Файл: Физика изучение спектра излучения атома водорода Методические указания к лабораторной работе Электронный учебный материал Минск 2020.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.01.2024
Просмотров: 155
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
 α-частицы назад. Однако, если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в nраз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона увеличилась бы в
α-частицы назад. Однако, если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в nраз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона увеличилась бы вкул
n2 раз ( F
). Эти соображения привели Резерфорда к выводу, что весь
положительный заряд атома сосредоточен в малом объеме. Именно эта часть атома была названа
атомнымядром.
В результате, опыты Резерфорда с сотрудниками привели к созданию ядерной(илипланетарной)моделиатома(см. рисунок 3), согласно которой в центре атома находится плотное положительно заряженное ядро (содержащее около 99,95 % массы атома), диаметр которого не превышает 10–14–10–15 м. Атом в целом нейтрален: отрицательный заряд электронов компенсируется положительным зарядом ядра. Электроны, подобно планетам, вращаются по орбитам вокруг ядра под действием кулоновских сил. Электроны не могут находиться в состоянии покоя, ибо в этом случае они должны притянуться к ядру.
Однако, несмотря на все достоинства, модель Резерфорда содержала в себе одно важное противоречие: она оказалась неспособной объяснить сам факт длительного существования атома, т.е. его устойчивость. Действительно, по законам классической электродинамики, электрон, движущийся с ускорением вокруг ядра, должен излучать электромагнитные волны, уносящие энергию электрона. Это означает, что за короткое время (порядка 10–8с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. Однако этого не происходит в устойчивых
состояниях атома. Отсюда следует вывод о том, что планетарная модель атома в классической физике оказывается недостоверной и внутренние процессы в атоме не подчиняются классическим законам физики. Истинная картина строения атома стала известна позднее.
-
ПостулатыБора
Выполненные к тому времени оптические эксперименты показали, что спектры
излучения (испускания) атомов состоят из отдельных узких спектральных линий, и их называют линейчатыми. Кроме того, эти спектральные линии расположены не беспорядочно, а образуют серии линий. Так, для атома водорода было открыто несколько спектральных серий, детальное рассмотрение которых будет представлено ниже. Объяснение этих спектральных закономерностей в рамках классической физики оказалось невозможным.
В итоге, неустойчивость атома в планетарной модели Резерфорда и удивительные закономерности спектров испускания атомов привели Н. Боракформулировкев1913г.двухважнейшихпостулатов:
Первый постулат – постулат стационарных состояний. Электронватомеможетдвигатьсятолькопоопределенным(разрешенным)стационарныморбитам,каждойизкоторыхможноприписатьопределенныйномерn=1,2,3…Атомприэтомнепоглощаетинеизлучает энергию, а находится в стационарном состоянии с неизменнойполнойэнергиейEn.
, n
1, 2, 3 (1)
где n – номер орбиты электрона, Ln – величина момента импульса электрона на n-й орбите, me- масса электрона, n–линейная скорость электрона на n-й орбите, а r– её радиус.
h
Это означает, что движущийся по стационарной замкнутой орбите электрон, вопреки законам классической электродинамики, не излучает энергии.
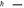 1 Приведенная постоянная Планка
1 Приведенная постоянная Планка 2
, где h= 6,62607004∙10-34 Дж∙с – постоянная Планка.
Второй постулат – правило частот Бора. При переходе атома из одногостационарногосостояния вдругоеэлектрониспускаетилипоглощаетквантэлектромагнитногоизлучения(фотон).
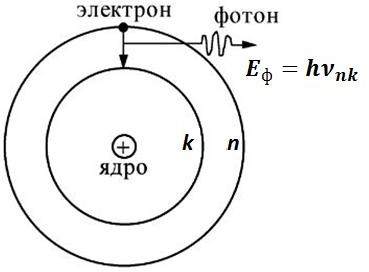 Если переход происходит на более низкий энергетический уровень, фотон излучается и уносит избыток энергии (см. рисунок 4). При этом частота излучения атома определяется разностью энергий атома в двух стационарных состояниях, т.е.
Если переход происходит на более низкий энергетический уровень, фотон излучается и уносит избыток энергии (см. рисунок 4). При этом частота излучения атома определяется разностью энергий атома в двух стационарных состояниях, т.е.Eф hnk En Ek, при n k. (2)
Такое же соотношение выполняется и в случае поглощения, когда падающий фотон с энергией h nkпереводит атом с
Рисунок 4. Излучение фотона при переходе атома в стационарное состояние с меньшей энергией
нижнего энергетического уровня (состояния) k на более высокий уровень n, а сам при этом исчезает.
Из соотношения (2) следует, что атомпереходитизодногостационарного состояния в другое скачками (их называют квантовыми). Отметим, что переходы атома на более высокие энергетические уровни могут также происходить и при неупругих столкновениях с другими атомами. Вместе с тем, постулаты Бора не дают ответа на вопрос, что происходит с атомом в процессе перехода, этот вопрос остается открытым.
-
АтомводородапоБору
Для объяснения результатов спектральных закономерностей в спектрах испускания атома водорода ядро атома рассматривается неподвижным, а электронные орбиты – круговыми орбитами. Запишем второй закон Ньютона для вращения электрона с массой meпо круговой орбите радиуса r под действием кулоновской силы притяжения со стороны ядра (выполняющей роль центростремительной силы) и формулу Бора (1) для квантования момента импульса электрона
m 2 1 e2
r
e n


rn 40 n
(3)
L m r n
n enn
Решая эту систему уравнений, находим для радиусов стационарных орбит электрона в атоме водорода следующее выражение
e
me2
n 1, 2,3
(4)
Вводя в качестве универсальной константы так называемый боровский радиус a (как радиус первой стационарной орбиты, n=1, электрона в атоме водорода)
10
a0 0,529 10 м, (5)
0
me2
формулу (4) можно записать в виде:
n
(6)
Для скорости электрона на n-ой стационарной орбите из (3) получаем значение
e
2
 n
n. (7)
n
Отсюда находим, в частности, что на первой стационарной орбите
электрон движется со скоростью оборот за время Т1=1,510-16 с.
2,2 106 м/с, совершая один полный
Соответственно, полная энергия Enэлектрона, движущегося по n-ой
стационарной орбите, складывается из его кинетической энергии
кин
m 2
me4