Файл: Методические рекомендации по выполнению контрольной работы по дисциплине Химия.docx
Добавлен: 12.01.2024
Просмотров: 276
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
4 + H2SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
г) Ацетат аммония – соль слабой кислоты и слабого основания. При растворении в воде ацетат аммония диссоциирует на ионы NH4+ и анионы CH3COO–. Так как NH4OH – слабый электролит, катионы NH4+ связывают анионы OH–,образуя слабое основание. Ионы CH3COO–, связываясь с катионами H+ воды, образуют слабую кислоту CH3COOH. Гидролиз идет по катиону слабого основания и аниону слабой кислоты. Сокращенное (и полное) ионно-молекулярное уравнение имеет вид:
CH3COO– + NH4++ H2O CH3COOH + NH4OH
CH3COOH + NH4OH
Гидроксид аммония при образовании неустойчив и разлагается на аммиак и воду
NH4OH NH3↑+ H2O
NH3↑+ H2O
молекулярное уравнение:
CH3COONH4 + H2O CH3COOH + NH3↑+ H2O
CH3COOH + NH3↑+ H2O
В растворе появляется ионы водорода практически полностью связываются ацетат-ионами, а гидроксид-ионы, связываясь с катионом водорода из катиона аммония превращаются снова в молекулу воды. Поэтому раствор CH3COONH4 имеет почти нейтральную реакцию (рН ≈ 7).
=
Zn° (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg+ Zn2+ = Mg2+ + Zn
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
ЭДС = 0к – 0а = 0zn2+ /Zn - 0м82+ /Mg = -0,763 - (-2,37) = 1,607 В.
Пример 11.2. Рассчитайте ЭДС элемента CdCd2+||Cu2+Cu при концентрации ионов Cu2+ и Cd2+, равных соответственно 0,1 и 0,01 моль/л.
Решение.
Используя уравнения Нернста и данные табл. 11.1, рассчитываем электродные потенциалы кадмия и меди:
Сu2+/Cu = 0Сu2+/Cu +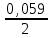 lg10-1 = 0,337 + 0,0295(–1) = 0,3075 В
lg10-1 = 0,337 + 0,0295(–1) = 0,3075 В
Сd2+/Cd = 0Сd2+/Cd +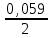 lg10-2 = –0,403 + 0,0295(–2) = –0,462 В
lg10-2 = –0,403 + 0,0295(–2) = –0,462 В
Так как Сd2+/Cd < Сu2+/Cu , то токообразующей в этом гальваническом элементе является реакция Cd0 + Cu2+ = Cd2+ + Cu0. Рассчитываем ЭДС элемента
E = Сu2+/Cu – Сd2+/Cd = 0,3075 – (–0,462 ) = 0,77 В.
Пример 11.3. Определите ЭДС концентрационного медного элемента с концентрациями ионов меди, равными 10–1 моль/л у одного электрода и 10–3 моль/л у другого при 298 К.
Решение.
Схема такого гальванического элемента CuCu2+||Cu2+Cu. По уравнению Нернста рассчитываем потенциалы двух медных электродов.
Сu2+/Cu = 0Сu2+/Cu + lg10-1 = 0,337 + 0,0295(–1) = 0,3075 В
lg10-1 = 0,337 + 0,0295(–1) = 0,3075 В
Сu2+/Cu = 0Сu2+/Cu + lg10-3 = 0,337 + 0,0295(–3) = 0,2485 В
lg10-3 = 0,337 + 0,0295(–3) = 0,2485 В
Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле:
E = к – а = 0,3075 – 0,2485 = 0,059 В.
Таблица 11.1.
Стандартные электродные потенциалы (o) при 25oС
и электродные реакции для некоторых металлов
Пример 11.4. Как изменится масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте молекулярные и ионные уравнения соответствующих реакций.
Решение.
В соответствии с положением ряду напряжений (табл. 11.1) ионы меди и свинца по отношению к цинку будут проявлять окислительную активность. При контакте с растворами CuSO4 и Pb(NO3)2 будут протекать реакции растворения цинка и осаждения соответствующего металла:
а) CuSO4 + Zn = Cu + ZnSO4; Cu2+ + Zn = Cu + Zn2+
б) Pb(NO3)2 + Zn = Pb + Zn(NO3)2; Pb2+ + Zn = Pb + Zn2+
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка (табл. 11.1). Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn2+. Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 11.5. Исходя из значений стандартных электродных потенциалов и G0х.р.,укажите, можно ли в гальваническом элементе осуществить реакцию
Pb2+ + Ti = Pb + Ti2+.
Составьте схему гальванического элемента, напишите уравнения электродных реакций.
Решение.
В соответствии с предложенным уравнением реакции схему гальванического элемента можно представить следующим образом:
(–)TiTi2+||Pb2+Pb(+). Уравнения электродных реакций имеют вид:
на аноде: Ti0 – 2ē Ti2+
на катоде: Pb2++ 2ē Pb0
Рассчитываем стандартное значение ЭДС:
E 0 = 0к – 0а = 0Pb2+/Pb – 0Ti2+
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
г) Ацетат аммония – соль слабой кислоты и слабого основания. При растворении в воде ацетат аммония диссоциирует на ионы NH4+ и анионы CH3COO–. Так как NH4OH – слабый электролит, катионы NH4+ связывают анионы OH–,образуя слабое основание. Ионы CH3COO–, связываясь с катионами H+ воды, образуют слабую кислоту CH3COOH. Гидролиз идет по катиону слабого основания и аниону слабой кислоты. Сокращенное (и полное) ионно-молекулярное уравнение имеет вид:
CH3COO– + NH4++ H2O
Гидроксид аммония при образовании неустойчив и разлагается на аммиак и воду
NH4OH
молекулярное уравнение:
CH3COONH4 + H2O
В растворе появляется ионы водорода практически полностью связываются ацетат-ионами, а гидроксид-ионы, связываясь с катионом водорода из катиона аммония превращаются снова в молекулу воды. Поэтому раствор CH3COONH4 имеет почти нейтральную реакцию (рН ≈ 7).
Пример 9.5. Какие продукты получатся при смешивании растворов а) AlCl3 и Na2S? б) A1(NO3)3 и К2СО3? Составьте ионно-молекулярные и молекулярные уравнения реакций.
Решение.
А) Соль AlCl3 гидролизуется по катиону, Na2S – по аниону:
Al3+ + H2O  AlOH2+ + H+
AlOH2+ + H+
S2– + H2O  HS–+OH–
HS–+OH–
Образующиеся ионы H+ и OH– связываются в молекулы слабого электролита H2O, сдвигая гидролитическое равновесие вправо. Гидролиз идет до конца с образованием Al(OH)3 и H2S. Ионно-молекулярные и молекулярное уравнение имеют вид:
2Al3+ + 3S2–- + 6H2O = 2Al(OH)3 + 3H2S
2Al3+ + 6Cl– + 6Na+ +3S2- + 6H2O = 2Al(OH)3 + 3H2S + 6Na+ + 6Cl–
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S+ 6NaCl
Б) Соль A1(NO3)3 гидролизуется по катиону, а К2СО3 — по аниону:
А13+ + Н2О = АlOН2+ + H+
СО32-+ Н2О = НСО3- + ОН-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН- образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
2А13+ + ЗСО32- + ЗН2О = 2А1(ОН)3 + ЗСО2
молекулярное уравнение:
2A1(NO3)3 + ЗК2СО3 + ЗН2О = 2А1(ОН)3 + ЗСО2+ 6KNO3
Контрольные вопросы
171. Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Fe3+ + 3OH– = Fe(OH)3 б) H+ + NO2– = HNO2 в) Cu2+ + S2– = CuS
172. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООК, KI, ZnSO4, A1(NO3)3 NH4Cl. Какое значение рН (7 < рН < 7) имеют растворы этих солей?
173. Смешивают попарно растворы: а) Cu(NO3)2 и Na2SO4; б) BaCl2 и K2SO4; в) NaHCO3 и NaOH; г) Cu(OH)2 и HCl. В каких из приведенных случаев реакции практически пойдут до конца? Составьте для этих реакций молекулярные и ионно-молекулярные уравнения. Укажите цвет фенолфталеина в 3 растворе?
174. Смешивают попарно растворы: а) KOH и Ba(NO3)2; б) Li2CO3 и HCl; в) Pb(NO3)2 и KCl; г) NH4Cl и KOH. В каких случаях реакции практически пойдут до конца? Представьте их в молекулярном и ионно-молекулярном виде.
175. Подберите по два уравнения в молекулярном виде к каждому из ионно-молекулярных уравнений: а) Fe3+ + 2H2O  Fe(OH)2+ + 2H+
Fe(OH)2+ + 2H+
б) CO32– + H2O  HCO3– + OH– в) NH4+ + H2O
HCO3– + OH– в) NH4+ + H2O  NH4OH + H+
NH4OH + H+
176. Составьте ионно-молекулярное и молекулярное уравнение гидролиза FeCl3. К раствору добавили следующие вещества: а) НС1; б) КОН; в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
177. Какие из приведенных солей: Na2SO3, СН3СООNa, KBr, AlCl3, NH4NO2 подвергаются гидролизу по катиону, по аниону, по катиону и аниону? Укажите pH среды, составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
178. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2SO3 и HCl; б) CH3COOH и KOH; в) Na2HPO4 и NaOH; г) Al(OH)3 и KOH.
179. Смешивают попарно растворы: а) K2SO3 и HCl; б) Na2SO4 и KCl; в) CH3COONa и HNO3; г) Al2(SO4)3 и избыток KOH. В каких из приведенных случаев реакции практически пойдут до конца? Составьте для этих реакций молекулярные и ионно-молекулярные уравнения.
180. К раствору A12(SO4)3 добавили следующие вещества: а) H2SO4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
181. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaCIO; MgCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
182. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CH3COONa и H2SO4; б) NH4Cl и NaOH; в) Ba(OH)2 и K2CrO4; г) CaCl2 и Na3PO4.
183. Составьте ионно-молекулярное и молекулярное уравнение гидролиза Cr2(SO4)3. К раствору добавили следующие вещества: а) H2SO4; б) KOH. В каком случае гидролиз сульфата хрома усилится? Почему?
184. Какие из веществ будут взаимодействовать с гидроксидом калия: Ba(OH)2, Zn(OH)2, FeCl3, H3PO4? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
185. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и CuSO4; б) AgNO3 и NH4Cl; в) Na2SiO3 и H3РO4; г) CaCO3 и HNO3. В какой цвет будет окрашен метиловый оранжевый в этих растворах?
186. Какие из приведенных солей: KCN, MgCl2, Cr(NO3)3, KNO3, ZnSO4 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей, укажите реакцию среды. В какой цвет будет окрашен лакмус в этих растворах?
187. Подберите по два уравнения в молекулярном виде к каждому из ионно-молекулярных уравнений: а) Al3+ + H2O  AlOH2+ + H+
AlOH2+ + H+
б) S2– + H2O  HS– + OH– в) CN–+ H2O
HS– + OH– в) CN–+ H2O  HCN +OH–
HCN +OH–
188. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, CuCl2, NH4CH3COO, LiBr? Для каждой из гидролизующихся солей напишите уравнение гидролиза в ионно-молекулярном и молекулярном виде, укажите реакцию среды ее водного раствора.
189. Какое значение рН (7< рН < 7) имеют растворы солей Na2S, СН3СООNa, A1C13, Pb(NO3)2, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
190. К раствору Na2CO3 добавили следующие вещества: а) НС1; б) NaOH; в) Cu(NO3)2; г) K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
191. Какие из солей KI, Cu(NO3)2, KNO2, NH4CN, CrCl3 подвергаются гидролизу? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей, укажите реакцию среды.
192. Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) OH– + HS– = H2O + S2–
б) CO32– + 2H+ = H2O + CO2 в) OH– + NH4+ = NH4OH
193. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCI2? Почему? Составьте ионно-молекулярные уравнения гидролиза этих солей.
194. Какое значение рН (7< рН < 7) имеют растворы солей Na3PO4, K2S, Cs2CO3, CuSO4 NaCl? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
195. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и H2SO4; б) Ba(NO3)2 и K3РO4; в) Cu(OH)2 и HNO3; в) AgNO3 и SnCl2. В какой цвет будет окрашен метиловый оранжевый в этих растворах?
10. Окислительно-восстановительные реакции. Примеры решения задач
Пример 10.1. Исходя из степени окисления (я) азота, серы и марганца в соединениях NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2 и КМnО4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение.
Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S) соответственно равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мп) соответственно равна: + 4 (промежуточная), +7 (высшая). Отсюда: NH3, H2S — только восстановители; HNO3, H2SO4, KMnO4 — только окислители; HNO2, H2SO3, MnO2 — окислители и восстановители.
Пример 10.2. Могут ли происходит окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) MnO2 и HCl; в) H2SO3 и НСЮ4? г) MnO2 и NaBiO3? д) H2SO4 и HClO4?
Решение.
а) в H2S с.о.(S) = -2; в HI с.о.(I) = -1. Так как и сера, и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут (реакция между ними невозможна);
б) в MnO2 с.о. (Mn) = +4 (промежуточная); в HCl с.о. (Cl) = –1 (низшая). Следовательно, взаимодействие этих веществ возможно, причем MnO2 является окислителем, а HCl будет восстановителем;
в) в H2SO3 с.о.(S) = +4 (промежуточная); в НС1О4 с.о.(С1) = +7 (высшая). Взятые вещества могут взаимодействовать, H2SO3 в этом случае будет проявлять восстановительные свойства;
г) в MnO2 с.о. (Mn) = +4 (промежуточная); NaBiO3 с.о. (Bi) = +5 (высшая). Взятые вещества могут взаимодействовать. MnO2 проявляет свойства восстановителя.
д) в H2SO4 с.о.(S) = +6; в HClO4 с.о.(Cl) = +7. Так как и сера, и хлор находятся в своей высшей степени окисления, то оба вещества проявляют только свойства окислителяи и взаимодействовать друг с другом не могут (реакция между ними невозможна).
Пример 10.3. Составьте уравнения окислительно-восстановительных реакций, идущие по схемам:
а) КМnО4 + Н3РО3 + H2SO4 →MnSO4 + Н3РО4 + K2SO4 + Н2О
б) KClO3 KCl + O2
в) К2MnO4 + H2О КMnO4 + MnO2 + КOН
На основании электронных или электронно-ионных уравнений расставьте коэффициенты. Определите тип реакции, окислитель и восстановитель для каждой реакции.
Решение.
а) Определяем степени окисления тех элементов, которые ее изменяют:
KMn+7O4+ Н3Р+3О3+H2SO4 Mn+2SO4+ Н3Р+5О4 +K2SO4+H2O
Составляем электронные уравнения процессов окисления и восстановления, определяем окислитель и восстановитель:
восстановитель Р +3 - 2ē
= Р +5 5 окисление
10
окислитель Mn+7 + 5ē → Mn+2 2 восстановление
Уравниваем реакцию методом электронного баланса, суть которого заключается в том, что общее число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Находим общее наименьшее кратное для отданных и принятых электронов. В приведенной реакции оно равно 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициенты перед веществами, атомы которых не меняют свои степени окисления, находим подбором.
Уравнение реакции будет иметь вид:
2КМnО4 + 5Н3РО3 + 3H2SO4 = 2MnSO4 + 5Н3РО4 + K2SO4 + ЗН2О
б) 2KCl+5O3–2 = 2KCl–1 + 3O2o
восстановитель 2O–2 – 4ē → O20 3 окисление
12
окислитель Cl+5 + 6ē → Cl–1 2 восстановление
в) 3K2Mn+6O4 + 2H2O = 2KMn+7O4 + Mn+4O2 + 4КОН
восстановитель Mn+6 –1ē →Mn+7 2 окисление
2
окислитель Mn+6 + 2ē → Mn+4 1 восстановление
Как видно из представленных уравнений в реакции (а) окислитель и восстановитель – разные элементы в молекулах двух разных веществ, значит, данная реакция относится к типу межмолекулярных окислительно-восстановительных реакций. В реакции (б) окислитель – хлор и восстановитель – кислород содержатся в одной молекуле – реакция внутримолекулярная. В реакции (в) роль окислителя и восстановителя выполняет марганец, следовательно, это реакция диспропорционирования.
Контрольные вопросы
196. Исходя из степени окисления серы в веществах: S, H2S, Na2SO3, H2SO4, определите, какое из них является только окислителем, только восстановителем и какие могут быть и окислителем и восстановителем. Почему? На основании электронных уравнений подберите коэффициенты в уравнении реакции, идущей по схеме:
KI + KIO3+ H2SO4 I2+ K2SO4 + H2O
Определите тип окислительно-восстановительной реакции.
197. Реакции выражаются схемами:
KNO2 + KI + H2 SO4 KNO3 + I2+ K2SO4 + H2 O
NaNO3 NaNO 2 + O2
Составьте электронные уравнения, расставьте коэффициенты, определите окислитель и восстановитель в каждой реакции. К какому типу относится каждая из приведенных реакций?
198. См. условие задания 197.
H2S + K2Cr2O7 + H2SO4 S + Cr2(SO4)3 + K2SO4 + H2 O
S + KOH K2S + K2SO3 + H2O
199. См. условие задания 197.
Na2SO3 + Na2S + H2SO4 S + Na2SO4 + H2O
KMnO4 K2MnO4 + MnO2 + O2
200. См. условие задания 197.
H3AsO3 + KMnO4 + H2SO4 H3AsO4 + MnSO4 + K2SO4 + H2O
AgNO3 Ag + NO2 + O2
201. См. условие задания 197.
(NH4)2Cr2O7 N2 + Cr2O3 + H2O
P + HNO3 + H2O H3PO4 + NO
202. См. условие задания 197.
KBr + KBrO3+ H2SO4 Br2 + K2 SO4 + H2O
NH4NO3 N2O + H2O
203. См. условие задания 197.
Ba(OH)2 + I2 Ba(IO3)2 + BaI2 + H2 O
MnSO4 + PbO2 + HNO3 HMnO4 + Pb(NO3)2 + PbSO4 + H2O
204. См. условие задания 197.
MnSO4 + KClO3 + KOH K2MnO4 + KCl + K2SO4 + H2O
Ni(NO3)2 NiO + NO2 + O2
205. Исходя из степени окисления хлора в соединениях НС1, HClO, НСlO3, НС1О4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
КCl + КClО3 + H2SO4 → Cl2 + K2SO4 + Н2О
Определите тип окислительно-восстановительной реакции.
206. Исходя из степени окисления железа, определите, какое из веществ может быть только восстановителем, только окислителем и какое – и окислителем и восстановителем: FeSO4, Fe2O3, K2FeO4. Почему? На основании электронных уравнений подберите коэффициенты для веществ в уравнении реакции, идущей по схеме:
CrCl3 + Br2 + NaOH Na2CrO4 + NaBr + NaCl + H2O
Определите тип окислительно-восстановительной реакции.
207. Исходя из степени окисления хрома, иода и серы в соединениях K2Cr2O7, KI и H2SO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
Определите тип окислительно-восстановительной реакции.
208. Могут ли протекать окислительно-восстановительные реакции между веществами: а) Cl2 и H2S; б) KBr и KBrO; в) HI и NH3? Почему? На основании электронных уравнений подберите коэффициенты, реакции, идущей по схеме:
NaCrO2 + PbO2 + NaOH Na2CrO4 + Na2PbO2 + H2O
Определите тип окислительно-восстановительной реакции.
209. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление происходит при следующих превращениях:
P–3 P+5; N+3 N–3; Cl– ClO3–; SO42– S–2
Реакция выражается схемой:
KMnO4 + H2S + H2SO4 MnSO4 + S +K2SO4 + H2O
Определите окислитель и восстановитель, на сновании электронных уравнений расставьте коэффициенты в уравнении реакции. Определите тип окислительно-восстановительной реакции.
210. Mогут ли происходить окислительно-восстановительные реакции между веществами: а) H2S и Br2 ; б) HI и HIO3; в) KMnO4 и K2Cr2O7? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
H2O2 + KMnO4 + H2SO4 O2 + MnSO4 + K2SO4 + H2O
Определите тип окислительно-восстановительной реакции.
211. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление происходит при следующих превращениях:
BrO4– Br2; Bi BiO3–; VO3–V; Si –4 Si +4.
На основании электронных уравнений подберите коэффициенты в уравнении реакции, идущей по схеме:
Al + KMnO4 + H2SO4 Al2(SO4)3 + MnSO4 + K2SO4 + H2O
Определите тип окислительно-восстановительной реакции.
212. Могут ли происходить окислительно-восстановитлеьные реакции между веществами: а) РН3 и НВг; б) К2Сr2О7 и Н3РО3; в) HNO3 и H2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
AsH3 + HNO3 → H3AsO4 + NO2 + Н2О
Определите тип окислительно-восстановительной реакции.
213. Могут ли идти окислительно-восстановительные реакции между следующими веществами а) PbO2 и KBiO3; б) Н2S и Н2SO3; в) H2SO3 и HClO4? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
P + KOH K3PO4 + K3P + H2O
Определите тип окислительно-восстановительной реакции.
214. Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O
Определите тип окислительно-восстановительной реакции.
215. Реакции выражаются схемами:
Zn + HNO3 (разб) Zn(NO3)2 + N2O + H2O
SnCl2 + K2Cr2O7 + H2SO4 Sn (SO4) 2 + CrCl3 + K2SO4 + H2O
Составьте электронные уравнения, подберите коэффициенты, укажите, какое вещество в каждой реакции является окислителем, какое восcтановителем.
Определите тип окислительно-восстановительных реакций.
216. См. условие задачи 215.
P + HNO3 + H2O → H3PO4 + NO
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
217. См. условие задачи 215.
K2Cr2O7 + HC1 → Cl2 + CrCl3 + KC1 + H2O
Au + HNO3 + HC1 → AuCl3 + NO + H2O
218. См. условие задачи 215.
H2SO3 + НСlO3 → H2SO4 + HC1
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
219. См. условие задачи 215.
NaCrO2+ Br2 + NaOH → Na2CrO4 + NaBr + H2O
FeS + HNO3 → Fe(NO3)2 + S + NO + H2O
220. См. условие задачи 215.
FeSO3 + HNO3 → Fe(NO3)3 + Fe2(SO4)3 + NO2 + H2O
Na2SO3 + КМnО4 + Н2О → Na2SO4 + MnO2 + КОН
221. См. условие задания 215.
Сu2О + HNO3 → Cu(NO3)2 + NO + Н2О
H2S + H2SO3 S + H2O
222. См. условие задачи 215.
MnSO4 + РbО2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O
NH4NO2 N2 + H2O
223. См. условие задачи 215.
Cl2 + КОН → К2СlO4 + КС1 + Н2О
K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 + Н2О
224. См. условие задачи 215.
HNO3 + Zn → N2O + Zn(NO3)2 + H2O
K2Cr2O7 + H3PO3 + H2SO4 →Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
225. Могут ли происходить окислительно-восстановительные реакции между веществами: a) NH3 и КМnО4; б) HNO2 и HI; в) НС1 и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
КМnО4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
Укажите, какое вещество в реакции является окислителем, а какое - восстановителем.
11.Электродныепотенциалы. Гальванические элементы. Примеры решения задач
При решении задач этого раздела см. табл. 11.1.
Пример 11.1. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение.
Схема данного гальванического элемента
(-) Mg | Mg2+ || Zn2+ | Zn (+)
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний (табл.11.1) имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg°-2e" = Mg2+ (1)
Цинк, потенциал которого -0,763 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2е
=
Пример 9.5. Какие продукты получатся при смешивании растворов а) AlCl3 и Na2S? б) A1(NO3)3 и К2СО3? Составьте ионно-молекулярные и молекулярные уравнения реакций.
Решение.
А) Соль AlCl3 гидролизуется по катиону, Na2S – по аниону:
Al3+ + H2O
S2– + H2O
Образующиеся ионы H+ и OH– связываются в молекулы слабого электролита H2O, сдвигая гидролитическое равновесие вправо. Гидролиз идет до конца с образованием Al(OH)3 и H2S. Ионно-молекулярные и молекулярное уравнение имеют вид:
2Al3+ + 3S2–- + 6H2O = 2Al(OH)3 + 3H2S
2Al3+ + 6Cl– + 6Na+ +3S2- + 6H2O = 2Al(OH)3 + 3H2S + 6Na+ + 6Cl–
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S+ 6NaCl
Б) Соль A1(NO3)3 гидролизуется по катиону, а К2СО3 — по аниону:
А13+ + Н2О = АlOН2+ + H+
СО32-+ Н2О = НСО3- + ОН-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН- образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
2А13+ + ЗСО32- + ЗН2О = 2А1(ОН)3 + ЗСО2
молекулярное уравнение:
2A1(NO3)3 + ЗК2СО3 + ЗН2О = 2А1(ОН)3 + ЗСО2+ 6KNO3
Контрольные вопросы
171. Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Fe3+ + 3OH– = Fe(OH)3 б) H+ + NO2– = HNO2 в) Cu2+ + S2– = CuS
172. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООК, KI, ZnSO4, A1(NO3)3 NH4Cl. Какое значение рН (7 < рН < 7) имеют растворы этих солей?
173. Смешивают попарно растворы: а) Cu(NO3)2 и Na2SO4; б) BaCl2 и K2SO4; в) NaHCO3 и NaOH; г) Cu(OH)2 и HCl. В каких из приведенных случаев реакции практически пойдут до конца? Составьте для этих реакций молекулярные и ионно-молекулярные уравнения. Укажите цвет фенолфталеина в 3 растворе?
174. Смешивают попарно растворы: а) KOH и Ba(NO3)2; б) Li2CO3 и HCl; в) Pb(NO3)2 и KCl; г) NH4Cl и KOH. В каких случаях реакции практически пойдут до конца? Представьте их в молекулярном и ионно-молекулярном виде.
175. Подберите по два уравнения в молекулярном виде к каждому из ионно-молекулярных уравнений: а) Fe3+ + 2H2O
б) CO32– + H2O
176. Составьте ионно-молекулярное и молекулярное уравнение гидролиза FeCl3. К раствору добавили следующие вещества: а) НС1; б) КОН; в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
177. Какие из приведенных солей: Na2SO3, СН3СООNa, KBr, AlCl3, NH4NO2 подвергаются гидролизу по катиону, по аниону, по катиону и аниону? Укажите pH среды, составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
178. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2SO3 и HCl; б) CH3COOH и KOH; в) Na2HPO4 и NaOH; г) Al(OH)3 и KOH.
179. Смешивают попарно растворы: а) K2SO3 и HCl; б) Na2SO4 и KCl; в) CH3COONa и HNO3; г) Al2(SO4)3 и избыток KOH. В каких из приведенных случаев реакции практически пойдут до конца? Составьте для этих реакций молекулярные и ионно-молекулярные уравнения.
180. К раствору A12(SO4)3 добавили следующие вещества: а) H2SO4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
181. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaCIO; MgCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
182. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CH3COONa и H2SO4; б) NH4Cl и NaOH; в) Ba(OH)2 и K2CrO4; г) CaCl2 и Na3PO4.
183. Составьте ионно-молекулярное и молекулярное уравнение гидролиза Cr2(SO4)3. К раствору добавили следующие вещества: а) H2SO4; б) KOH. В каком случае гидролиз сульфата хрома усилится? Почему?
184. Какие из веществ будут взаимодействовать с гидроксидом калия: Ba(OH)2, Zn(OH)2, FeCl3, H3PO4? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
185. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и CuSO4; б) AgNO3 и NH4Cl; в) Na2SiO3 и H3РO4; г) CaCO3 и HNO3. В какой цвет будет окрашен метиловый оранжевый в этих растворах?
186. Какие из приведенных солей: KCN, MgCl2, Cr(NO3)3, KNO3, ZnSO4 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей, укажите реакцию среды. В какой цвет будет окрашен лакмус в этих растворах?
187. Подберите по два уравнения в молекулярном виде к каждому из ионно-молекулярных уравнений: а) Al3+ + H2O
б) S2– + H2O
188. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, CuCl2, NH4CH3COO, LiBr? Для каждой из гидролизующихся солей напишите уравнение гидролиза в ионно-молекулярном и молекулярном виде, укажите реакцию среды ее водного раствора.
189. Какое значение рН (7< рН < 7) имеют растворы солей Na2S, СН3СООNa, A1C13, Pb(NO3)2, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
190. К раствору Na2CO3 добавили следующие вещества: а) НС1; б) NaOH; в) Cu(NO3)2; г) K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
191. Какие из солей KI, Cu(NO3)2, KNO2, NH4CN, CrCl3 подвергаются гидролизу? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей, укажите реакцию среды.
192. Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) OH– + HS– = H2O + S2–
б) CO32– + 2H+ = H2O + CO2 в) OH– + NH4+ = NH4OH
193. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCI2? Почему? Составьте ионно-молекулярные уравнения гидролиза этих солей.
194. Какое значение рН (7< рН < 7) имеют растворы солей Na3PO4, K2S, Cs2CO3, CuSO4 NaCl? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
195. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и H2SO4; б) Ba(NO3)2 и K3РO4; в) Cu(OH)2 и HNO3; в) AgNO3 и SnCl2. В какой цвет будет окрашен метиловый оранжевый в этих растворах?
10. Окислительно-восстановительные реакции. Примеры решения задач
Пример 10.1. Исходя из степени окисления (я) азота, серы и марганца в соединениях NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2 и КМnО4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение.
Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S) соответственно равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мп) соответственно равна: + 4 (промежуточная), +7 (высшая). Отсюда: NH3, H2S — только восстановители; HNO3, H2SO4, KMnO4 — только окислители; HNO2, H2SO3, MnO2 — окислители и восстановители.
Пример 10.2. Могут ли происходит окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) MnO2 и HCl; в) H2SO3 и НСЮ4? г) MnO2 и NaBiO3? д) H2SO4 и HClO4?
Решение.
а) в H2S с.о.(S) = -2; в HI с.о.(I) = -1. Так как и сера, и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут (реакция между ними невозможна);
б) в MnO2 с.о. (Mn) = +4 (промежуточная); в HCl с.о. (Cl) = –1 (низшая). Следовательно, взаимодействие этих веществ возможно, причем MnO2 является окислителем, а HCl будет восстановителем;
в) в H2SO3 с.о.(S) = +4 (промежуточная); в НС1О4 с.о.(С1) = +7 (высшая). Взятые вещества могут взаимодействовать, H2SO3 в этом случае будет проявлять восстановительные свойства;
г) в MnO2 с.о. (Mn) = +4 (промежуточная); NaBiO3 с.о. (Bi) = +5 (высшая). Взятые вещества могут взаимодействовать. MnO2 проявляет свойства восстановителя.
д) в H2SO4 с.о.(S) = +6; в HClO4 с.о.(Cl) = +7. Так как и сера, и хлор находятся в своей высшей степени окисления, то оба вещества проявляют только свойства окислителяи и взаимодействовать друг с другом не могут (реакция между ними невозможна).
Пример 10.3. Составьте уравнения окислительно-восстановительных реакций, идущие по схемам:
а) КМnО4 + Н3РО3 + H2SO4 →MnSO4 + Н3РО4 + K2SO4 + Н2О
б) KClO3 KCl + O2
в) К2MnO4 + H2О КMnO4 + MnO2 + КOН
На основании электронных или электронно-ионных уравнений расставьте коэффициенты. Определите тип реакции, окислитель и восстановитель для каждой реакции.
Решение.
а) Определяем степени окисления тех элементов, которые ее изменяют:
KMn+7O4+ Н3Р+3О3+H2SO4 Mn+2SO4+ Н3Р+5О4 +K2SO4+H2O
Составляем электронные уравнения процессов окисления и восстановления, определяем окислитель и восстановитель:
восстановитель Р +3 - 2ē
Zn° (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg+ Zn2+ = Mg2+ + Zn
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
ЭДС = 0к – 0а = 0zn2+ /Zn - 0м82+ /Mg = -0,763 - (-2,37) = 1,607 В.
Пример 11.2. Рассчитайте ЭДС элемента CdCd2+||Cu2+Cu при концентрации ионов Cu2+ и Cd2+, равных соответственно 0,1 и 0,01 моль/л.
Решение.
Используя уравнения Нернста и данные табл. 11.1, рассчитываем электродные потенциалы кадмия и меди:
Сu2+/Cu = 0Сu2+/Cu +
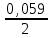 lg10-1 = 0,337 + 0,0295(–1) = 0,3075 В
lg10-1 = 0,337 + 0,0295(–1) = 0,3075 ВСd2+/Cd = 0Сd2+/Cd +
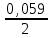 lg10-2 = –0,403 + 0,0295(–2) = –0,462 В
lg10-2 = –0,403 + 0,0295(–2) = –0,462 ВТак как Сd2+/Cd < Сu2+/Cu , то токообразующей в этом гальваническом элементе является реакция Cd0 + Cu2+ = Cd2+ + Cu0. Рассчитываем ЭДС элемента
E = Сu2+/Cu – Сd2+/Cd = 0,3075 – (–0,462 ) = 0,77 В.
Пример 11.3. Определите ЭДС концентрационного медного элемента с концентрациями ионов меди, равными 10–1 моль/л у одного электрода и 10–3 моль/л у другого при 298 К.
Решение.
Схема такого гальванического элемента CuCu2+||Cu2+Cu. По уравнению Нернста рассчитываем потенциалы двух медных электродов.
Для первого электрода:
Сu2+/Cu = 0Сu2+/Cu +
 lg10-1 = 0,337 + 0,0295(–1) = 0,3075 В
lg10-1 = 0,337 + 0,0295(–1) = 0,3075 ВДля второго электрода:
Сu2+/Cu = 0Сu2+/Cu +
 lg10-3 = 0,337 + 0,0295(–3) = 0,2485 В
lg10-3 = 0,337 + 0,0295(–3) = 0,2485 ВПервый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле:
E = к – а = 0,3075 – 0,2485 = 0,059 В.
Таблица 11.1.
Стандартные электродные потенциалы (o) при 25oС
и электродные реакции для некоторых металлов
Электрод | Электродная реакция | o , В | Электрод | Электродная реакция | o, В |
| Li+/Li | Li+ + ē = Li | –3,045 | Cd2+/Cd | Cd2+ + 2ē = Cd | –0,403 |
| Rb+/Rb | Rb+ + ē = Rb | –2,925 | Co2+/Co | Co2+ + 2ē = Co | –0,277 |
| K+/K | K+ + ē = K | –2,924 | Ni2+/Ni | Ni2+ + 2ē = Ni | –0,250 |
| Cs+/Cs | Cs+ + ē = Cs | –2,923 | Sn2+/Sn | Sn2+ + 2ē = Sn | –0,136 |
| Ba2+/Ba | Ba2+ + 2ē = Ba | –2,906 | Pb2+/Pb | Pb2+ + 2ē = Pb | –0,126 |
| Ca2+/Ca | Ca2+ + 2ē = Ca | –2,866 | Fe3+/Fe | Fe3+ + 3ē = Fe | –0,036 |
| Na+/Na | Na+ + ē = Na | –2,714 | 2H+/H2 | 2H+ + 2ē = H2 | 0,000 |
| Mg2+/Mg | Mg2+ + 2ē = Mg | –2,363 | Bi3+/Bi | Bi3+ + 3ē = Bi | +0,215 |
| A13+/A1 | Al3+ + 3ē = Al | –1,662 | Cu2+/Cu | Cu2+ + 2ē = Cu | +0,337 |
| Ti2+/Ti | Ti2+ + 2ē = Ti | –1,628 | Ag+/Ag | Ag+ + ē = Ag | +0,799 |
| Mn2+/Mn | Mn2+ + 2ē = Mn | –1,180 | Hg2+/Hg | Hg2+ + 2ē = Hg | +0,854 |
| Zn2+/Zn | Zn2+ + 2ē = Zn | –0,763 | Pt2+/Pt | Pt2+ + 2ē = Pt | +1,190 |
| Cr3+/Cr | Cr3+ + 3ē = Cr | –0,744 | Au3+/Au | Au3+ + 3ē = Au | +1,498 |
| Fe2+/Fe | Fe2+ + 2ē = Fe | –0,440 | Au+/Au | Au+ + ē = Au | +1,691 |
Пример 11.4. Как изменится масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте молекулярные и ионные уравнения соответствующих реакций.
Решение.
В соответствии с положением ряду напряжений (табл. 11.1) ионы меди и свинца по отношению к цинку будут проявлять окислительную активность. При контакте с растворами CuSO4 и Pb(NO3)2 будут протекать реакции растворения цинка и осаждения соответствующего металла:
а) CuSO4 + Zn = Cu + ZnSO4; Cu2+ + Zn = Cu + Zn2+
б) Pb(NO3)2 + Zn = Pb + Zn(NO3)2; Pb2+ + Zn = Pb + Zn2+
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка (табл. 11.1). Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn2+. Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 11.5. Исходя из значений стандартных электродных потенциалов и G0х.р.,укажите, можно ли в гальваническом элементе осуществить реакцию
Pb2+ + Ti = Pb + Ti2+.
Составьте схему гальванического элемента, напишите уравнения электродных реакций.
Решение.
В соответствии с предложенным уравнением реакции схему гальванического элемента можно представить следующим образом:
(–)TiTi2+||Pb2+Pb(+). Уравнения электродных реакций имеют вид:
на аноде: Ti0 – 2ē Ti2+
на катоде: Pb2++ 2ē Pb0
Рассчитываем стандартное значение ЭДС:
E 0 = 0к – 0а = 0Pb2+/Pb – 0Ti2+