Файл: Методические рекомендации по выполнению контрольной работы по дисциплине Химия.docx
Добавлен: 12.01.2024
Просмотров: 279
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
| 33 | 8 | 34 | 56 | 74 | 97 | 124 | 134 | 163 | 183 | 209 | 226 | 261 | 274 | 283 |
| 34 | 9 | 35 | 55 | 75 | 98 | 125 | 133 | 162 | 185 | 208 | 244 | 262 | 273 | 282 |
| 35 | 10 | 36 | 54 | 76 | 99 | 126 | 136 | 161 | 184 | 201 | 236 | 261 | 272 | 281 |
| 36 | 11 | 37 | 53 | 77 | 94 | 127 | 135 | 170 | 187 | 210 | 239 | 250 | 271 | 280 |
| 37 | 12 | 38 | 52 | 78 | 95 | 128 | 138 | 169 | 186 | 200 | 243 | 251 | 270 | 279 |
| 38 | 13 | 39 | 51 | 79 | 96 | 129 | 137 | 168 | 188 | 209 | 238 | 258 | 269 | 278 |
| 39 | 14 | 40 | 65 | 80 | 91 | 130 | 140 | 167 | 190 | 202 | 240 | 259 | 268 | 277 |
| 40 | 15 | 41 | 64 | 81 | 92 | 119 | 139 | 166 | 189 | 199 | 242 | 262 | 267 | 276 |
| 41 | 16 | 42 | 63 | 82 | 93 | 117 | 131 | 156 | 191 | 202 | 245 | 260 | 275 | 284 |
| 42 | 17 | 43 | 62 | 83 | 109 | 118 | 132 | 157 | 192 | 201 | 235 | 263 | 274 | 285 |
| 43 | 18 | 44 | 61 | 84 | 110 | 119 | 133 | 158 | 194 | 203 | 241 | 256 | 273 | 288 |
| 44 | 19 | 45 | 60 | 85 | 107 | 120 | 134 | 159 | 193 | 198 | 244 | 264 | 272 | 289 |
| 45 | 20 | 46 | 59 | 86 | 108 | 121 | 135 | 160 | 171 | 205 | 231 | 257 | 271 | 278 |
| 46 | 21 | 47 | 65 | 87 | 105 | 122 | 137 | 161 | 172 | 203 | 240 | 265 | 270 | 279 |
| 47 | 22 | 48 | 64 | 88 | 106 | 123 | 136 | 162 | 174 | 204 | 239 | 250 | 269 | 290 |
| 48 | 23 | 49 | 63 | 89 | 103 | 124 | 138 | 163 | 173 | 197 | 228 | 254 | 268 | 291 |
| 49 | 24 | 50 | 62 | 90 | 104 | 125 | 139 | 164 | 175 | 196 | 239 | 246 | 267 | 280 |
| 50 | 25 | 26 | 61 | 66 | 101 | 126 | 140 | 165 | 174 | 204 | 241 | 255 | 266 | 281 |
| 51 | 1 | 28 | 60 | 68 | 102 | 127 | 142 | 166 | 171 | 205 | 242 | 247 | 266 | 292 |
| 52 | 2 | 29 | 59 | 69 | 99 | 128 | 141 | 167 | 177 | 208 | 238 | 253 | 267 | 293 |
| 53 | 3 | 30 | 58 | 70 | 96 | 129 | 143 | 168 | 178 | 207 | 243 | 248 | 268 | 282 |
| 54 | 4 | 31 | 57 | 71 | 97 | 130 | 144 | 169 | 179 | 206 | 241 | 252 | 269 | 283 |
| 55 | 5 | 32 | 56 | 72 | 98 | 111 | 145 | 170 | 180 | 206 | 242 | 249 | 270 | 294 |
| 56 | 6 | 33 | 55 | 73 | 100 | 112 | 147 | 151 | 181 | 217 | 243 | 253 | 271 | 295 |
| 57 | 7 | 34 | 54 | 74 | 91 | 113 | 146 | 152 | 182 | 216 | 244 | 265 | 272 | 276 |
| 58 | 8 | 35 | 53 | 75 | 93 | 114 | 148 | 153 | 183 | 219 | 230 | 254 | 273 | 277 |
| 59 | 9 | 36 | 52 | 76 | 94 | 115 | 149 | 154 | 184 | 207 | 237 | 246 | 274 | 286 |
| 60 | 10 | 37 | 51 | 77 | 95 | 116 | 150 | 155 | 185 | 225 | 229 | 255 | 275 | 287 |
| 61 | 11 | 38 | 54 | 78 | 92 | 117 | 136 | 155 | 186 | 215 | 231 | 247 | 268 | 292 |
| 62 | 12 | 39 | 53 | 79 | 100 | 118 | 134 | 154 | 187 | 214 | 248 | 256 | 269 | 293 |
| 63 | 13 | 40 | 52 | 80 | 101 | 119 | 133 | 153 | 188 | 208 | 232 | 248 | 272 | 294 |
| 64 | 14 | 41 | 51 | 81 | 102 | 120 | 132 | 152 | 189 | 218 | 247 | 252 | 273 | 295 |
| 65 | 15 | 42 | 60 | 82 | 103 | 121 | 131 | 151 | 190 | 213 | 233 | 249 | 266 | 286 |
| 66 | 16 | 43 | 59 | 83 | 104 | 122 | 150 | 170 | 191 | 212 | 240 | 257 | 267 | 287 |
| 67 | 17 | 44 | 58 | 84 | 105 | 123 | 149 | 169 | 192 | 209 | 234 | 250 | 270 | 288 |
| 68 | 18 | 45 | 57 | 85 | 106 | 124 | 148 | 168 | 193 | 224 | 239 | 251 | 271 | 289 |
| 69 | 19 | 46 | 56 | 86 | 107 | 125 | 147 | 167 | 194 | 211 | 235 | 258 | 274 | 290 |
| 70 | 20 | 47 | 55 | 87 | 108 | 126 | 146 | 166 | 195 | 222 | 231 | 261 | 275 | 291 |
| 71 | 21 | 48 | 65 | 88 | 109 | 127 | 145 | 165 | 171 | 210 | 232 | 262 | 271 | 281 |
| 72 | 22 | 49 | 64 | 89 | 110 | 128 | 144 | 164 | 172 | 221 | 233 | 259 | 272 | 282 |
| 73 | 23 | 50 | 63 | 90 | 91 | 129 | 143 | 163 | 173 | 220 | 234 | 263 | 273 | 283 |
| 74 | 24 | 26 | 62 | 66 | 92 | 130 | 142 | 162 | 174 | 224 | 235 | 247 | 274 | 284 |
| 75 | 25 | 27 | 61 | 67 | 94 | 111 | 141 | 161 | 175 | 211 | 238 | 264 | 275 | 285 |
| 76 | 1 | 29 | 60 | 69 | 95 | 112 | 140 | 160 | 177 | 223 | 236 | 249 | 266 | 276 |
| 77 | 2 | 30 | 54 | 70 | 96 | 113 | 139 | 159 | 176 | 196 | 237 | 260 | 267 | 277 |
| 78 | 3 | 31 | 53 | 71 | 97 | 114 | 138 | 158 | 179 | 223 | 230 | 265 | 268 | 278 |
| 79 | 4 | 32 | 52 | 72 | 98 | 115 | 137 | 157 | 178 | 212 | 231 | 248 | 269 | 279 |
| 80 | 5 | 33 | 51 | 73 | 99 | 116 | 135 | 156 | 181 | 222 | 236 | 246 | 270 | 280 |
| 81 | 6 | 34 | 55 | 74 | 110 | 117 | 134 | 156 | 180 | 197 | 237 | 261 | 270 | 295 |
| 82 | 7 | 35 | 56 | 75 | 109 | 118 | 133 | 157 | 183 | 225 | 238 | 259 | 269 | 294 |
| 83 | 8 | 36 | 57 | 76 | 108 | 119 | 132 | 158 | 182 | 213 | 239 | 258 | 268 | 292 |
| 84 | 9 | 37 | 58 | 77 | 107 | 120 | 131 | 159 | 185 | 221 | 240 | 260 | 267 | 293 |
| 85 | 10 | 38 | 59 | 78 | 106 | 121 | 150 | 160 | 184 | 206 | 229 | 262 | 266 | 291 |
| 86 | 11 | 39 | 65 | 79 | 105 | 122 | 149 | 161 | 186 | 202 | 236 | 255 | 275 | 290 |
| 87 | 12 | 40 | 64 | 80 | 104 | 123 | 148 | 162 | 187 | 214 | 228 | 257 | 274 | 278 |
| 88 | 13 | 41 | 63 | 81 | 103 | 124 | 147 | 163 | 189 | 198 | 235 | 249 | 273 | 279 |
| 89 | 14 | 42 | 62 | 82 | 102 | 125 | 146 | 164 | 188 | 205 | 227 | 256 | 272 | 277 |
| 90 | 15 | 43 | 61 | 83 | 101 | 126 | 145 | 165 | 191 | 220 | 241 | 263 | 271 | 276 |
| 91 | 16 | 44 | 60 | 84 | 100 | 127 | 144 | 166 | 190 | 215 | 242 | 254 | 271 | 276 |
| 92 | 17 | 45 | 59 | 85 | 99 | 128 | 143 | 155 | 192 | 204 | 243 | 248 | 272 | 295 |
| 93 | 18 | 46 | 58 | 86 | 98 | 129 | 142 | 154 | 193 | 199 | 244 | 253 | 275 | 277 |
| 94 | 19 | 47 | 57 | 87 | 97 | 130 | 141 | 153 | 195 | 201 | 245 | 264 | 274 | 294 |
| 95 | 20 | 48 | 56 | 88 | 96 | 111 | 140 | 152 | 194 | 216 | 234 | 252 | 273 | 291 |
| 96 | 21 | 49 | 55 | 89 | 95 | 112 | 139 | 151 | 174 | 219 | 226 | 247 | 266 | 278 |
| 97 | 22 | 50 | 54 | 90 | 94 | 113 | 138 | 170 | 175 | 200 | 233 | 250 | 267 | 293 |
| 98 | 23 | 26 | 53 | 66 | 93 | 114 | 137 | 169 | 171 | 203 | 245 | 246 | 268 | 280 |
| 99 | 24 | 27 | 52 | 67 | 92 | 115 | 136 | 168 | 172 | 217 | 232 | 251 | 269 | 279 |
| 00 | 25 | 28 | 51 | 68 | 91 | 116 | 135 | 167 | 173 | 218 | 226 | 265 | 270 | 292 |
Контрольные задания
1. Строение атома. Примеры решения задач
Пример 1.1. Запишите электронную конфигурацию ионов Fe3+ и S2–.
Решение. Электронная конфигурация атома железа 26Fe 1s22s22p63s23p63d64s2. Если атом железа отдаст три электрона, он превратится в ион: Fe0 – 3e → Fe3+. В первую очередь атом отдает электроны с более высокого энергетического уровня и подуровня. Электронная конфигурация ионов Fe3+ имеет вид 1s22s22p63s23p63d54s0. Электронная конфигурация атома серы 16S 1s22s22p63s2 3p4. Приняв два электрона S0 + 2e → S2–, атом серы превращается в ион S2–, электронная конфигурация которого 1s22s22p63s23p6.
Пример 1.2. Составьте электронные формулы атома элемента с порядковым номером 22. Покажите распределение электронов этого атома по квантовым (энергетическим) ячейкам.
Решение. Порядковый номер 22 в периодической системе соответствует титану (Ti) Следовательно, положительный заряд ядра равен +22 и столько же электронов в атоме титана. Поскольку титан находится в 4 периоде, электроны располагаются на 4-х энергетических уровнях следующим образом: 22Ti 2е, 8е, 10е, 2е. Запись электронной конфигурации атома титана по уровням и подуровням имеет вид: 1s22s22p63s23p63d24s2.
В соответствии с правилом Хунда электроны на d-подуровне у атома титана располагаются следующим образом:
 .
.
На предвнешнем энергетическом уровне атома титана содержится три свободные d-орбитали.
Пример 1.3. Какие орбитали атома заполняются электронами раньше 5d или 6s; 4f или 6p?
Решение. Последовательность заполнения орбиталей осуществляется в соответствии с правилом Клечковского и определяется суммой (n+l). Для подуровня 5d сумма (n+l) равна (5+2) = 7, для подуровня 6s (6+0) = 6. В первую очередь заполняются орбитали с меньшей энергией, следовательно, вначале заполняется 6s, потом 5d. Для подуровней 4f и 6р сумма (n+l) одинакова (4+3) = 7 и (6+1) = 7. При одинаковом значении суммы (
n+l) раньше заполняется подуровень с меньшим n, следовательно, 4f.
Пример 1.4. Возможно ли наличие в атоме двух электронов с одинаковыми значениями трех квантовых чисел: l, ml, ms? Приведите примеры.
Решение. Да, возможно, т.к. это не противоречит принципу Паули. Два электрона, характеризующиеся одинаковыми значениями трех квантовых чисел l, ml, ms, должны отличаться главным квантовым числом n. Например, в атоме фтора, электронная конфигурация которого 1s22s22p5, для электронов 1s1 и 2s1 квантовые числа будут иметь следующие значения:
Для 1s1 n = 1, l = 0, ml = 0, ms = ½.
Для 2s1 n = 2, l = 0, ml = 0, ms = ½.
Пример 1.5. Охарактеризуйте квантовыми числами электроны состояния 3р3.
Решение. Изобразим графически распределение электронов состояния
3р3:
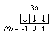 . Каждый электрон в атоме характеризуется набором четырех квантовых чисел: n, l, ml, ms. Главное квантовое число n обозначается арабской цифрой. Для указанных электронов главное квантовое число n равно 3. Электроны находятся на р-подуровне, следовательно, для всех трех электронов l=1. Три электрона находятся на разных орбиталях, которые ориентированы по трем разным направлениям. Ориентацию АО в пространстве определяет магнитное квантовое число ml, значение которого зависит от орбитального квантового числа l. Если l=1, ml принимает значение –1, 0, 1 (значение ml указано под каждой орбиталью). Спиновое квантовое число ms принимает значения +½ и –½. Таким образом, электроны состояния 3р3 характеризуются следующими квантовыми числами:
. Каждый электрон в атоме характеризуется набором четырех квантовых чисел: n, l, ml, ms. Главное квантовое число n обозначается арабской цифрой. Для указанных электронов главное квантовое число n равно 3. Электроны находятся на р-подуровне, следовательно, для всех трех электронов l=1. Три электрона находятся на разных орбиталях, которые ориентированы по трем разным направлениям. Ориентацию АО в пространстве определяет магнитное квантовое число ml, значение которого зависит от орбитального квантового числа l. Если l=1, ml принимает значение –1, 0, 1 (значение ml указано под каждой орбиталью). Спиновое квантовое число ms принимает значения +½ и –½. Таким образом, электроны состояния 3р3 характеризуются следующими квантовыми числами:n= 3, l= 1, ml= –1, ms= ½ (или –½)
n= 3, l= 1, ml= 0, ms= ½ (или –½)
n= 3, l= 1, ml= 1, ms= ½ (или –½)
Контрольные вопросы.
1. Напишите электронные формулы атомов элементов с порядковыми номерами 17 и 23. Покажите распределение валентных электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
2. Среди приведенных ниже электронных конфигураций укажите невозможные и объясните причину невозможности их реализации: а) 1р3; б) 3р6; в) 3s2; г) 2s2; д) 2d5; е) 5d2; ж) 3f12; з) 2р4; и) 3р7. Напишите электронную конфигурацию атома элемента с порядковым номером 34.
3. Какие орбитали атома заполняются электронами раньше: 4 dили 5s; 6sили 5р? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
4. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 47, учитывая, что у первого происходит «провал» одного s-электрона на З-й подуровень. Чему равен максимальный спин d-электронов у атомов первого и p-электронов у атомов второго элемента?
5. В чем заключается принцип Паули? Может ли на подуровне р находиться 8, а на подуровне d 13 электронов? Почему? Напишите электронную конфигурацию атома элемента с порядковым номером 51 и укажите его валентные электроны.
6. Назовите элементы, внешний энергетический уровень атомов которых выражается электронной конфигурацией np5. Напишите полную электронную конфигурацию 4 атома из этих элементов и укажите их электронное семейство.
7. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 46. Чему равен максимальный спин p-электронов у атомов первого и d-электронов у атомов второго элемента?
8. Квантовые числа для электронов внешнего энергетического уровня атомов некоторых элементов имеют следующие значения: п = 4; l = 0; mt = 0; ms= ± 1/2. Напишите электронные формулы атомов этих элементов и определите, сколько свободных 3d-орбиталей содержит каждый из них.
9. Какое максимальное число электронов могут занимать s
р-, d- и f - орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 49.
10. Напишите электронные формулы атомов элементов с порядковыми номерами 11 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
11. Запишите электронные конфигурации нейтральных атомов по заданным электронным конфигурациям ионов: а) 1s22s22p63s23p63d104s24p6 (Э–); б) 1s22s22p63s23p63d64s0 (Э3+); в) 1s22s22p63s23p63d104s24p64d105s25p6 (Э2–); г) 1s22s22p63s23p64s0 (Э2+). Укажите символы и названия элементов, для которых приведены электронные конфигурации.
12. Покажите графически распределение электронов в атомах с конфигурацией d4 в основном состоянии. Определите суммарное значение ms четырех электронов. Напишите электронную конфигурацию атома элемента с порядковым номером 45 и укажите его валентные электроны.
13. Напишите электронные конфигурации атомов элементов с порядковыми номерами 13 и 27. Чему равен максимальный спин р-электронов у атомов первого и d-электронов у атомов второго элемента?
14. Какие из электронных конфигураций, отражающих строение невозбужденного атома некоторого элемента, неверны: а) 1s22s22p63s3; б) 1s22s22p4; в) 1s22s22p63s23p63d44s1; г) 1s22s22p63s23p64s1; д) 1s22s22p63s23f2? Почему? Атомам каких элементов отвечают правильно составленные электронные конфигурации?
15. Какие значения могут принимать квантовые числа n, l, ml иms, характеризующие состояние электрона в атоме? Какие значения они принимают для внешних электронов атома бария? Напишите электронную конфигурацию его атома.
16. Напишите электронные конфигурации атомов элементов с порядковыми номерами 14 и 40. Сколько свободных