ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.03.2019
Просмотров: 639
Скачиваний: 2
23
Рис.6. Амилоид может накапливаться
в надпочечниках, также как и в
других
органах.
Здесь
видны
отложения амилоида, окрашенные
конго - красным в красный цвет.
В
сердце
амилоид
обнаруживается
под
эндокардом, в строме и сосудах
миокарда, а также в эпикарде по
ходу вен (кардиопатический
вариант амилоидоза). Сердце становится плотным, имеет сальный вид.
Амилоидоз поражает также скелетные мышцы, легкие, головной мозг,
поджелудочную и щитовидную
железы (Рис.7).
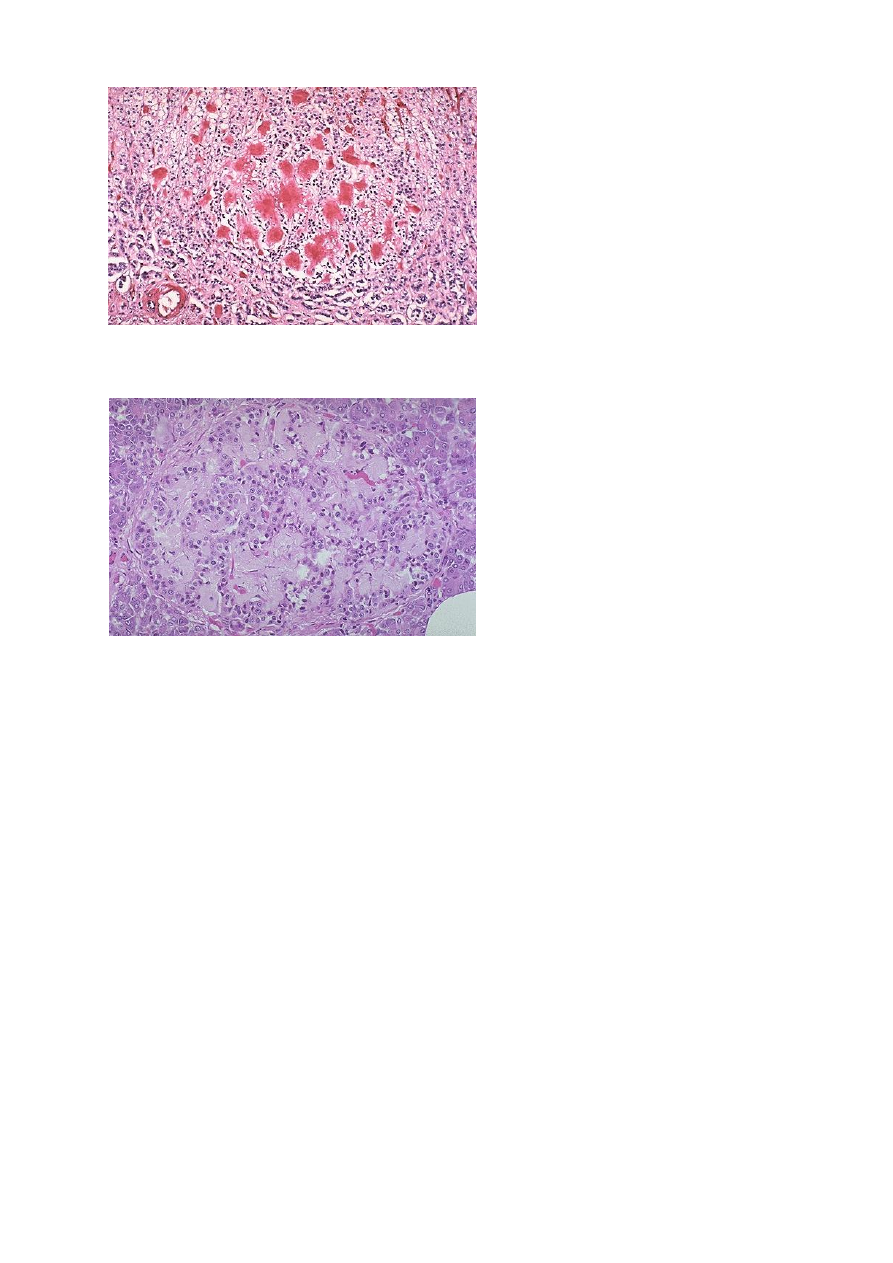
Рис.7. В островках Лангерганса
видны розовые гиалинизированные
участки с красными включениями
амилоида. Эти изменения характерны
для больных с сахарным диабетом II
типа.
Амилоидоз стромы часто встречается в опухолях эндокринных
органов или APUD-системы (апудомах), медуллярном раке щитовидной
железы, инсуломе, карциноме, феохромоцитоме, опухолях каротидных
телец, хромофобной аденоме гипофиза, гипернефроидном раке. Показано,
что эпителиальные опухолевые клетки образуют APUD-амилоид.
Классификация амилоидоза.
1. Приобретенный идиопатический (первичный) амилоидоз. Причина и
механизм не известны. Может проявляться в виде генерализованного,
нефропатического,
гепатопатического,
нейропатического,
кардиопатического типов.
2. Наследственный (генетический, семейный) амилоидоз.
3. Приобретенный (вторичный) амилоидоз. Встречается наиболее часто и
развивается на фоне какого-либо заболевания (хронические инфекции,
болезни, связанные с деструктивными процессами). Среди них:
туберкулез; хронические неспецифические заболевания легких;
остеомиелит, в том числе туберкулезный; длительно незаживающие
гнойные раны; злокачественные заболевания; ревматические болезни (в
первую очередь, ревматоидный артрит); заболевания крови (миеломная
болезнь, лимфогранулематоз и др.).
4. Приобретенный старческий амилоидоз. Поражает сердце, артерии
головного мозга.
24
Патогенез амилоидоза.
В настоящее время выделено несколько различных видов
специфического фибриллярного белка амилоида (AA-, AL-, FAP-, ASC
1
-
формы). На основании биохимических и гистохимических исследований
выделили четыре группы генерализованного амилоидоза. К АА-
амилоидозу
относят
вторичный
амилоидоз,
наследственный
(периодическая болезнь) и синдром Мак-Уэльса. АL-амилоидоз включает
неопластическую плазмоклеточную дискразию и первичный амилоидоз.
FАР-амилоидоз представлен семейной амилоидной полинейропатией. К
АSС
1
-амилоидозу относится старческий семейный амилоидоз.
В крови найдены белки, являющиеся предшественниками
фибриллярных белков амилоида (АА, АL, FАР, АSС
1
). Предшественником
АА-белка является сывороточный амилоидный белок (SАА), который
относится к белкам острой фазы. В нормальных условиях содержание
SАА в сыворотке крови очень мало. Количество этого белка увеличивается
в сотни раз при воспалении или повреждении ткани. Синтезируется SАА-
белок преимущественно гепатоцитами. Количество SАА в сыворотке
крови регулируется активностью макрофагальной системы, с другой
стороны SАА усиливает активность Т-киллеров и стимулирует синтез
антител. При стихании острого процесса часть SАА деградирует в
гепатоцитах. Другая часть этого белка фильтруется в почечных клубочках,
причем часть SАА может реабсорбироваться. Иногда его обнаруживают в
подоцитах и мезангии, т.е. в клетках обладающих фагоцитарными
свойствами. Особенность фильтрации и реабсорбции белка SАА почками
позволяет понять нефропатический тип АА-амилоидоза, в том числе
вторичного.
Предшественником АL-белка фибрилл амилоида являются легкие
цепи иммуноглобулинов и их фрагментов. Белок амилоидных фибрилл
образуется двумя путями. В одном случае нарушение деградации
моноклональных легких цепей ведет к появлению пептидов, которые
путем агрегации и полимеризации превращаются в амилоидные
фибриллы. Эти фибриллы относительно резистентны к протеиназам и
накапливаются в соединительной ткани. Во втором случае в легких цепях
возникают замены аминокислот и появляются неполноценные легкие цепи
способные к образованию аномального белка.
При
FAP-амилоидозе
предшественником
амилоидного
фибриллярного белка является преальбумин плазмы, в котором
встречаются различные аминокислотные замены. В отличие от других
форм амилоидоза содержание преальбумина в сыворотке крови больных
FАР-амилоидозом снижено в несколько раз, в то время как отмечается
высокое содержание преальбумина в спиномозговой жидкости. Этот
феномен связывают с усиленным синтезом альбумина хориоидальным
эпителием, что вызывает симптомы полинейропатии. Снижение уровня

25
преальбумина в сыворотке крови происходит из-за усиленного
расходования предшественника на построение амилоидного белка.
При старческом амилоидозе предшественником белка фибрилл АSС
1
является сывороточный преальбумин. В старческом возрасте в связи с
нарушениями в синтезе преальбумина, повышается способность
последнего к образованию АSС
1.
При этом наблюдается снижение уровня
сывороточного преальбумина в крови.
Патогенез АА-амилоидоза. Активированные макрофаги через
интерлейкин 1 приводят к усиленному синтезу гепатоцитами
сывороточного амилоидного белка, уровень которого резко увеличивается
в крови. В ответ на это макрофаги начинают усиленное разрушение SАА,
но быстро возникает ферментативная недостаточность, которая приводит
к неполной деградации, в результате чего появляется фибриллярный белок
АА или его фрагменты. В дальнейшем на поверхности макрофагов –
амилоидобластов происходит агрегация фибрилл амилоида из белка АА
или его фрагментов.
Патогенез АL-амилоидоза включает синтез легких амилоидогенных
цепей
иммуноглобулинов
(с
нарушенной
деградацией
или
аминокислотными заменами) и последующий синтез из этих цепей
амилоидобластами
(плазматическими,
миеломными
клетками
и
макрофагами) амилоидных фибрилл.
Стромально-сосудистые жировые дистрофии (липидозы).
Возникают при нарушении обмена нейтральных жиров и
холестерина. Нейтральные жиры лабильны. Они обеспечивают
энергетические запасы организма. Жировая ткань сосредоточена в
жировом депо (подкожная клетчатка, брыжейка, сальник, эпикард,
костный мозг). Стромально-сосудистые (мезенхимальные) жировые
дистрофии проявляются либо избыточным накоплением нейтрального
жира в жировом депо, либо в патологическом уменьшении его количества,
либо в появлении его в тканях, где в норме его нет.
Наибольшее значение имеет общее ожирение, при котором
увеличивается масса нейтрального жира в организме. Причиной могут
быть заболевания ЦНС, гипоталамуса, гипофиза и других эндокринных
органов. Избыточное питание является причиной алиментарного
ожирения.
Важное значение в патологии имеет ожирение сердца, при котором
жир откладывается под эпикардом и между пучками мышечных клеток.
Особенно это выражено в правой половине сердца. Сдавленные жиром
мышечные клетки атрофируются и
возможен разрыв стенки сердца.
Нарушение обмена холестерина
заключается
в
очаговом
накоплении его в интиме крупных
сосудов
из-за
повышенной
26
проницаемости интимы, что лежит в основе атеросклероза (Рис.8).
Рис.8. Атеросклеротическая бляшка в коронарной артерии с наличием скоплений
холестерина и других веществ.
Стромально-сосудистые углеводные дистрофии.
Связаны с нарушением обмена гликопротеидов и ГАГ и
проявляются развитием на месте соединительной ткани, хрящей, жировой
ткани слизеподобной массы. Гликопротеиды и ГАГ теряют белки и
накапливаются в межуточном веществе. Типичным примером является
слизистый отек – микседема при недостаточности щитовидной железы.
Дистрофия может быть обратимой, но прогрессирование ведет к некрозу.