Файл: Отчет по практике вид (тип) практики Преддипломная практика Курс (группа).docx
Добавлен: 11.01.2024
Просмотров: 193
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
1.3. Свойства пероксидазы хрена
1.4. Инактивация пероксидазы хрена
1.5. Методы выделения пероксидазы хрена
1.6. Применение пероксидазы хрена
2.1. Выделение пероксидазы хрена
2.2. Определение концентрации фермента
3.1. Выделение и концентрирование пероксидазы хрена
3.2. Количественное определение белка
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное
образовательное учреждение высшего образования
«Тульский государственный университет»
 Подразделение Кафедра «Химии» (наименование подразделения)
Подразделение Кафедра «Химии» (наименование подразделения)ОТЧЕТ ПО ПРАКТИКЕ
| Вид (тип) практики | Преддипломная практика |
| Курс (группа) | 4 (420491) |
| Направление подготовки (специальности) | 04.03.01 Химия |
| Ф.И.О. обучающегося | Лаврентьев Дмитрий Алексеевич |
| Место прохождения практики | Тульский Государственный Университет |
| Период прохождения практики | 24.01.2023-6.02.2023 |
Руководитель
практики от профильной организации
к.х.н., доцент Зайцев М.Г.

 (Ф.И.О., должность) ( подпись)
(Ф.И.О., должность) ( подпись)Руководитель
практики от подразделения
Горячева А.А., доцент кафедры химии

 (Ф.И.О., должность) ( подпись)
(Ф.И.О., должность) ( подпись)г. Тула, 2023 г.
РЕФЕРАТ
Отчёт 25 с., 4 рис., 8 табл., 15 источ.
ВЫДЕЛЕНИЕ ПЕРОКСИДАЗЫ ХРЕНА ИЗ КОРНЕЙ Armoraciarusticana, КОНЦЕНТРИРОВАНИЕ ФЕРМЕНТА И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Объектом исследования являются корни Armoraciarusticana.
Целью данной работы является выделение пероксидазы хрена из корней Armoraciarusticana, её количественное определение с последующим концентрированием.
Для достижения цели были поставлены следующие задачи:
-
Выделение пероксидазы хрена из корней Armoraciarusticana; -
Концентрирование фермента на концентрирующих фильтрах 10 кДа; -
Количественное определение методом Лоури.
Оглавление
Введение 5
1. Литературный обзор 6
1.1. Классификация пероксидаз 6
1.2. Пероксидаза хрена 7
1.3. Свойства пероксидазы хрена 9
1.4. Инактивация пероксидазы хрена 10
1.5. Методы выделения пероксидазы хрена 12
1.6. Применение пероксидазы хрена 13
1.6.1. Биосенсоры на основе пероксидазы хрена 13
1.6.2. Иммунобиосенсоры с пероксидазой хрена в качестве метки 15
1.6.3. ДНК-сенсоры с пероксидазой хрена в качестве метки 15
2. Экспериментальная часть 17
2.1. Выделение пероксидазы хрена 17
2.2. Определение концентрации фермента 17
3. Результаты и их обсуждения 18
3.1. Выделение и концентрирование пероксидазы хрена 18
3.2. Количественное определение белка 19
3.2.1. Количественное определение белка в растворенном осадке после высаливания 35% от насыщения сульфата аммония 22
3.2.2. Количественное определение белка в растворенном осадке после высаливания 70% от насыщения сульфата аммония 22
3.2.3. Количественное определение белка после концентрирования в растворенном осадке после высаливания 35% отнасыщения 23
3.2.4. Количественное определение белка после концентрирования в растворенном осадке после высаливания 70% отнасыщения 24
3.3. Концентрирование фермента 24
Выводы 25
Список литературы 26
Введение
Пероксидаза из корней хрена один из наиболее изученных и доступных ферментов класса оксидоредуктаз, обладающих групповой субстратной специфичностью и высокой каталитической активностью. Вследствие этого пероксидазу хрена широко используют для разработки ферментативных методик определения большого числа органических и неорганических веществ, являющихся ее субстратами и эффекторами, для аналитической биохимии и биотехнологии в качестве маркера антител, ДНК и низкомолекулярных соединений, а также в качестве фермента-маркера для иммуноферментного и иммуногистохимического анализа.
1. Литературный обзор
1.1. Классификация пероксидаз
Пероксидазы (КФ 1.11.1.Х) относятся к ферментам класса оксидоредуктаз. Они катализируют окисление широкого спектра субстратов под действием пероксида водорода. Молекулярная масса ферментов этого типа колеблется от 17 до 84 кДа, а длина полипептидной цепи – от 153 до 753 аминокислотных остатков. Белковая глобула обычно образована 10–11 α-спиралями, β-складки либо отсутствуют, либо представлены слабо [1].
Согласно общепринятой классификации, предложенной в 1992 г., пероксидазы подразделяются на два больших суперсемейства: животные пероксидазы и растительные. Суперсемейство растительных пероксидаз в свою очередь включает в себя 3 класса.
I класс растительных пероксидаз включает внутриклеточные ферменты, такие как аскорбатпероксидаза, дрожжевая цитохром C пероксидаза и бактериальная каталаза-пероксидаза. Эти белки не гликозилированы и не содержат ни дисульфидных связей, ни ионов кальция. Ко II классу относятся секретируемые грибные пероксидазы. Наиболее хорошо изученные представители этого класса – лигнинпероксидаза и марганецпероксидаза, принимающие участие в окислении лигнина, а также пероксидаза из Coprinus cine reus (навозник обыкновенный, предыдущее название Arthromyces ramosus). Эти ферменты являются мономерными гликопротеидами, для которых характерно наличие четырёх дисульфидных связей и двух консервативных кальций-связывающих доменов. III класс представлен секретируемыми пероксидазами растений. Эти ферменты также являются мономерными гликопротеидами, имеют четыре дисульфидные связи и два кальций-связывающих центра, однако расположение дисульфидных связей и «укладка» полипептидной цепи в пероксидазах второго и третьего классов несколько различаются [2].
1.2. Пероксидаза хрена
Изофермент С пероксидазы из корней хрена хрена (HRP – horse radish peroxidase) является безусловным лидером по популярности среди растительных пероксидаз. В настоящее время он рассматривается как модельный для третьего класса растительных пероксидаз. Несмотря на то, что по многим параметрам HRP уступает другим известным пероксидазам, этот фермент наиболее широко используется на практике.
В корнях хрена (Armoracia rusticana) содержится множество различных пероксидаз, но основная доля приходится на изофермент С, характеризующийся изоэлектрической точкой pI = 9 и проявляющий максимальную активность при рН = 6–8. Молекулярная масса HRP составляет около 44 кДа, 18–22% приходится на углеводную часть. Из девяти остатков Asn, по которым возможно присоединение углеводных цепей, как правило, гликозилированы восемь остатков (Asn 13, 57, 158, 186, 198, 214, 255 и 268) [3]. Состав углеводной части молекулы гетерогенен и зависит от многих факторов, например, от стадии и условий роста. Олигосахариды оказывают стабилизирующее воздействие на фермент. Они защищают фермент от протеолиза и модификации полипептидной цепи под действием свободных радикалов, образующихся в ходе реакции [2].
HRP C содержит два структурных домена, простетическая группа-гем (комплекс трехвалентногожелеза с протопорфирином IX). Группа-гема присоединена к ферменту в His170 (проксимальный остаток гистидина) посредство координационной связи между атомом N боковой цепи гистидина и атомом железа гема. Второй участок аксиальной координации (так называемой дистальной стороной плоскости гема) не занят в состоянии покоя фермента, но доступен для присоединения перекиси водорода во время реакций восстановления-окисления [4].
В структуре белковой глобулы имеются два домена – дистальный и проксимальный. Каждый из них содержит сайт связывания кальция, в которых катионы кальция удерживаются семью координационными связями. Важная структурная роль Ca2+ подтверждена многочисленными экспериментальными данными и результатами компьютерного моделирования. Так как центры связывания катионов кальция соединены системой водородных связей с активным центром фермента, удаление Ca2+ влечёт за собой серьёзные изменения в свойствах фермента. Дистальный катион связан менее прочно, чем проксимальный. Его удаление приводит к падению каталитической активности приблизительно в 2 раза и снижению термостабильности фермента, а также стабильности при экстремальных значениях рН и при хранении. Третичная структура молекулы при удалении дистального Ca
2+ претерпевает малые изменения. Полная потеря катионов кальция приводит к инактивация фермента вследствие серьезных конформационных изменений в активном центре [2].
Ион Fe3+ имеет 4 координационные связи внутри гема, пятое координационное положение занимает атом азота имидазольного кольца проксимального остатка His170. Шестое координационное положение в релаксированном состоянии фермента свободно, но в процессе катализа происходит присоединение пероксида водорода к атому железа, и комплекс становится шестикоординационным [2].
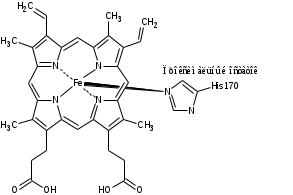
Рисунок1. Структура пероксидазы хрена
1.3. Свойства пероксидазы хрена
Особенностью процессов пероксидазного катализа является образование ряда спектрофотометрически различимых комплексов. Реакция пероксидазы представляет собой двухэлектронное окисление-восстановление с тремя различными стадиями. Упрощенная схема пероксидазного цикла выглядит следующим образом [5]:
HRP + H2O2 Соединение I + H2O (1)
Соединение I + AH2 Соединение II + AH• (2)
Соединение II + AH2 HRP + AH• (3)
Где AH2 – электрон-донорный субстрат, AH• – радикальный продукт реакции.
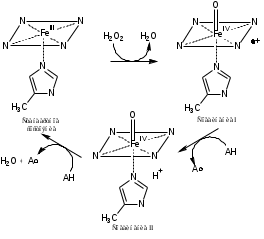
Рисунок 2. Цикл превращения пероксидазы хрена
Каталитический цикл гем-пероксидазы, специфичной для растений, начинается с координации пероксида с трехвалентным гемом (рис. 2). На первой стадии координированный пероксид подвергается быстрому гетеролитическому расщеплению с образованием молекулы воды и полустабильного промежуточного продукта, называемого соединением I (π-катион-радикалом, оксиферрилпорфирина). Реакция включает перенос протона с последующим разрывом связи О-О. Один кислород уходит в виде молекулы воды, а другой уже координирован с гемом. Он завершает свой октат, извлекая два наиболее легкодоступных электрона из фермента. Один электрон удаляется из железа, создавая оксиферрильный центр (Fe=O). Как правило, в случае большинства пероксидаз второй электрон удаляется из порфиринового кольца, образуя π-катионный радикал порфирина. Этот радикал порфирина принимает один электрон от электронодонорного субстрата, образуя свободный радикал субстрата и соединение II (называемое оксиферрилгемовым промежуточным продуктом). В следующем стадия одноэлектронного восстановления вторая молекулы субстрата восстанавливает соединение II до пероксидазы железа в стандартное состояние [5].
1.4. Инактивация пероксидазы хрена
Инактивация пероксидазы в ходе катализа может произойти из-за избытка H2O2. Этот процесс в значительной степени подавляется в присутствии восстановительных донорных субстратов (например, фенолов), поскольку они конкурируют с H2O2 за активные ферментативные промежуточные звенья [6].
Пероксидаза, реагирующая с большим избытком перекиси водорода дает полосу поглощения при λ=940 нм, которая со временем затухает. Затем появляется максимум поглощения при λ=670 нм, обусловлено это неактивной формой пероксидазы, названной Р-670. Причем образованию продукта с максимумом поглощения при λ=670 нм предшествует образование нескольких промежуточных форм [7].
В отсутствие обычных доноров электронов в системе HRP/H2O2 происходит разложение перекиси водорода (каталазное направление реакции). Сначала в результате реакции нативного фермента с перекисью водорода образуется соединение I. Затем соединение I, будучи сильным окислителем, вынуждает перекись водорода реагировать в качестве донора электронов. Восстановление соединения I перекисью водорода может пройти через:
-
Двух-электронный перенос с образованием O2; -
Одноэлектронный перенос, с образованием соединения II и супе-роксидного аниона.
В результате реакции соединения II с перекисью водорода образуется соединение III. Соединение III является промежуточной формой, в которой фермент защищен от окислительного воздействия избытка перекиси водорода. Прямые кинетические исследования инактивации фермента с использованием в качестве окислителя 30 различных органических перекисей, а в качестве восстановителя АБТС показали, что инактивирующим агентом является субстрат-окислитель. В этом случае вместо перекиси водорода на соединениях I и II окисляется субстрат - восстановитель, а соединение III не образуется [8].
Общая схема пероксидазного катализа с учетом возможности необратимой инактивации, окисляющим и восстанавливающим субстратами, выглядит следующим образом: конкуренция между гидропероксидом и восстановителем за соединение I и соединение II. Этим объясняется влияние отношения начальных концентраций субстратов на инактивацию фермента. Центральную роль в инактивации фермента гидроперекисью играет комплекс соединение I - ROOH. От этого соединения ведут два пути: каталитический путь к нативному ферменту через соединение II и инактивационный путь к неактивному ферменту. Если в качестве окислителя выступает перекись водорода, возможен другой каталитический путь, включающий генерацию кислорода (каталазный путь). Конкуренция между ROOH и восстановителем на уровне соединения II определяет образование соединения III. Превращение пероксидазы в соединение III происходит при 500-кратном мольном избытке перекиси водорода [9].