ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.07.2024
Просмотров: 364
Скачиваний: 0
СОДЕРЖАНИЕ
2. Описание лабораторного стенда и порядок выполнения работы
Измерение теплоёмкости воздуха
2. Описание лабораторного стенда
4. Обработка результатов измерения
2. Описание лабораторного стенда
4. Обработка результатов измерения
2. Описание лабораторного стенда
4. Обработка результатов измерения
1. Основные теоретические положения
2.1. Теплоотдача от горизонтальной трубы (поперечное обтекание)
Температурный коэффициент объёмного расширения:
Коэффициент кинематической вязкости:
2.2. Теплоотдача от вертикальной трубы (продольное обтекание)
Переходный режим (2320 Re 104)
2. Описание лабораторного стенда
4. Обработка результатов измерений
4. Описание лабораторного стенда

ИЗУЧЕНИЕ ОСНОВНЫХ ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССОВ ИДЕАЛЬНОГО ГАЗА
Цель работы: теоретическое и экспериментальное исследование процессов идеального газа на примере изохорного процесса воздуха.
Задания:
На основании полученных опытных данных построить экспериментальную и теоретическую зависимости P = f(T).
Определить изменение удельной внутренней энергии u и удельной энтропии s воздуха в процессе.
Определить максимальную ошибку опытных данных.
Основные положения
Термодинамическим процессом называется совокупность непрерывно изменяющихся состояний термодинамической системы.
Изучение любого термодинамического процесса включает определение следующих его основных характеристик:
уравнение процесса;
графическое изображение процесса на диаграммах состояния;
работу, совершаемую системой в процессе;
количество теплоты, участвующей в процессе;
изменение внутренней энергии системы;
изменение энтропии системы.
Основными термодинамическими процессами идеального газа являются следующие:
изохорный;
изобарный;
изотермический;
адиабатный;
политропный.
Изохорный процесс
При изохорном процессе выполняется условие dv = 0 или v = const. Из уравнения состояния идеального газа следует, что
![]() .
.
Таким образом,
![]() – уравнение процесса. (1)
– уравнение процесса. (1)
На рис. 1 представлен график процесса в p-v и T-S координатах.
р Т v S q q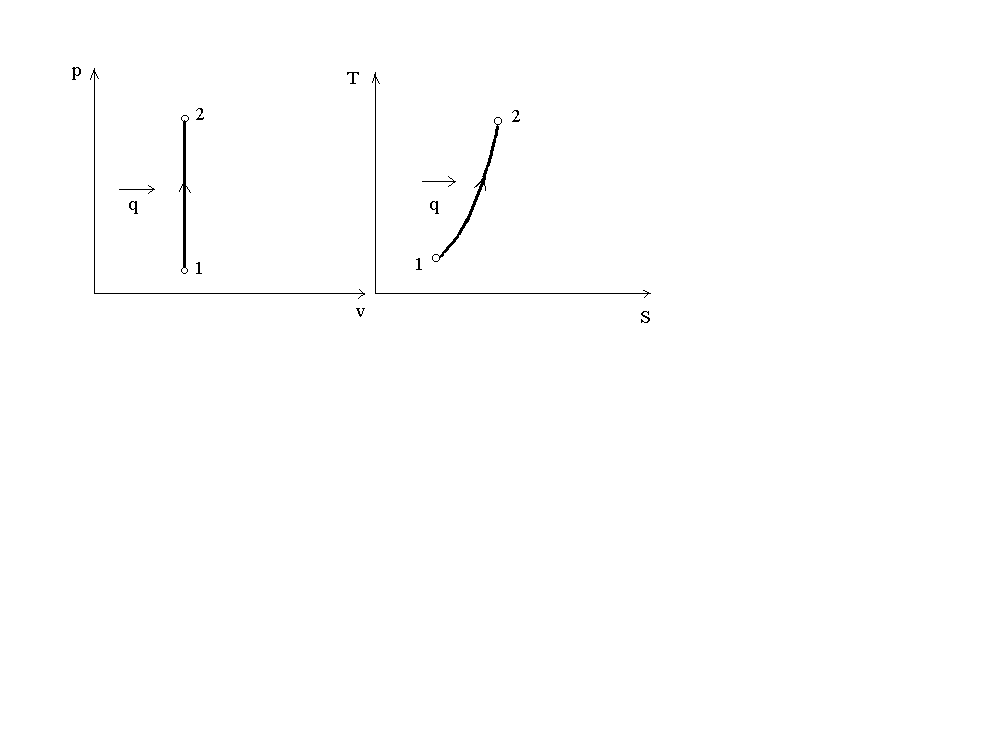
Рис. 1. График изохорного процесса
Работа изменения объёма
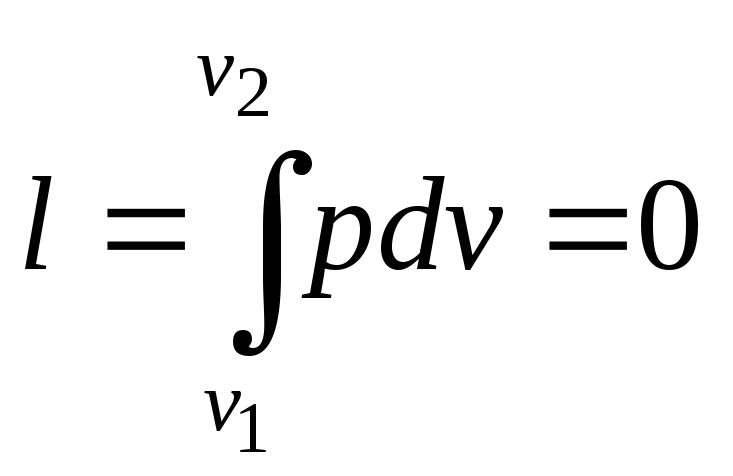 .
(2)
.
(2)
Количество теплоты, участвующей в процессе:
![]() при постоянной
теплоемкости сv
=
const;
(3)
при постоянной
теплоемкости сv
=
const;
(3)
![]() при
переменной теплоемкости сv
=
var.
(4)
при
переменной теплоемкости сv
=
var.
(4)
Изменение внутренней энергии системы: согласно 1-му закону термодинамики
![]() ,
(5)
,
(5)
но так как dl = 0, то du = dq.
Тогда
![]() .
(6)
.
(6)
Таким образом, в изохорном процессе вся теплота, подводимая к системе, затрачивается на изменение её внутренней энергии.
Поскольку внутренняя энергия идеального газа является функцией только его температуры, то и для любого термодинамического процесса идеального газа:
![]() .
(7)
.
(7)
Изменение энтропии:
![]() .
(8)
.
(8)
Изобарный процесс
При изобарном процессе выполняется условие dp = 0 или р = const. Из уравнения состояния идеального газа следует, что
![]() .
.
Таким образом,
![]() – уравнение процесса. (9)
– уравнение процесса. (9)
На рис. 2 представлен график процесса в p-v и T-S координатах.
р q q Т v S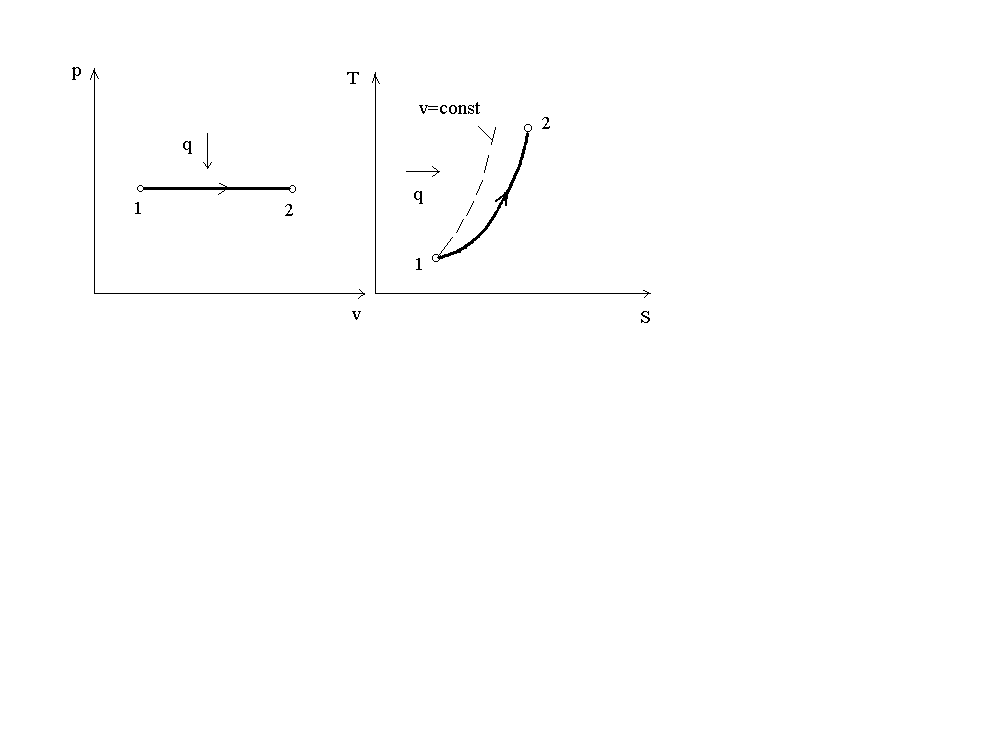
Рис. 2. График изобарного процесса
Работа изменения объёма
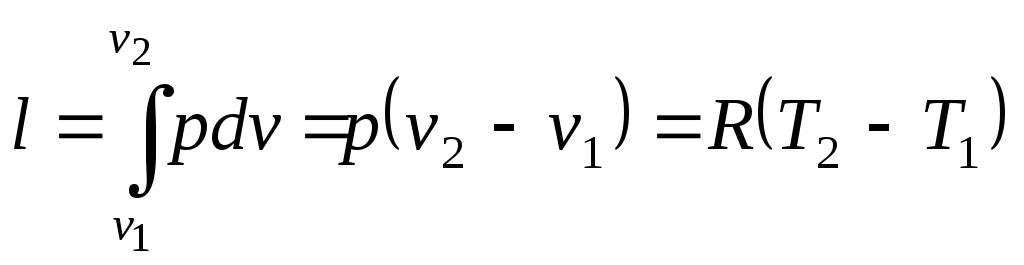 .
(10)
.
(10)
Количество теплоты, участвующей в процессе:
-
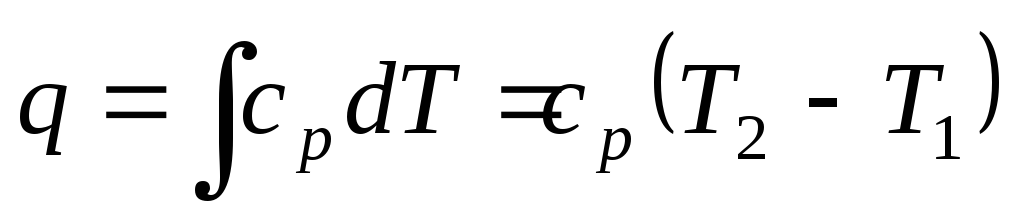 –при постоянной
теплоемкости ср
= const;
–при постоянной
теплоемкости ср
= const;(11)
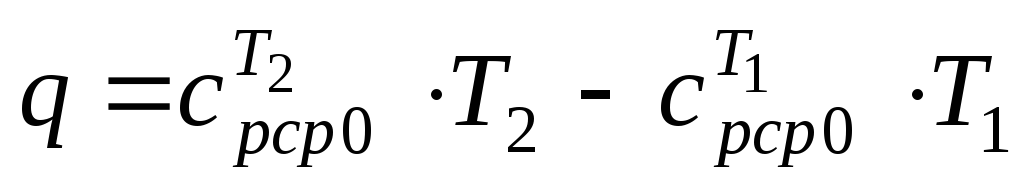 –при переменной
теплоемкости сv
= var.
–при переменной
теплоемкости сv
= var.(12)
Изменение внутренней энергии системы:
![]() .
(13)
.
(13)
Изменение энтропии:
![]() .
(14)
.
(14)
Изотермический процесс
При изотермическом процессе выполняется условие dT =0 или Т = const. Из уравнения состояния идеального газа следует, что
![]() .
.
Таким образом,
![]() – уравнение процесса. (15)
– уравнение процесса. (15)
На рис. 3 представлен график процесса в p-v и T-S координатах. В p-v координатах графиком процесса является равнобокая гипербола.
S q q Т v р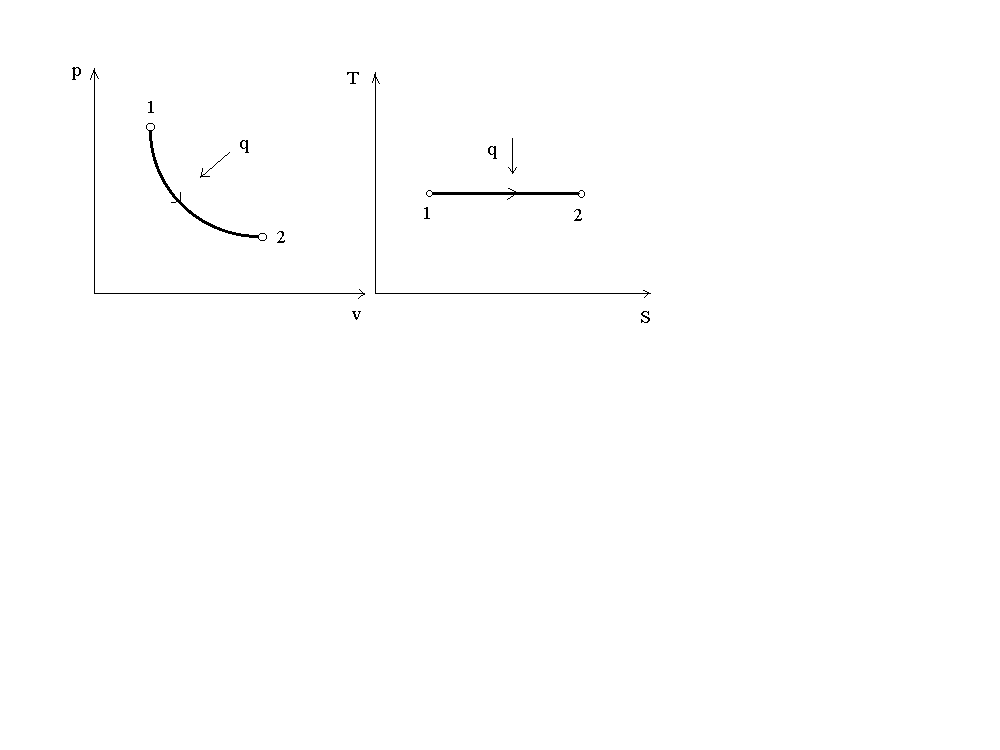
Рис. 3. График изотермического процесса
Работа изменения объёма:
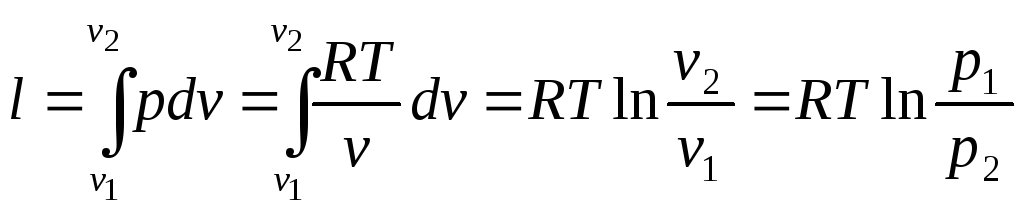 .
(16)
.
(16)
Изменение внутренней энергии системы:
![]() .
(17)
.
(17)
Количество теплоты, участвующей в процессе: согласно 1-му закону термодинамики
![]() ,
,
но так как du = 0, то dq = dl = рdv. (18)
Таким образом, в изотермическом процессе вся теплота, подводимая к системе, затрачивается на совершение работы изменения объёма.
Изменение энтропии:
![]() .
(19)
.
(19)
Адиабатный процесс
Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным. Таким образом, условие адиабатного процесса dq = 0.
Для того чтобы выполнялось данное условие, следует либо теплоизолировать газ, т.е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа.
Уравнения 1-го закона термодинамики для адиабатного процесса имеют вид:
![]()
Поделив первое уравнение на второе, получают
![]() или
или
![]() ,
,
где
![]() – показатель адиабаты.
– показатель адиабаты.
После интегрирования и потенцирования получают уравнение адиабаты:
![]() или
или
![]() .
(20)
.
(20)
Согласно молекулярно-кинетической теории показатель адиабаты для идеального газа не зависит от его температуры, а определяется только числом степеней молекулы газа. Для одноатомных газов k = 1,66; для 2-х атомных – k = 1,4; для 3-х и многоатомных – k = 1,33.
Поскольку k 1, то в координатах p-v линия адиабаты идет круче линии изотермы. На рис.4 представлен график адиабатного процесса в сравнении с графиком изотермического.
v р S Т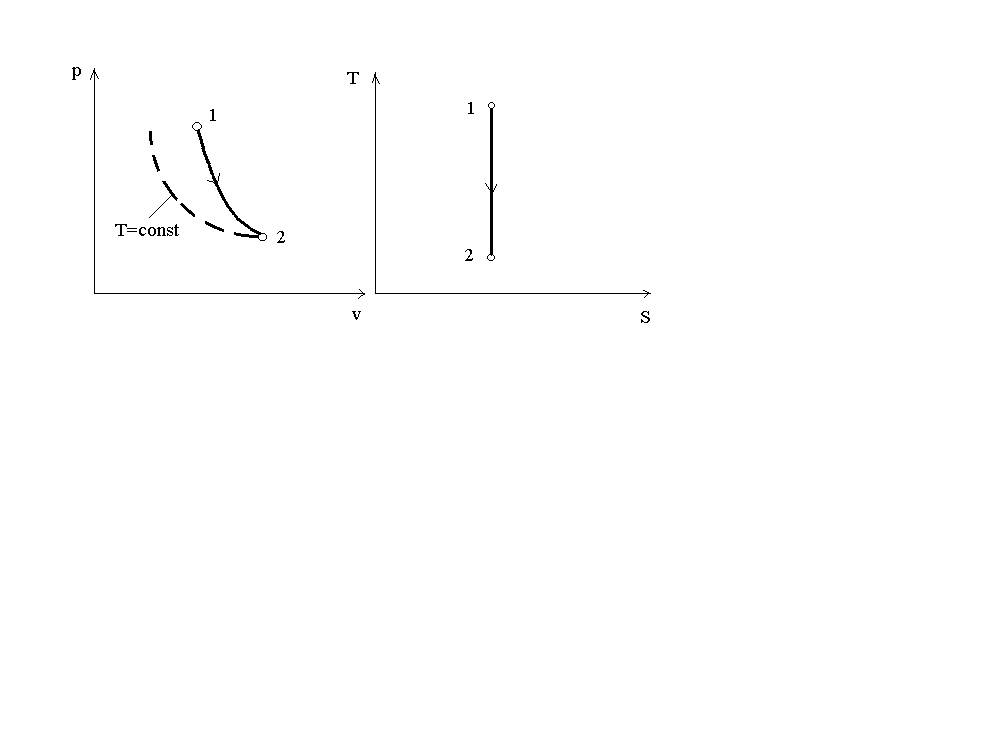
Рис. 4. График адиабатного процесса
При адиабатном расширении давление понижается быстрее, чем при изотермическом расширении, т.к. при этом происходит уменьшение температуры газа.
Параметры состояния в адиабатном процессе связаны следующими соотношениями
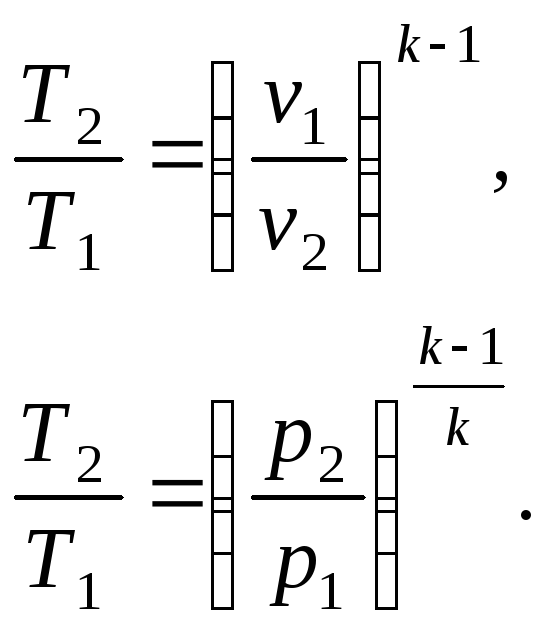 (21)
(21)
Изменение внутренней энергии системы:
![]() .
(22)
.
(22)
Работа изменения объёма системы: согласно 1-му закону термодинамики
|
|
(23) |
Таким образом, в адиабатном процессе работа совершается за счет изменения внутренней энергии системы.
Изменение энтропии:
![]() .
(24)
.
(24)
В связи с тем, что в адиабатном процессе энтропия системы остается постоянной, иное название этого процесса – изоэнтропный.