ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.11.2023
Просмотров: 149
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
В настоящее время проницаемость эмали изучена довольно подробно, что позволило пересмотреть ряд ранее существовавших представлений. Если считалось, что вещества в эмаль поступают по пути: пульпа – дентин – эмаль, то в настоящее время не только установлена возможность поступления веществ в эмаль из слюны, но и доказано, что этот путь является основным. Эмаль проницаема в обоих направлениях: от поверхности эмали к дентину и пульпе и от пульпы к дентину и поверхности эмали. На этом основании эмаль зуба считают полупроницаемой мембраной. Некоторые авторы считают, что проницаемость – это главный фактор созревания эмали зубов после прорезывания.
1.2. ДЕНТИН
Дентин составляет основную массу зуба. Его коронковая часть покрыта эмалью, корневая – цементом.
Дентин, как ткань, относится к группе специализированных костных тканей. Поэтому в его формировании выделяют две стадии: 1. Образование межклеточного вещества – или органической фазы, которая называется предентином. 2. Минерализация предентина и превращение его в дентин. На первой стадии процесс начинается с синтеза сложных углеводов – гликозамингликанов, которые связываются с водой за пределами клеток между отростками Томса и образуют основное гомогенное вещество – обязательную часть межклеточного вещества. После этого одонтобласты начинают синтезировать молекулы коллагена I типа, которые также выходят вне клеток между отростками Томса. Таким образом, межклеточное вещество, которое выделили одонтобласты, содержит только соединения органической природы, является по консистенции мягким, податливым и называется предентином.
Вторая стадия (минерализации) начинается с того момента, когда предентин достигает толщины 20-30 мкм, а затем эти стадии идут попеременно до тех пор, пока не образуется необходимая толщина дентина. Процесс минерализации регулируют сами клетки одонтобласты, которые активно захватывают из кровеносных сосудов зубного сосочка многие ионы (Са2+, Mg2+, Na+, F-, PO43- и др.). Последние транспортируются по отросткам одонтобластов в предентин, где включаются в структуру апатитов. Параллельно с этим клетки начинают выделять матриксные пузырьки, которые содержат ферменты – щелочную фосфатазу и пирофосфатазу, гидролизующие органические эфиры фосфорной кислоты и таким образом пополняющие пул неорганического фосфата в участках минерализации.
Образование дентина происходит в течение всего периода функционирования зуба при наличии жизнеспособной пульпы. Дентин, образующийся после прорезывания зубов, называют вторичным. Он характеризуется меньшей степенью минерализации и большим содержанием коллагеновых фибрилл.
В дентине содержится до 72% неорганических веществ и около 28% органических и воды. Неорганические соединения представлены, наряду с гидроксиапатитами и карбонатапатитами, фосфатом, карбонатом и фторидом кальция, органические - коллагеном и другими белками. Дентин построен из основного вещества и проходящих в нем канальцев, в которых расположены отростки одонтобластов и окончания нервных волокон, проникающих из пульпы. Основное вещество содержит коллагеновые фибриллы, собранные в пучки, и аморфное склеивающее вещество, химический состав которого изучен недостаточно, известно лишь, что оно включает большое количество минеральных солей.
Органическая основа дентина. В отличие от эмали дентин содержит большее количество органических веществ. В основном это белки:
Б
 ЕЛКИ ДЕНТИНА
ЕЛКИ ДЕНТИНАнерастворимые (90%) растворимые (10%)
– коллаген – собственно белки дентина
– структурные гликопротеины – сывороточные белки
Нерастворимые протеины в основном представлены коллагеном. Последний имеет особое строение, он не набухает в воде, устойчив к воздействию коллагеназы, содержит до 12% гидроксипролина, 2,0-3,5% лизина и гидроксилизина. В его составе также присутствует большое количество глутаминовой и аспарагиновой кислот, аргинина, лейцина, изолейцина и валина, мало циклических аминокислот, отсутствует триптофан.
Растворимые – это белки крови, проникающие через кровеносные сосуды. Они представлены сывороточными альбуминами, и -глобулинами, ферментами гликолиза, цикла трикарбоновых кислот, фосфатазами и трансаминазами. Из собственных белков дентина следует упомянуть Са-связывающие белки с молекулярной массой 11 кДа.
Физиологическая роль протеинов дентина заключается в инициации минерализации, ее упорядоченности и регулируемости. Возможность влияния одонтобластов на минерализацию обусловлена тем, что проксимальный отросток этих клеток содержит митохондрии, эндоплазматический ретикулум, рибосомоподобные гранулы, т.е. элементы, характеризующие метаболическую активность.
Уровень проницаемости дентина корня для большинства минеральных компонентов значительно ниже, чем дентина коронки. Данное явление можно объяснить с учетом структуры этой ткани. Известно, что дентинных канальцев в области бугров зубов человека значительно больше, чем в дентине, прилежащим к фиссурам. Ранее существовало мнение, что жидкость из пульпы поступает в дентин по отросткам одонтобластов и, выделяясь через них в пространство между отростком и стенкой трубочки, возвращается обратно. В настоящее время считают, что анатомической основы для подтверждения дентинной циркуляции нет. Состав дентинной жидкости близок к интерстициальной и включает ионы хлора, калия, натрия.
В дентине также содержится около 1% лимонной кислоты, роль которой заключается в способности образовывать хелатные комплексы с кальцием для передачи его во внутрь гидроксиапатита (рис. 4).

Рис. 4. Хелатный комплекс цитрата с ионами кальция.
1.3. ЦЕМЕНТ
Цемент зуба рассматривают как вариант грубоволокнистой костной ткани. В его состав входят около 70 % неорганических, 20% органических веществ и 10% приходится на воду. Из неорганических соединений преобладают гидроксиапатиты, а также соли фосфата и карбоната кальция, органические вещества представлены главным образом коллагеном, а также гликозамингликанами, липидами. В костной ткани содержится большое количество цитрата, его уровень превышает таковой в печени более, чем в двести раз.
Различают клеточный цемент, расположенный в верхушечной части корня и в области его бифуркации, и бесклеточный, покрывающий остальную часть корня. Клеточный цемент содержит цементоциты, в которых выявляются достаточно большое количество РНК, гликогена и ферментов. Это свидетельствует об интенсивных обменных процессах по сравнению с другими минерализованными тканями зуба. Бесклеточный цемент не имеет цементоцитов и состоит из коллагеновых волокон и аморфного склеивающего вещества. Цемент тесно связан с дентином.
В течение жизни постоянно происходит отложение цемента. При некоторых заболеваниях, например, пародонтите и периодонтите, а также при повышении нагрузки на зуб происходит интенсивное отложение цемента, при этом формируется гиперцементоз (анкилоз зуба).
Поскольку наиболее часто нами упоминается коллаген, белок, имеющий довольно оригинальную структуру мы считаем уместным более подробно остановиться на его строении. Из всех белков, обнаруженных у высших позвоночных, коллаген наиболее распространенный: количество его в организме составляет около одной трети всего уровня белков. Сухожилия построены из параллельных пучков молекул коллагена. В отличие от -кератинов коллаген растягивается с трудом. В настоящее время известны 19 типов коллагена, различающиеся по первичной структуре пептидных цепей, функциям и локализации в организме. Наиболее распространен 1 тип (кожа, кости, сухожилия, связки, роговица, дентин, пульпа, периодонт); 2-ой тип этого белка находится в хряще, стекловидном теле, передней части роговицы; 3-ий тип - в почках, печени, лимфатических узлах, аорте и других сосудах; 4-ый - локализуется в базальных мембранах. Отличие костного коллагена от других его видов в соединительной ткани заключается в том, что в первом имеются остатки фосфорной кислоты и дикарбоновых кислот. Характерной чертой коллагена является также то, что одну треть всех его аминокислотных остатков составляет глицин, а одну четвертую часть и более - пролин, гидроксипролин и гидроксилизин. Исключительно высокое содержание в коллагене таких аминокислот, которые нарушают
-спиральную структуру, дает основание предполагать, что коллаген не образует классическую альфа-спираль. В коллагене каждые три полипептидных цепи скручены и образуют тройную спираль (Рис. 4), при этом под влиянием регулярно располагающихся остатков пролина и оксипролина цепь принимает форму как бы ломаной спирали; это обусловливается жесткостью R-групп пролина, а также тем обстоятельством, что пептидные связи, в образовании которых участвуют пролин и оксипролин, не могут образовать водородных связей. NH-группы пептидных связей, в образовании которых участвуют остатки глицина, образуют межцепочечные водородные связи, которые также способствуют сохранению прочности структуры коллагена и делают ее устойчивой к растягиванию. Каждая полипептидная цепь коллагена имеет молекулярную массу 120000 и содержит около 1000 аминокислотных остатков. Полная трехспиральная единица называется тропоколлагеном. Тропоколлагеновые единицы уложены в волокнах коллагена в сухожилиях ступенчатым образом, чем и объясняется характерное для фибрилл коллагена расстояние между повторяющимися единицами (в зависимости от степени гидратации 600-700 А).
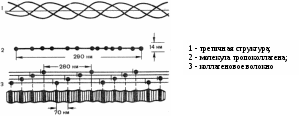
Рис. 4. Схема строения молекулы коллагена.
Прочность коллагеновых волокон (нить сечением около 1 мм выдержавает нагрузку более 10 кг) во многом достигается за счет дополнительных ковалентных «сшивок» между молекулами тропоколллагена. Установлено, что в образовании «сшивок» участвуют главным образом, остатки лизина и гидроксилизина.
Биосинтез данного протеина, осуществляемый в остео-, хондро- и фибробластах, протекает весьма сложно. Сначала его цепи синтезируются на полисомах в виде предшественников, образуя проколлаген. Затем пептидные цепочки посттрансляционно гидроксилируются и гликозилируются. Гидроксилирование проколлагена осуществляется с участием фермента протоколлаген-гидроксилазы, который в качестве кофермента использует витамин С (аскорбиновую кислоту). Негидроксилированный белок плохо секретируется из клеток, а если секретируется, то сразу же атакуется коллагеназой. Следовательно при гиповитаминозах С и Р содержание коллагена в тканях уменьшается, что в конечном итоге приводит к остепорозу.
Выделяют два пути распада коллагена - специфический и неспецифический. В первом случае коллаген разрушается коллагеназой на два фрагмента, которые в дальнейшем гидролизуются лизосомальными протеазами. Во втором - протеин денатурируется продуктами свободнорадикального окисления липидов, а затем подвергается действию протеаз. Продукты специфического распада коллагена стимулируют образование новых остео-, хондро-, фибробластов, то есть обусловливают регенерацию на клеточном уровне.