Файл: Задача Охарактеризуйте фармакопейный метод количественного определения субстанции морфина. Напишите уравнение реакции.docx
Добавлен: 07.11.2023
Просмотров: 117
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Задача 1Какой метод используется при испытании субстанции амитриптилина на чистоту? Как проводится данное определение? Укажите возможные специфические примеси и их предельное содержание
Испытания на чистоту выполняют методом ТСХ на силикагеле G в системе растворителей: циклогексан-этилацетат-диэтиламин (85:12:3). Детектируют в УФ-свете после обработки раствором формальдегида и серной кислоты (4:96). С помощью стандартов устанавливают наличие примеси дибензосуберона и циклобензоприна (не более 0,25%).
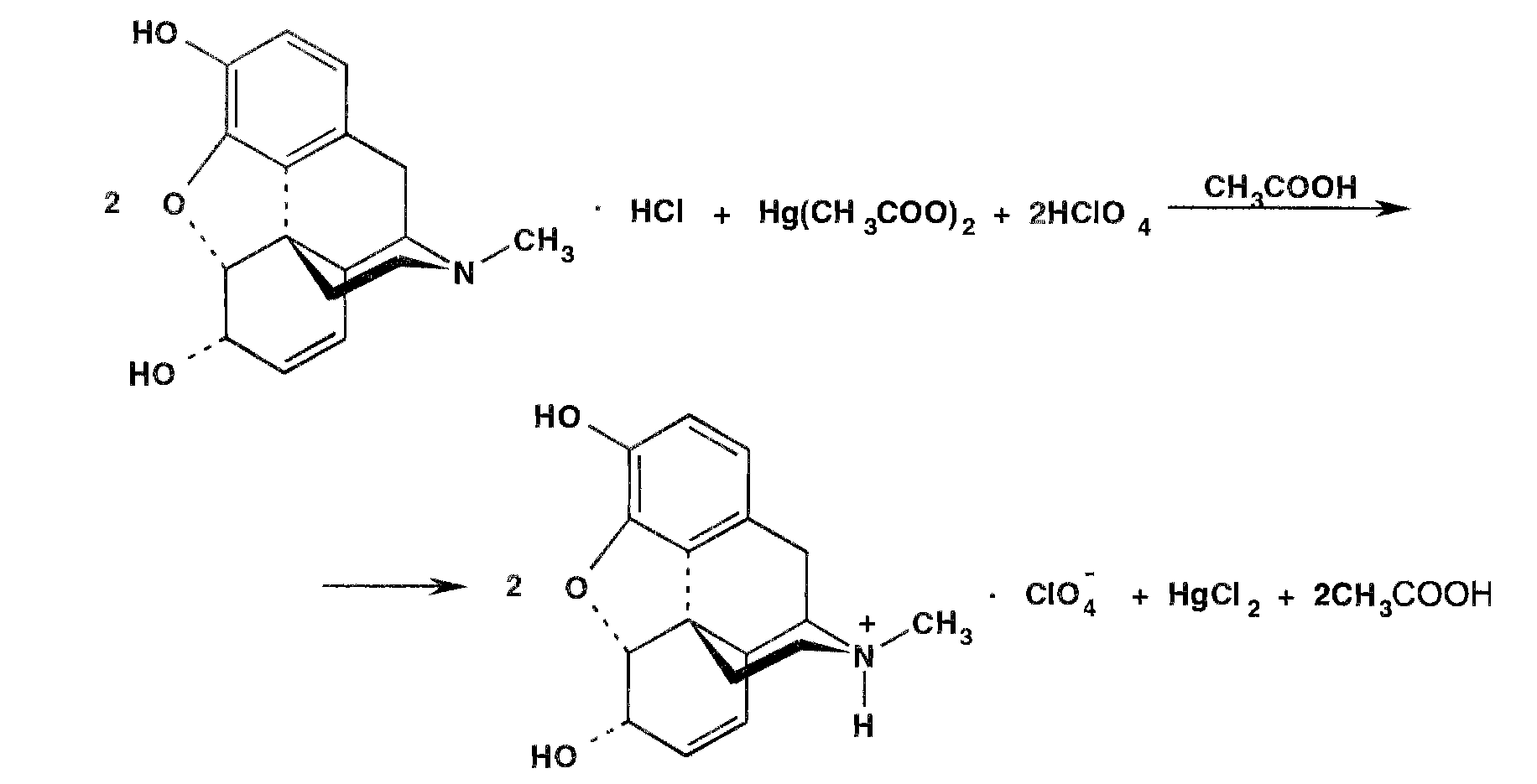
Задача 2. Охарактеризуйте фармакопейный метод количественного определения субстанции морфина. Напишите уравнение реакции.
Метод неводного титрования,титрант-хлорная к-та, в среду безводной уксусной к-ты, индикатор-кристаллический фиолетовый, переход окраски из фиолетового в зеленый
Задача 3 ФЕНТАНИЛ Охарактеризуйте спектрофотометрический метод и покажите возможность использования его в качественном анализе данной субстанции.Наличие каких фрагментов структуры обусловливает использование спектрофотометрии для качественного анализа этой субстанции?
Подлинность фентанила устанавливают по ИК-спектру, который должен соответствовать спектру, прилагаемого к НД. УФ-спектр фентанила должен иметь максимумы поглощения при (251±2) нм, (257±2) нм и плечо в области 260-264 нм.
П
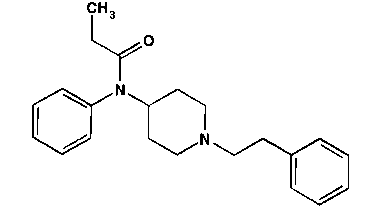 ри нагревании фентанила с уксусным ангидридом и кислотой лимонной появляется красно-фиолетовое окрашивание (наличие третичного атома азота)
ри нагревании фентанила с уксусным ангидридом и кислотой лимонной появляется красно-фиолетовое окрашивание (наличие третичного атома азота)Задача 4 Охарактеризуйте методы идентификации и количественного определения 3% раствора перекиси водорода, приведенные в ГФ. Напишите уравнения реакций.
В некоторых реакциях перекись водорода проявляет восстановительные свойства:
-при действии перекиси водорода на оксид серебра, осажденного аммиаком из раствора нитрата серебра, наблюдается черный осадок восстановленного серебра.
- при взаимодействии перекиси водорода с подкисленным раствором перманганата калия наблюдается обесцвечивание раствора вследствие восстановления Мп0
4_ до Мп2+; одновременно происходит бурное выделение кислорода.
Примером реакции, где перекись водорода проявляет окислительные свойства, может служить реакция взаимодействия ее с йодидами (слой хлороформа окрашивается в малиновый цвет) и бромидами.
Количественное определение:
Из объемных методов определения наиболее широкое распространение получили йодометрический и перманганатометрический методы, основанные на окислительно-востановительных свойствах перекиси водорода. Метод перманганатометрии является одним из наиболее точных и надежных способов определения и применим как для разбавленных, так и для более концентрированных растворов (метод принят ГФ X).
Определение ведут непосредственным титрованием подкисленного раствора перекиси водорода раствором перманганата калия до момента прекращения обесцвечивания, т. е. достижения точки конца титрования, когда раствор становится бледно-розовым.
2MnO4– + 5H2O2 + 6H+ → 2Mn2+ + 5O2 +8H2O.
Водорода перекись окисляется до кислорода:
H2O2 – 2ē → O2 + 2H+
Йодометрический метод (косвенная йодометрия) определения перекиси водорода основан на взаимодействии ее с йодидом калия в кислой среде. Выделившийся йод оттитровывают тиосульфатом натрия. Этот метод несколько менее точен, чем перманганатометрический, но тем не менее находит широкое применение особенно в интервале концентрации перекиси водорода 1-6%.
H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2O.
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI.
Водорода перекись восстанавливается до воды:
H2O2 + 2H+ + 2ē → 2H2O
Задача 5. Поясните возможность использования ИК- и УФ-спектрофотометрии для подтверждения подлинности циннаризина. Какие спектральные характеристики используют для этой цели? Чем отличается УФ-спектр поглощения от ИК-спектра

ИК-спектр представляет собой график зависимости процента пропускания от длины волны (λ, мкм) или частоты (ν, см-1) инфракрасного излучения. Картина (вид) ИК-спектра значительно отличается от картины УФ-спектра или спектра в видимой области. Если УФ-спектры вещества (или спектры в видимой области) представляют собой плавные кривые с 1-3 максимумами, то в ИК-спектре таких «максимумов» достаточно много. Их количество определяется поглощением ИК-излучения отдельными функциональными группами или колебаниями под действием этого излучения фрагментов скелета органического вещества. Положение каждого максимума характеризуется интенсивностью (сильная, средняя, слабая), формой (очень широкая, широкая, узкая) и определенным положением в спектре. Колебательные спектры (в УФ и видимом диапазоне) более простые - как правило, всего несколько полос, обычно, более широкие.
Задача 6. В соответствии с химическим строением предложите реакции идентификации препарата тримеперидина гидрохлорида. Напишите уравнения реакций.
ГФ использует для определения подлинности цветные и осадительные реакции, основанные на наличии в препарате третичного азота,хлороводородной кислоты и восстановительных возможностей промедола.
1.К формальдегиду в конц. Серной кислоте осторожно по стенкам пробирки добавляют р-р промедола в хлороформе. На границе соприкосновения 2х жидкостей получается кольцо красного цвета. Появление окраски обусловлено окислительной конденсацией
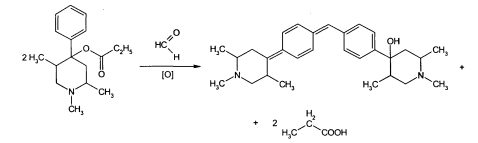
2. К ЛП добавляют 5капель пикриновой кислоты,выпадает желтый осадок пикрата промедола
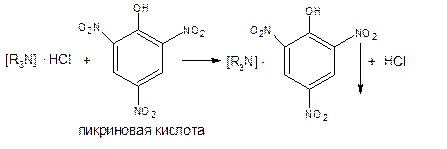
3.Реакция на хлориды с нитратом серебра.
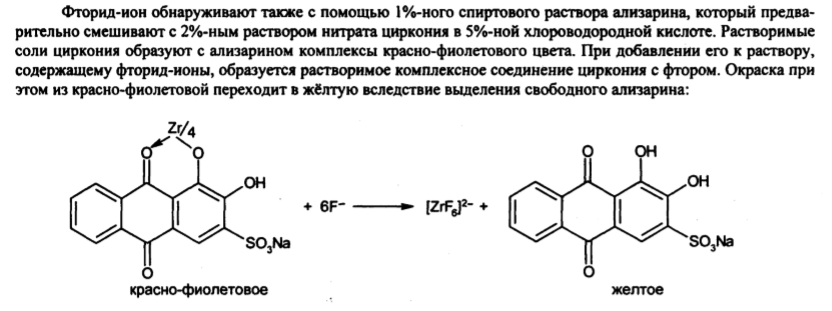
Задача 7. Как провести испытания на присутствие в молекуле органически связанных фтора и хлора? Приведите уравнения реакций
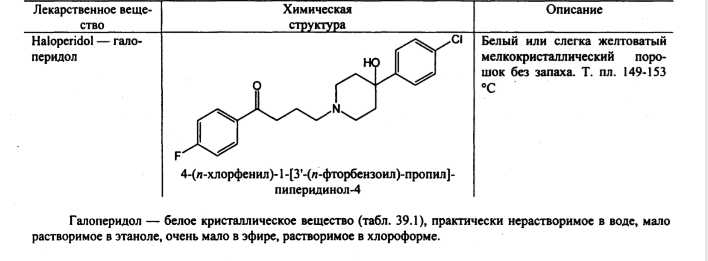

AgNO3+Cl-=AgCl+NO3-
Задача 8. В соответствии с химическим строением предложите физико-химические и химические методы идентификации для субстанции папаверина гидрохлорида.
0,05 г препарата помещают в фарфоровую чашку, смачивают 1 - 2 каплями кислоты азотной концентрированной, появляется желтое окрашивание, которое при нагревании на водяной бане переходит в оранжевое.
2. К 0,05 г препарата прибавляют 1 мл кислоты серной концентированной и нагревают, появляется фиолетовое окрашивание.
3. Окрашенные продукты также образуются при взаимодействии с реактивом Марки. При последующем добавлении бромной воды и раствора аммиака появляется фиолетовый осадок, который после растворения в этаноле окрашивает раствор в фиолетово-красный цвет (реакция является специфичной для папаверина и используется в его фотоколориметрическом определении).
4. Положительную реакцию дает папаверина гидрохлорид с реактивом Фреде, при его обработке уксусным ангидридом и концентрированной серной кислотой после нагревания на водяной бане появляется желтое окрашивание с зеленой флуоресценцией.
5. С перманганатом калия в кислой среде папаверина гидрохлорид образует продукты, флуоресцирующие голубым светом.
6. Кроме того папаверина гидрохлорид дает некоторые реакции с осадительными реактивами:
v Бромная вода выделяет из раствора желтый осадок.
v Спиртовой раствор йода - темно-красные кристаллы.
v С пикриновой кислотой образуется желтый осадок.
7. УФ-спектр 0,0005% раствора препарата в 0,01 М растворе кислоты хлористоводородной в области от 230 до 270 нм имеет максимум поглощения при 251 нм, УФ-спектр 0,0025% раствора препарата в 0,01 М растворе кислоты хлороводородной имеет максимумы поглощения при 285 нм и 309 им.
8. ИК- спектр
9. Раствор препарата дает характерную реакцию на хлориды с нитратом серебра.
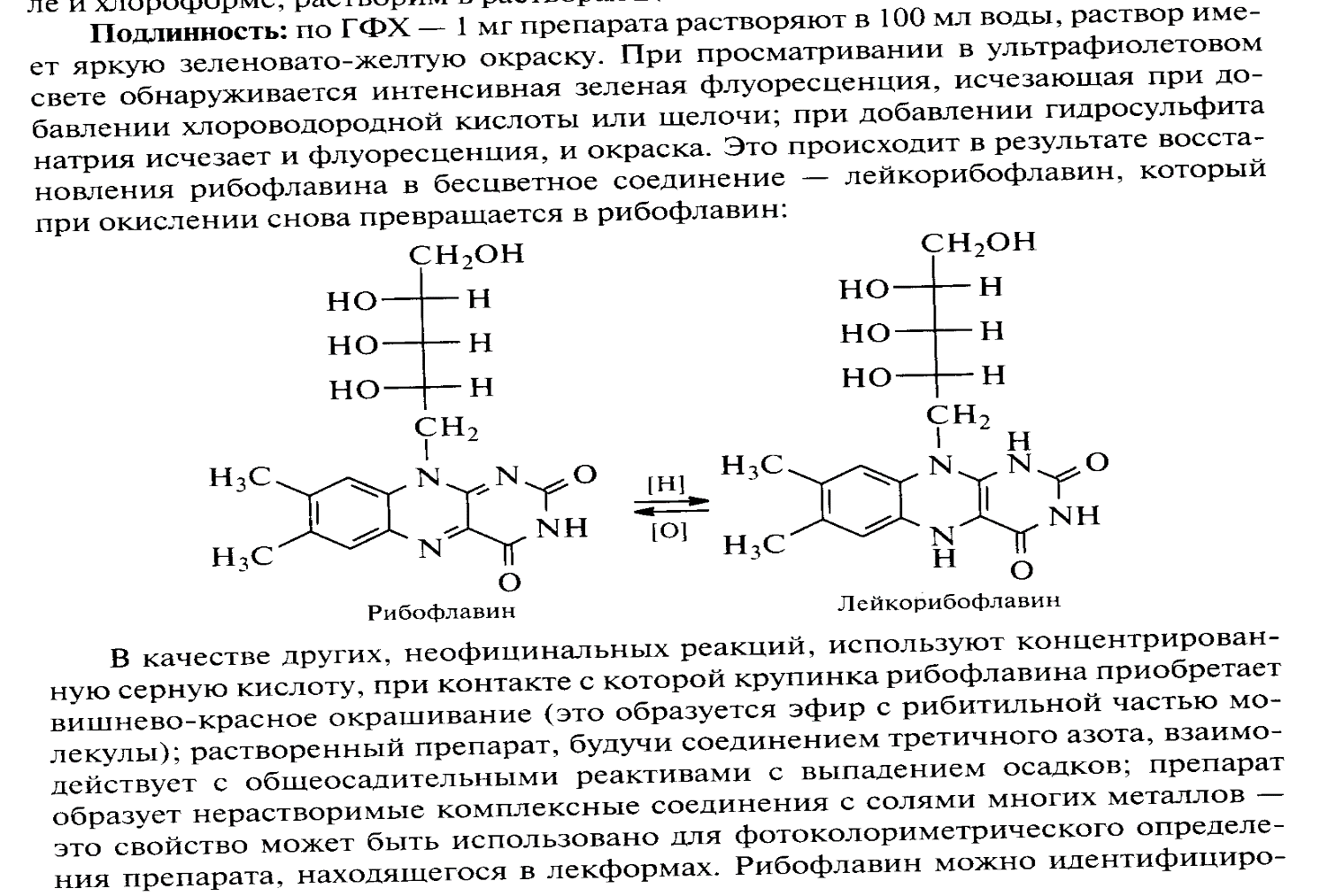
Задача 9. Опишите методы испытания на подлинность и чистоту субстанции рибофлавина. Напишите уравнение реакции, применяемой для идентификации препарата.

Задача 10. В соответствии с химическим строением пиридоксина гидрохлорида предложите методы количественного определения. Напишите уравнения реакций.
Количественное определение пиридоксина гидрохлорида проводят методом кислотно-основного титрования в неводной среде (ледяной уксусной кислоте и титранте – 0,1 М растворе хлорной кислоты). Пиридоксина гидрохлорид можно количественно определять алкалиметрически.
ГФ: Метод неводного титрования.
Методика: точную навеску препарата растворяют в ледяной уксусной кислоте, прибавляют ацетат ртути, индикатор кристаллический фиолетовый и титруют 0,1М HClO4 до изумрудно-зеленого окрашивания.
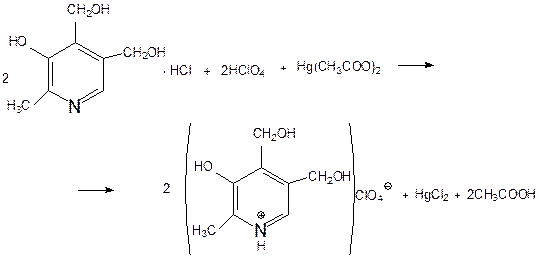
Метод нейтрализации
Методика: точную навеску препарата растворяют в воде, в присутствии индикатора бромтимолового синего титруют 0,1 М NaOH до голубого окрашивания.
 УЧ = 1, формула прямого титрования
УЧ = 1, формула прямого титрованияЗадача 11. Укажите общие реакции, лежащие в основе испытаний подлинности фенобарбитала и других барбитуратов. Назовите реакцию отличия фенобарбитала от других барбитуратов. Приведите уравнения реакций, укажите аналитические эффекты.

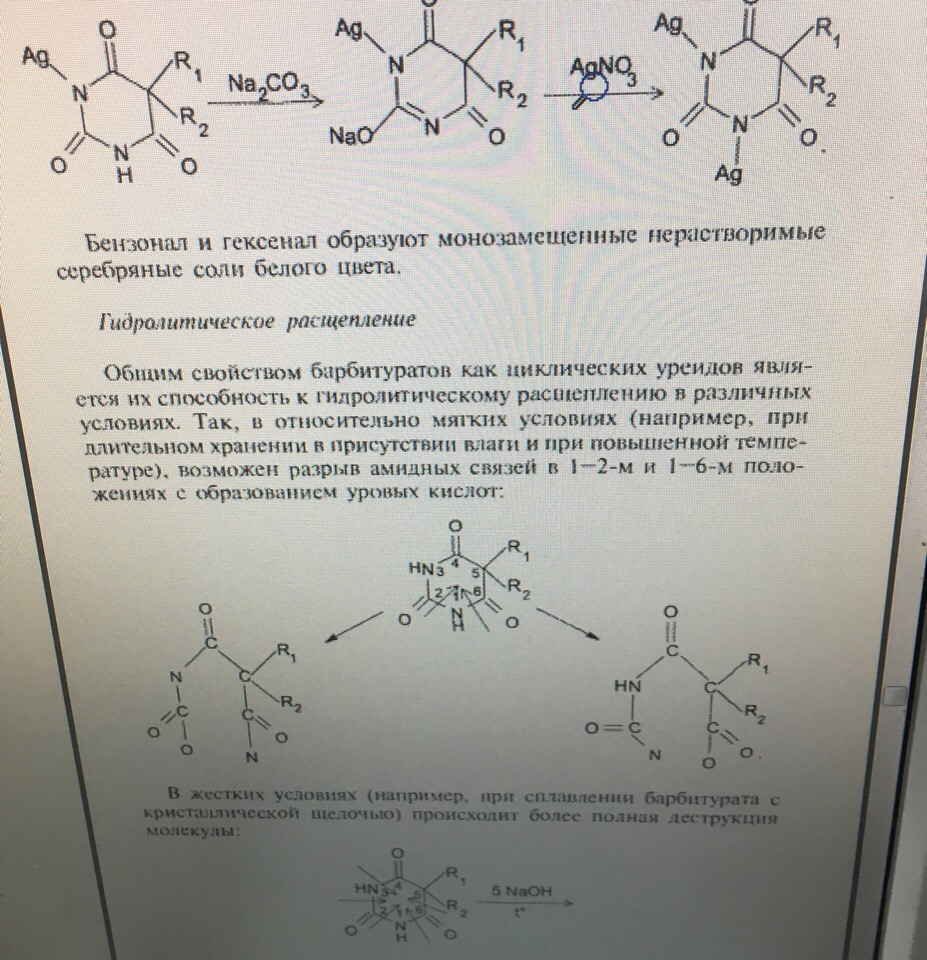
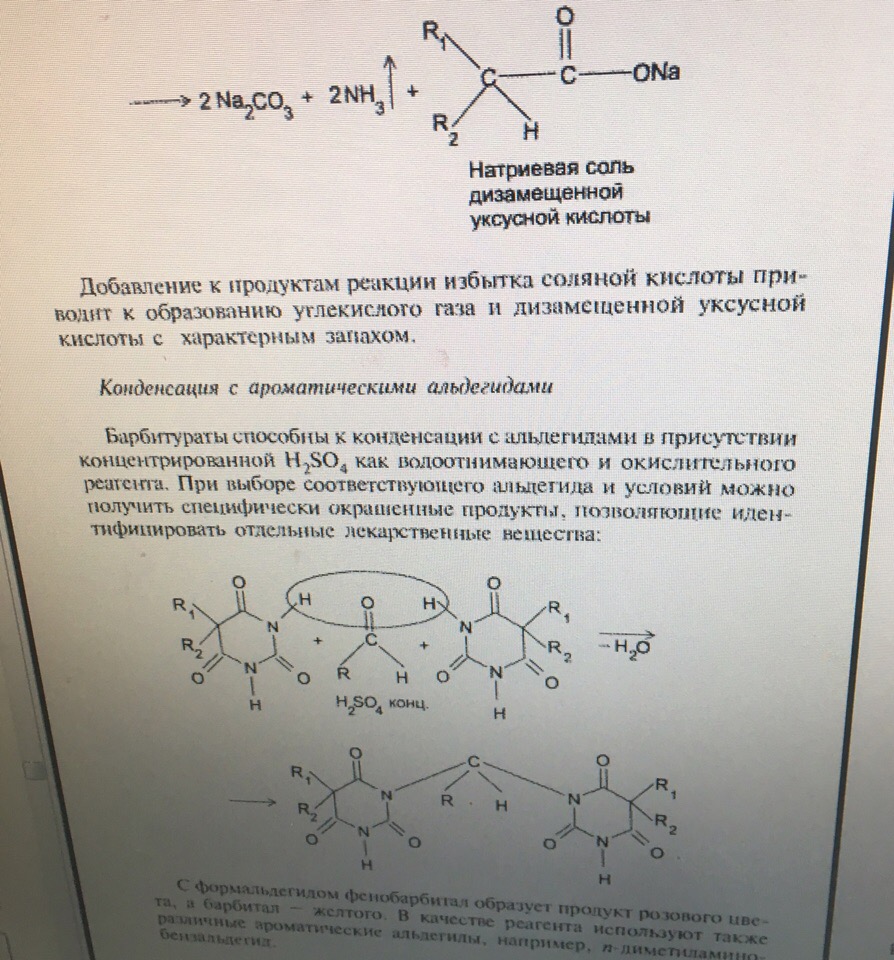
С формальдегидом фенобарбитал образует продукт розового цвета, а барбитал — желтого.
Частные реакции
Фенобарбитал имеет в 5-м положении фенильный радикал, по которому возможны Sg-реакции, например нитрование с последующим восстановлением нитрогруппы, диазотированием и азосоче-танием:
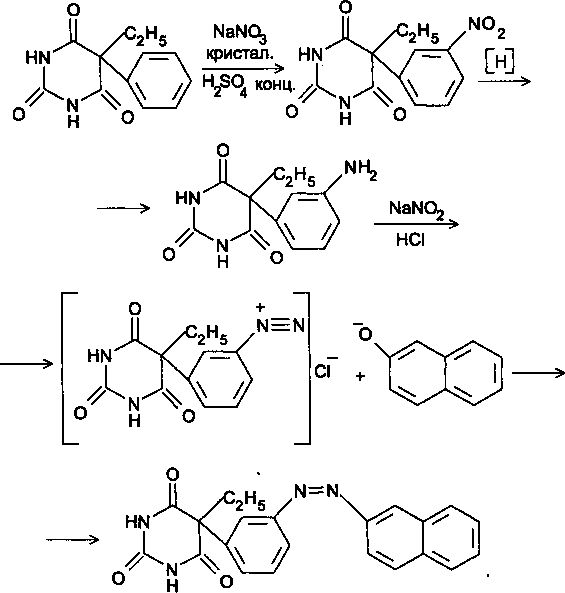
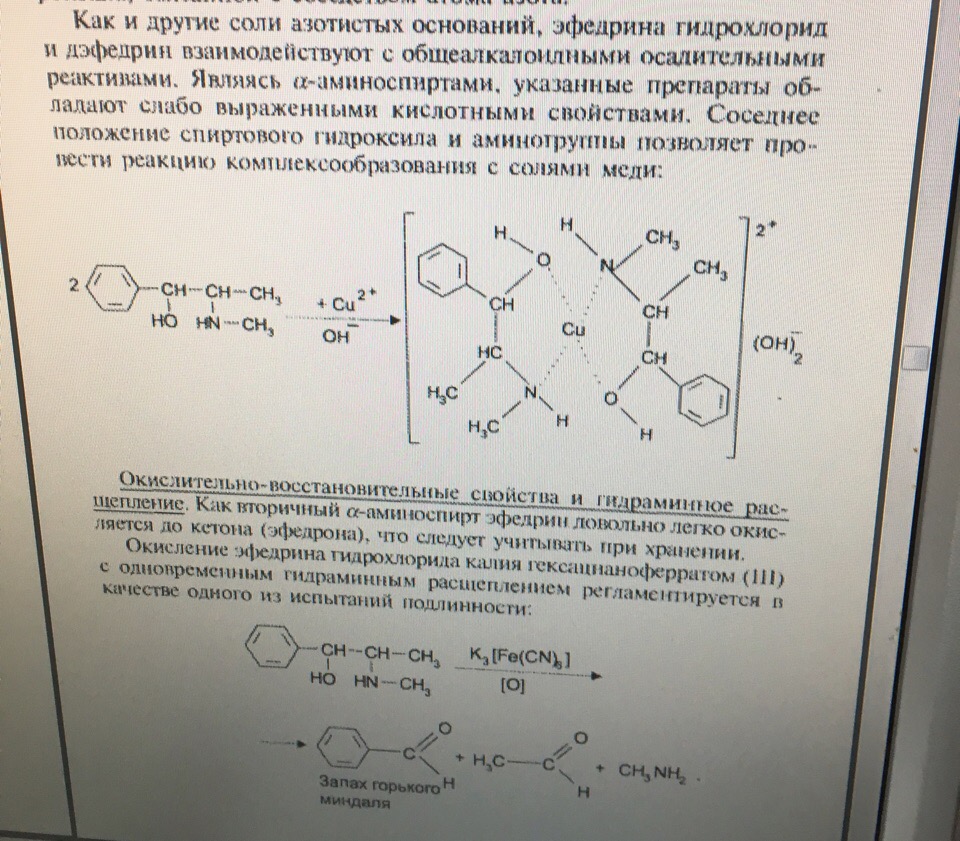
Задача 12. В соответствии с химическим строением предложите реакции идентификацииэфедрина гидрохлорида. Перечислите методы анализа, позволяющие отличить эфедрина гидрохлоридот дэфедрина гидрохлорида
Задача 13. В отличие от растительных слабительных, солевые слабительные действуют на всем протяжении кишечника и показаны при пищевых отравлениях. Приведите формулу глауберовой соли. Напишите уравнения реакций, лежащих в основе испытаний на подлинность данного лекарственного препарата.