ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.11.2023
Просмотров: 53
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ИЛИ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ, ПОЛУЧЕННОМ ПРИ СМЕШИВАНИИ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ
Типовая задача№1. Смешали 140 г 0,5 %-ного раствора соляной кислоты с 200 г 3 %-ного раствора соляной кислоты. Каково процентное содержание соляной кислоты во вновь полученном растворе?
Д ано: Решение:
ано: Решение:
m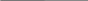 (p) = 140 г 1) m (HCl) в 1ом р-ре
(p) = 140 г 1) m (HCl) в 1ом р-ре
(HCl) = 0,005 (0,5 %)m (HCl) = 140 г ∙ 0,005 = 0,7 г
m (p. HCl) = 200 г 2) m (HCl) во 2ом р-ре
щ(HCl) = 0,03 (3 %) m (HCl) = 200 г ∙ 0,03 = 6 г
(HCl) = ? 3) Общая m (HCl) = 6 г + 0,7 г = 6,7 г
4) m (p-ра полученного) = 140 г + 200 г = 340 г
5) Новая ?(HCl)
(HCl) =6,7 г/340 г = 0,0197 (1,97 %)
Ответ:(HCl) = 0,0197 (1,97 %)
Типовая задача №2. Какой будет массовая доля вещества в растворе, полученном при сливании 30 г 24%-го и 75 г 12%-го растворов серной кислоты?
Наглядно-логический метод:
Ответ: массовая доля вещества в растворе составляет 15, 4%.


Задачи для самостоятельной работы

 VIII ТИП. ЗАДАЧИ НА МОЛЯРНУЮ КОНЦЕНТРАЦИЮ
VIII ТИП. ЗАДАЧИ НА МОЛЯРНУЮ КОНЦЕНТРАЦИЮ
Типовая задача №1. Определить молярную концентрацию раствора серной кислоты, полученного при смешивании 25 мл 10-молярного раствора серной кислоты и 225 мл воды.
Д ано: Решение:
ано: Решение:
V (p. H2SO4) = 25 млn (H2SO4) - ? В 1000 мл – 10 моль
(p. H2SO4) = 25 млn (H2SO4) - ? В 1000 мл – 10 моль
C(H2SO4) = 10 моль/л в 25 мл – х моль
V(H2O) = 225мл х = 0,25 моль
C(H2SO4) = ? 2) V(р-ра) = 225 мл + 25 мл = 250 мл
3) C(H2SO4) - ? В 250 мл – 0,25 моль
в 1000 мл – х моль
х = 1 моль/л
Ответ: С = 1 моль/л.
Типовая задача №2. Определить молярную концентрацию 73,8 %-ного раствора серной кислоты, плотность которого 1,655 г/мл.
 Дано: Решение:
Дано: Решение:
 (H2SO4) = 0,738 (73,8%) 1)V(р) = 100 г /1,655 г/мл = 60,42 мл
(H2SO4) = 0,738 (73,8%) 1)V(р) = 100 г /1,655 г/мл = 60,42 мл
(p) = 1,655 г/мл 2)В 60,42 мл р. – 73,8 г H2SO4
С=? в 1000 мл – х
х = 1221,45 г
3)n = 1221,45 г /98 г/мл = 12,46 моль
С = 12,45 моль/л
Ответ: С = 12,45 моль/л
Типовая задача №3. Какой объем 36,5 %-ного раствора соляной кислоты (пл. 1,18 г/мл) необходимо взять для приготовления 1000 мл 0,1 молярного раствора?
Д ано: Решение:
ано: Решение:
 (HCl) = 0,365 ( 36,5 %) 1)В 1000 мл р-ра – 0,1 моль HCl (3,65 г)
(HCl) = 0,365 ( 36,5 %) 1)В 1000 мл р-ра – 0,1 моль HCl (3,65 г)
(p-ра) = 1,18 г/мл2) В 100 г р-ра – 36,5 г HCl
V(р) = 1000 млх – 3,65 г
С(HCl) = 0,1 моль/лх = 10 г (р-ра)
V(36,5 % р-ра) = ? 3)V(р-ра) = 10 г /1,18 г/мл = 8,4745 мл
Ответ: V = 8,4745 мл
Типовая задача №4. Определить массовую долю азотной кислоты в 4,97 молярном ее растворе, плотность которого 1,16 г/мл. Ответ: 27 %.;
 Дано: Решение:
Дано: Решение:
С (HNO3) = 4,97 моль/л 1) m (р) = 1000 мл х 1,16 г/мл = 1160 г
(HNO3) = 4,97 моль/л 1) m (р) = 1000 мл х 1,16 г/мл = 1160 г
(p) = 1,16 г/мл 2) m (HNO3) = 4,97 моль х 63 г/моль = 313,11 г
(HNO3) = ?= 313,11 г/1160 г = 0,27 (27 %)
Ответ: = 0,27 (27 %).
З
 адачи для самостоятельной работы
адачи для самостоятельной работы

IX ТИП. УСЛОЖНЕННЫЕ ЗАДАЧИ.
Типовая задача №1. Из раствора хлорида алюминия массой 110 г и массовой долей соли 10% выпарили 10 г воды и добавили 5 г той же соли. Массовая доля соли в полученном растворе равна _____%.
Решение:
ω=m (вещества)/m (раствора)
Найдем массу хлорида алюминия из первого раствора
m (вещества)= m (раствора)∙ω
m (вещества)= 110г ∙0,1 = 11 г
m (воды) = m (раствора)- m (вещества)
= 110-11 = 99 г
По условию выпарили 10 г воды.
Далее в раствор добавляют 5 г соли
Таким образом, в итоговом растворе будет содержаться:
воды 99-10 = 89 г
хлорида алюминия = 11 + 5 = 16 г
суммарная масса = 89 + 16 = 105 г
Подставим значения в формулу ω= 16∙100%/105 =15,2 %
Типовая задача №2. При смешивании 50%-ного и 10%-ного растворов одного и того же вещества получили 15%-ный раствор. Во сколько раз взяли больше по массе 10%-ного раствора, чем 50%-ного? Ответ запишите в виде целого числа.
Решение:
Пусть масса 10%-ного раствора в n раз больше, тогда
m - масса 50%-ного раствора, а n∙m - масса 10%-ного раствора, тогда
0,5m + 0,1∙(n∙m) = 0,15∙(m + n∙m)
0,5 + 0,1n = 0,15 + 0,15n
0,05n = 0,35
n=7 Ответ: 7
Типовая задача №3. Сколько граммов 10%-го раствора соли надо добавить к 300 г 30%-го раствора этой же соли, чтобы получить 14%-ный раствор? Ответ запишите в виде целого числа.
Решение:
Пусть m - масса добавляемого 10%-го раствора в граммах, тогда
m∙0,1+300∙0,3 = (m+300)∙0,14
0,1m+90=0,14m+42
0,04m=48
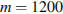 (г)
(г)
Ответ: 1200г
Типовая задача №4. Определите массы 10%-ного и 50%-ного (по массе) растворов, необходимые для получения 200 г 20%-ного раствора.
Решение:
ω1 = 10%, ω2 = 50%, ω3= 20%, m3 = 200 г, m2 = 200 - m1
Составляем уравнение:
m1∙ 10 + (200 - m1) ∙50 = 200 ∙20
40∙m1 = 6000
m1 = 150 (г),
m2 = 200 - m1 = 200 - 150 = 50 (г)
Ответ: 150 г, 50 г.
Типовая задача №5. Определите массы 25%-ного (по массе) раствора и воды, необходимые для получения 200 г 10%-ного раствора.
Решение:
ω1 = 25%, ω2 = 0%, ω3= 10%, m3 = 200 г
Составляем уравнение:
m1∙ 25 + m2 ∙ 0 = 200∙10
25 ∙m1 = 2000
m1 = 80 (г),
m2 = 200 - m1 = 200 - 80 =120 (г)
Ответ: 80 г, 120 г.
Типовая задача №6. Какую массу оксида серы (VI) следует добавить к 500 г 20%-ного раствора серной кислоты, чтобы увеличить её массовую долю до 40%?
Решение:
1) Составить уравнение химической реакции
SO3+H2O=H2SO4
2) Рассчитать массу серной кислоты, находившейся в исходном растворе и получившейся из х моль оксида серы (VI):
m1 (H2SO4)= m1(р-ра) ∙ ω1 (H2SO4)= 500 • 0,2 = 100 г
m (SO3)=n(SO3)∙M(SO3) = 80x (где х - число молей оксида серы)
m2 (H2SO4)= n(H2SO4) ∙M(H2SO4) = 98x
3) Рассчитать массу раствора и суммарную массу серной кислоты в нём:
m2(р-ра) = m2(р-ра) +m (SO3)= 500 + 80Х
m3 (H2SO4)= m1(H2SO4) + m2 (H2SO4) = 100 + 98x
4) Найти массу SO3, необходимую для растворения:
ω2 (H2SO4) = m3 (H2SO4)/ m2(р-
Типовая задача№1. Смешали 140 г 0,5 %-ного раствора соляной кислоты с 200 г 3 %-ного раствора соляной кислоты. Каково процентное содержание соляной кислоты во вновь полученном растворе?
Д
 ано: Решение:
ано: Решение:m
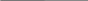 (p) = 140 г 1) m (HCl) в 1ом р-ре
(p) = 140 г 1) m (HCl) в 1ом р-ре(HCl) = 0,005 (0,5 %)m (HCl) = 140 г ∙ 0,005 = 0,7 г
m (p. HCl) = 200 г 2) m (HCl) во 2ом р-ре
щ(HCl) = 0,03 (3 %) m (HCl) = 200 г ∙ 0,03 = 6 г
(HCl) = ? 3) Общая m (HCl) = 6 г + 0,7 г = 6,7 г
4) m (p-ра полученного) = 140 г + 200 г = 340 г
5) Новая ?(HCl)
(HCl) =6,7 г/340 г = 0,0197 (1,97 %)
Ответ:(HCl) = 0,0197 (1,97 %)
Типовая задача №2. Какой будет массовая доля вещества в растворе, полученном при сливании 30 г 24%-го и 75 г 12%-го растворов серной кислоты?
Наглядно-логический метод:
| Р1 | + | Р2 | = | Р3 |
| mp1 = 30 г | mp2 = 75 г | mp3 = 30+75=105 г | ||
| ɷ =0.24(24%) | ɷ = 0,12 (12%) | ɷ = 16, 2/105 = 0, 154 | ||
| mв1 = 30· 0, 24= 7,2г | mв2 = 75· 0, 12=9 г | mв3 = 7,2+9 = 16,2 г |
Ответ: массовая доля вещества в растворе составляет 15, 4%.


Задачи для самостоятельной работы
-
Смешали 50 г 5 %-ного раствора серной кислоты с 80 г 20 %-ного раствора серной кислоты. Каково процентное содержание серной кислоты во вновь полученном растворе? -
Смешали 70 г 10 %-ного раствора азотной кислоты с 80 г 25 %-ного раствора азотной кислоты. Каково процентное содержание азотной кислоты во вновь полученном растворе? -
Смешали 60 г 2 %-ного раствора поваренной соли с 80 г 4 %-ного раствора поваренной соли. Каково процентное содержание поваренной соли во вновь полученном растворе? -
Смешали 20 г 0,5 %-ного раствора сахара с 20 г 1 %-ного раствора сахара. Какова массовая доля сахара во вновь полученном растворе? -
Какова массовая доля нитрата калия в растворе, полученном после смешивания 90 г 2 %-ного раствора и 110 г 5 %-ного раствора нитрата калия. -
Вычислите массовую долю хлорида алюминия в растворе, полученном при смешивании 25г 10%-ного и 750г 25%-ного растворов

Типовая задача №1. Определить молярную концентрацию раствора серной кислоты, полученного при смешивании 25 мл 10-молярного раствора серной кислоты и 225 мл воды.
Д
 ано: Решение:
ано: Решение:V
 (p. H2SO4) = 25 млn (H2SO4) - ? В 1000 мл – 10 моль
(p. H2SO4) = 25 млn (H2SO4) - ? В 1000 мл – 10 мольC(H2SO4) = 10 моль/л в 25 мл – х моль
V(H2O) = 225мл х = 0,25 моль
C(H2SO4) = ? 2) V(р-ра) = 225 мл + 25 мл = 250 мл
3) C(H2SO4) - ? В 250 мл – 0,25 моль
в 1000 мл – х моль
х = 1 моль/л
Ответ: С = 1 моль/л.
Типовая задача №2. Определить молярную концентрацию 73,8 %-ного раствора серной кислоты, плотность которого 1,655 г/мл.
 Дано: Решение:
Дано: Решение:
 (H2SO4) = 0,738 (73,8%) 1)V(р) = 100 г /1,655 г/мл = 60,42 мл
(H2SO4) = 0,738 (73,8%) 1)V(р) = 100 г /1,655 г/мл = 60,42 мл(p) = 1,655 г/мл 2)В 60,42 мл р. – 73,8 г H2SO4
С=? в 1000 мл – х
х = 1221,45 г
3)n = 1221,45 г /98 г/мл = 12,46 моль
С = 12,45 моль/л
Ответ: С = 12,45 моль/л
Типовая задача №3. Какой объем 36,5 %-ного раствора соляной кислоты (пл. 1,18 г/мл) необходимо взять для приготовления 1000 мл 0,1 молярного раствора?
Д
 ано: Решение:
ано: Решение:
 (HCl) = 0,365 ( 36,5 %) 1)В 1000 мл р-ра – 0,1 моль HCl (3,65 г)
(HCl) = 0,365 ( 36,5 %) 1)В 1000 мл р-ра – 0,1 моль HCl (3,65 г)(p-ра) = 1,18 г/мл2) В 100 г р-ра – 36,5 г HCl
V(р) = 1000 млх – 3,65 г
С(HCl) = 0,1 моль/лх = 10 г (р-ра)
V(36,5 % р-ра) = ? 3)V(р-ра) = 10 г /1,18 г/мл = 8,4745 мл
Ответ: V = 8,4745 мл
Типовая задача №4. Определить массовую долю азотной кислоты в 4,97 молярном ее растворе, плотность которого 1,16 г/мл. Ответ: 27 %.;
 Дано: Решение:
Дано: Решение:С
 (HNO3) = 4,97 моль/л 1) m (р) = 1000 мл х 1,16 г/мл = 1160 г
(HNO3) = 4,97 моль/л 1) m (р) = 1000 мл х 1,16 г/мл = 1160 г(p) = 1,16 г/мл 2) m (HNO3) = 4,97 моль х 63 г/моль = 313,11 г
(HNO3) = ?= 313,11 г/1160 г = 0,27 (27 %)
Ответ: = 0,27 (27 %).
З

-
Определить молярную концентрацию 56,68 %-ного раствора азотной кислоты, плотность которого равна 1,356 г/мл. -
Определить молярную концентрацию 18 %-ного раствора соляной кислоты, плотность которого равна 1,089 г/мл. -
Вычислите молярную концентрацию 10 %-ного раствора серной кислоты (пл. 1,07 г/мл). -
Вычислите молярную концентрацию 16 %-ного раствора сульфата меди II, плотностью 1,18 г/мл.

IX ТИП. УСЛОЖНЕННЫЕ ЗАДАЧИ.
Типовая задача №1. Из раствора хлорида алюминия массой 110 г и массовой долей соли 10% выпарили 10 г воды и добавили 5 г той же соли. Массовая доля соли в полученном растворе равна _____%.
Решение:
ω=m (вещества)/m (раствора)
Найдем массу хлорида алюминия из первого раствора
m (вещества)= m (раствора)∙ω
m (вещества)= 110г ∙0,1 = 11 г
m (воды) = m (раствора)- m (вещества)
= 110-11 = 99 г
По условию выпарили 10 г воды.
Далее в раствор добавляют 5 г соли
Таким образом, в итоговом растворе будет содержаться:
воды 99-10 = 89 г
хлорида алюминия = 11 + 5 = 16 г
суммарная масса = 89 + 16 = 105 г
Подставим значения в формулу ω= 16∙100%/105 =15,2 %
Типовая задача №2. При смешивании 50%-ного и 10%-ного растворов одного и того же вещества получили 15%-ный раствор. Во сколько раз взяли больше по массе 10%-ного раствора, чем 50%-ного? Ответ запишите в виде целого числа.
Решение:
Пусть масса 10%-ного раствора в n раз больше, тогда
m - масса 50%-ного раствора, а n∙m - масса 10%-ного раствора, тогда
0,5m + 0,1∙(n∙m) = 0,15∙(m + n∙m)
0,5 + 0,1n = 0,15 + 0,15n
0,05n = 0,35
n=7 Ответ: 7
Типовая задача №3. Сколько граммов 10%-го раствора соли надо добавить к 300 г 30%-го раствора этой же соли, чтобы получить 14%-ный раствор? Ответ запишите в виде целого числа.
Решение:
Пусть m - масса добавляемого 10%-го раствора в граммах, тогда
m∙0,1+300∙0,3 = (m+300)∙0,14
0,1m+90=0,14m+42
0,04m=48
Ответ: 1200г
Типовая задача №4. Определите массы 10%-ного и 50%-ного (по массе) растворов, необходимые для получения 200 г 20%-ного раствора.
Решение:
ω1 = 10%, ω2 = 50%, ω3= 20%, m3 = 200 г, m2 = 200 - m1
Составляем уравнение:
m1∙ 10 + (200 - m1) ∙50 = 200 ∙20
40∙m1 = 6000
m1 = 150 (г),
m2 = 200 - m1 = 200 - 150 = 50 (г)
Ответ: 150 г, 50 г.
Типовая задача №5. Определите массы 25%-ного (по массе) раствора и воды, необходимые для получения 200 г 10%-ного раствора.
Решение:
ω1 = 25%, ω2 = 0%, ω3= 10%, m3 = 200 г
Составляем уравнение:
m1∙ 25 + m2 ∙ 0 = 200∙10
25 ∙m1 = 2000
m1 = 80 (г),
m2 = 200 - m1 = 200 - 80 =120 (г)
Ответ: 80 г, 120 г.
Типовая задача №6. Какую массу оксида серы (VI) следует добавить к 500 г 20%-ного раствора серной кислоты, чтобы увеличить её массовую долю до 40%?
Решение:
1) Составить уравнение химической реакции
SO3+H2O=H2SO4
2) Рассчитать массу серной кислоты, находившейся в исходном растворе и получившейся из х моль оксида серы (VI):
m1 (H2SO4)= m1(р-ра) ∙ ω1 (H2SO4)= 500 • 0,2 = 100 г
m (SO3)=n(SO3)∙M(SO3) = 80x (где х - число молей оксида серы)
m2 (H2SO4)= n(H2SO4) ∙M(H2SO4) = 98x
3) Рассчитать массу раствора и суммарную массу серной кислоты в нём:
m2(р-ра) = m2(р-ра) +m (SO3)= 500 + 80Х
m3 (H2SO4)= m1(H2SO4) + m2 (H2SO4) = 100 + 98x
4) Найти массу SO3, необходимую для растворения:
ω2 (H2SO4) = m3 (H2SO4)/ m2(р-