Файл: Теоретические основы процессов горения и тушения курсовая работа исследование пожаровзрывоопасности горючих жидкостей на примере пропилбензола.docx
Добавлен: 06.12.2023
Просмотров: 407
Скачиваний: 35
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
3. ОПРЕДЕЛЕНИЕ ХАРАКТЕРИСТИК ГОРЕНИЯ
3.2 Теоретический и практический расход воздуха на горение
3.3. Объем и состав продуктов полного сгорания
3.5 Стехиометрическая концентрация в паровоздушной смеси
3.6 Расчет температуры горения
4. ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЕЙ ПОЖАРНОЙ ОПАСНОСТИ
4.3 Температура самовоспламенения
4.4 Концентрационные пределы распространения пламени
4.5 Температурные пределы распространения пламени
4.6 Нормальная скорость распространения пламени
4.7 Критический диаметр огнегасящего канала и безопасного экспериментального максимального зазора
4.8 Минимальная энергия зажигания
4.11 Минимальное взрывоопасное содержание кислорода
4.12 Максимальное давление взрыва
| Температура, К | Теплосодержание, кДж/моль | |||||
| О2 | N2 | Воздух | СО2 | Н2О | SO2 | |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 100 | 3,0 | 2,9 | 2,9 | 3,8 | 3,3 | 4,1 |
| 200 | 6,0 | 5,8 | 5,8 | 8,0 | 6,8 | 8,5 |
| 300 | 9,1 | 8,8 | 8,9 | 12 | 10,4 | 13,2 |
| 400 | 12,4 | 11,8 | 11,9 | 17,3 | 14,0 | 18,2 |
| 500 | 15,7 | 14,9 | 15,1 | 22,3 | 17,8 | 23,3 |
| 600 | 19,1 | 18,1 | 18,3 | 27,5 | 21,7 | 28,5 |
| 700 | 22,5 | 21,3 | 21,5 | 32,8 | 25,8 | 33,9 |
| 800 | 26,0 | 24,6 | 24,8 | 38,2 | 29,9 | 39,3 |
| 900 | 29,6 | 28,0 | 28,2 | 43,8 | 34,2 | 44,8 |
| 1000 | 33,1 | 31,3 | 31,6 | 49,4 | 38,6 | 50,3 |
| 1100 | 36,8 | 34,8 | 35,1 | 55,1 | 43,2 | 55,9 |
| 1200 | 40,4 | 38,2 | 38,6 | 60,9 | 47,8 | 61,5 |
| 1300 | 44,0 | 41,7 | 42,1 | 66,8 | 52,6 | 67,2 |
| 1400 | 47,7 | 45,3 | 45,6 | 72,7 | 57,4 | 72,3 |
| 1500 | 51,5 | 48,8 | 49,2 | 78,6 | 62,3 | 78,4 |
| 1600 | 55,2 | 52,4 | 52,8 | 84,6 | 67,3 | 84,1 |
| 1700 | 59,0 | 55,9 | 56,4 | 90,5 | 72,4 | 89,8 |
| 1800 | 62,8 | 57,12 | 60,0 | 96,6 | 77,6 | 95,6 |
| 1900 | 66,6 | 63,1 | 63,6 | 102,6 | 82,8 | 101,2 |
| 2000 | 70,4 | 66,8 | 67,3 | 108,6 | 88,1 | 107,1 |
| 2100 | 74,2 | 70,4 | 71,0 | 120,7 | 93,4 | 112,7 |
| 2200 | 78,1 | 74,1 | 74,7 | 120,8 | 98,8 | 118,5 |
| 2300 | 82,0 | 77,8 | 78,4 | 126,9 | 104,2 | 124,2 |
| 2400 | 85,9 | 81,5 | 82,1 | 133,0 | 109,6 | 130,0 |
| 2500 | 89,9 | 85,1 | 85,9 | 159,2,1 | 115,1 | 135,8 |
| 2600 | 94,0 | 89,0 | 89,3 | 145,3 | 119,4 | 141,5 |
Таблица 4. Алгоритм расчета температуры горения.
| Определяемый параметр | Комментарий |
| 1)Объём и состав продуктов горения | ∑Vпгi: [ 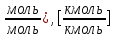 |
| 2)Низшая теплота сгорания | Q низш.=υ*∑* Q пр.реакции- υ*∑* Q исходн. в-в.: [ 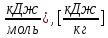 |
| 3)Среднее значение энтальпии продуктов горения | Hсредн= 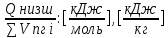 |
| 4)Подбираем Т1 по таблице (энтальпия газов при постоянном давлении) ориентируясь на Азот | |
| 5)Рассчитываем теплосодержание продуктов горения при температуре Т1 | Q1 = ∑Hi*Vпгi 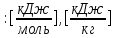 |
| 6)Если Q1>Qнизш, то подбираем Т2 поднимаясь вверх по той же таблице, до тех пор, пока не будет соблюдаться двойное неравенство Q2 | Q2 = ∑Hi*Vпгi 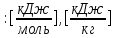 |
| 7)Когда Q2 | Тгор.адиаб.=Т2 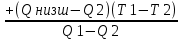 0С 0С |
Вычислимдействительнуютемпературугоренияпропилбензола
1.Запишем уравнение реакции горения пропилбензола:
C9H12 +12(О₂ + 3,76 N₂) = 9СО₂ +6Н₂О + 12· 3,76 N₂
β=12
2.По уравнению реакции горения определяем количество кмоль продуктов горения:
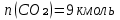
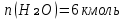
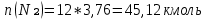
∑Vпгi=9+6+47,12=60,12
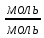
3.Рассчитаем Qнизш:
Qнизш = Ʋ∑Qпр. реакции - Ʋ∑Qисх.в-ва
Q(СO₂) =396,6
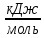
Q(Н₂O) =242,2

Q(
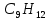 ) =-46,22
) =-46,22
Qнизшее(
 = (9*396,6+6*242,2)-(-46,22)=5068,82
= (9*396,6+6*242,2)-(-46,22)=5068,82
4.Определим среднее значение энтальпии:
Hсредн=
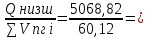 84,31
84,31 
5.Методом подбора подставим значения максимально нам подходящие:
-
Т1=24000С
6.Рассчитываем теплосодержание продуктов горения при температуре Т1:
H(СO₂)=133,0

H(Н₂O)=109,6

H(N₂)=81,5

Q1 = ∑Hi*Vпгi= 9*133,0+6*109,6+81,5*45,12=5331,88

5331,88> 5068,82
7.Рассчитываем теплосодержание продуктов горения при температуре Т2:
-
Т2=23000С
H(СO₂)=126,9

H(Н₂O)=104,2

H(N₂)=77,8

Q2 = ∑Hi*Vпгi= 9*126,9+6*104,2+77,8*45,12=5277,636

5277,36> 5068,82
-
Т3=22000С
H(СO₂)=120,8

H(Н₂O)=98,8

H(N₂)=74,1

Q3 = ∑Hi*Vпгi= 9*120,8+6*98,8+74,1*45,12=5023,392

5023,392˂ 5068,22˂5277,636-неравенство выполняется, следовательно, находим Тгор.:
Тгор= Т3 +
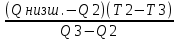 ; 0C
; 0CТгор=2200+
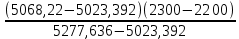 = 2218 0С
= 2218 0С4. ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЕЙ ПОЖАРНОЙ ОПАСНОСТИ
Для оценки пожаровзрывоопасности все вещества и материалы по агрегатному состоянию подразделяют на 4 группы: газы, жидкости и твердые и пыли.
Для полной оценки пожаровзрывоопасности вещества необходимо знать его физико-химические свойства, а также поведение вещества при его производстве, применении, хранении и транспортировке.
Особенно важно учитывать это при контакте исследуемого вещества с активными веществами, при длительном нагреве, облучении и других внешних воздействиях, в результате которых с течением времени могут измениться его физико-химические свойства.
После этого для вещества определяются показатели пожаровзрывоопасности.
4.1 Температура вспышки
Температура вспышки - это наименьшая температура конденсированного вещества, при которой в условиях специальных испытаний над его поверхностью образуются пары и газы, способные вспыхивать от источника зажигания; устойчивое горение при этом не возникает.
Температура вспышки является основным показателем пожарной опасность жидкостей.
Существует несколько способов расчета температуры вспышки.
4.1.1 Расчёт температуры вспышки
Температуру вспышки жидкостей в закрытом тигле в
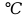 , имеющих нижеперечисленные виды связей, вычисляют по формуле:
, имеющих нижеперечисленные виды связей, вычисляют по формуле: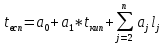
где
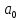 – размерный коэффициент, равный -73,14
– размерный коэффициент, равный -73,14
 ;
;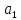 - безразмерный коэффициент, равный 0,659;
- безразмерный коэффициент, равный 0,659;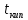 – температура кипения исследуемой жидкости,
– температура кипения исследуемой жидкости,  ;
;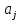 – эмпирические коэффициенты;
– эмпирические коэффициенты;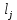 - количество связей всегда j в молекуле исследуемой жидкости.
- количество связей всегда j в молекуле исследуемой жидкости.Таблица 5. Эмпирические коэффициенты в зависимости от связей в структурной формуле вещества.
| Вид связи | 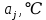 |
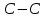 | -2,03 |
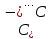 Химические связи, между атомами C внутри бензольного кольца | -0,28 |
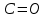 | 11,66 |
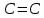 | 1,72 |
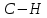 | 1,105 |
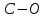 | 2,47 |
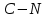 | 14,15 |
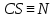 | 12,13 |
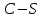 | 2,09 |
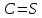 | -11,91 |
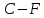 | 3,33 |
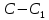 | 15,11 |
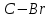 | 19,40 |
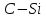 | -4,84 |
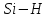 | 11,0 |
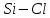 | 10,07 |
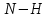 | 5,83 |
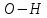 | 23,90 |
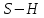 | 5,64 |
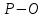 | 3,27 |
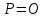 | 9,64 |