ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 25.10.2023
Просмотров: 103
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
.2 Ядерно-физические характеристики основных ПЭТ радионуклидов
.3 Методы получения радионуклида 18F
1.4 Нуклеофильное ароматическое радиофторирование
.5 Синтез [18F]фторбензальдегидов
2.1 Получение радионуклида фтор-18 в мишени циклотрона
.2 Получение комплексов [K+/K 2.2.2]18F- и [K+/K 2.2.2BB]18F-

Рис. 20 Радио-ТСХ хроматограмма. Условия: K.2.2.2BB, ДМФА, 30 минут, T=140°C, субстрат/криптанд=1/1. Выход реакции ̶ 27,6%
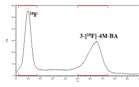
Рис. 21 Радио-ТСХ хроматограмма. Условия: K.2.2.2BB, ДМФА, 30 минут, T=140°C, субстрат/криптанд=1/2. Выход реакции ̶ 52%
Аналогичный эффект наблюдался и для K 2.2.2. Максимальный выход радиофторирования в данных условиях был 40% (см. стр.5 в табл.7). При применении того же катализатора при соотношении субстрат:криптанд - 1:1 эффективность радиофторирования была значительно ниже - 23% (см. стр.2 в табл.7).
Таким образом, увеличение количества [K+/K 2.2.2]2CO3 ([K+/K 2.2.2BB]2CO3) привело к значительному увеличению эффективности конверсии субстрата в случае использования обоих катализаторов. Данный факт отчасти имеет подтверждение в некоторых литературных источниках, в которых отмечается положительный эффект на выход радиофторирования карбонат- и бикарбонат- ионов (слабых нуклеофильных оснований) [11].
Интересно отметить, что при одинаковом содержании воды в QMA элюенте (15%) в случае K 2.2.2 ВВ максимальный выход продукта составил 54% (см. стр.5 в табл.7), тогда как при использовании К 2.2.2 - намного меньше - 18,5% (см. стр.5 в табл.7). На практике это может означать, что высокой эффективности радиофторирования при использовании K 2.2.2ВВ можно достичь и без тщательного удаления следов влаги при приготовлении реакционноспособного комплекса, более того, возможно, в этом случае необходимы каталитические количества протонного растворителя.
Выводы
Впервые было изучено влияние двух межфазных катализаторов - криптандов K 2.2.2 и K 2.2.2 BB на эффективность ароматического нуклеофильного радиофторирования на примере молекулы 4-метокси-3-нитробензальдегида.
На основании результатов серии опытов были подобраны условия реакции (растворитель ДМФА; время реакции 30 минут; температура - 140°C; мольное соотношение субстрат:криптанд - 1:2), при которых оба криптанда показали относительно высокие выходы радиофторирования: 40 % и 54 % для K 2.2.2 и K 2.2.2BB, соответственно.
Полученное соединение 4-метокси-3-[18F]фторбензальдегид может быть использовано в качестве меченого интермедиата в синтезе биологически активных макромолекул, потенциальных радиотрейсеров для позитронной эмиссионной томографии (ПЭТ).
Практическое значение использования криптанда K 2.2.2ВВ в ароматическом нуклеофильном радиофторировании может заключаться в упрощении процедуры приготовления реакционноспособного комплекса [K+/K 2.2.2BB]18F- для достижения высокой эффективности процесса.
Благодарности
Выражаю огромную благодарность за помощь в выполнении и подготовке выпускной квалификационной работы моим научным руководителям - Гомзиной Наталье Анатольевне и Красиковой Раисе Николаевне, а также всему коллективу лаборатории радиохимии Федерального государственного бюджетного учреждения науки Института мозга человека им. Н.П. Бехтеревой Российской академии наук (ИМЧ РАН): Ваулиной Дарие Дмитриевне, Кузнецовой Ольге Федоровне, Федоровой Ольге Сталлитовне, Орловской Виктории Владимировне.
Список цитированной литературы
[1] С.В. Медведев, Т.Ю. Скворцова, Р.Н. Красикова, Астрель-СПб, Санкт-Петербург, 2008, С. 319.
[2] R.A.J.O. Dierckx, A.Otte, E.F.J. de Vries, A.van Waarde, J.A den Boer, Springer Berlin Heidelberg, 2014, P. 849.
[3] B. Gulyás, C. Halldin, Q. J. Nucl. Med. Mol. Im., 2012, V. 56, PP 173-190.
[4] S. Richter and F. Wuest, Molecules, 2014, V. 19, PP 20536-20556.
[5] Johannes Ermert, BioMed Research International, 2014, V. 2014, Article ID 812973.
[6] F. Wuest in PET Chemistry (P. A. Schubiger, L. Lehmann, M. Friebe), Springer Berlin Heidelberg, 2007, PP 51-78.
[7] L. Li, M. N. Hopkinson, R. L. Yona, R. Bejot, A. D. Gee, V. Gouverneur, Chem. Sci. 2011, V. 2, PP 123 - 131.
[8] М.В Корсаков, ТЕЗА, Санкт-Петербург, 2008, С. 108.
[9] F. Dolle, D. Roeda, B. Kuhnast, M. Lasne in Fluorine and Health (A. Tressaud, G. Haufe), Elsevier, 2008, PP 3-67.
[10] O. Jacobson, D. O. Kiesewetter, X. Chen, Bioconjugate Chem., 2015, V. 26, PP 1−18
[11] R. Bejot and V. Gouverneur in Fluorine in Pharmaceutical and Medicinal Chemistry - From Biophysical Aspects to Clinical Applications (V. Gouverneur, K. Muller), Imperial College Press, London, 2012, PP 335-381.
[12] R. Schirrmacher, C. Wangler, E. Schirrmacher in Pharmaceutical Radiochemistry (I), Fluorine-18 Munich Molecular Imaging Handbook Series, 2010, V. 1, 73PP.
[13] H.H. Coenen in PET Chemistry (P. A. Schubiger, L. Lehmann, M. Friebe), Springer Berlin Heidelberg, 2007, PP 15-50.
[14] Vogt M., Huszar I., Argentini M., Oehninger H., Weinreich R., Appl. Radiat. Isot., 1986, V.17, P 59.
[15] K. Sander, T. Gendron, E. Yiannaki, K. Cybulska, T. L. Kalber, M. F. Lythgoe, E. Arstad, Sci. Rep, 2015, V. 5, Article number: 9941.
[16] B. Shen, D. Loffler, G. Reischl, H.J. Machulla, K.P. Zeller, Journal of Fluorine Chemistry, 2009, V. 130, PP 216-224
[17] I. Fernа́ndez, G. Frenking, E. Uggerud, J. Org. Chem., 2010, V. 75, PP 2971 - 2980.
[18] S. Preshlock, M. Tredwell, and V. Gouverneur, Chem. Rev., 2016, V. 116 (2), PP 719-776.
[19] T. Furuya, C.A. Kuttruff, T. Ritter, Curr. Opin. Drug Discovery Dev., 2008, V. 11, PP 803−819.
[20] Y.H. Oh, D.S. Ahn, S.Y. Chung, J.H. Jeon, S.W. Park, S. J. Oh, D. W. Kim, H. S. Kil, D. Y. Chi, S. Lee, J. Phys. Chem. A, 2007, V. 111, PP 10152-10161.
[21] D. W. Kim, D. S Ahn, Y. H. Oh, S. Lee, H. S. Kil, S. J. Oh, S. J. Lee, J.S. Kim, J. S. Ryu, D. H. Moon, D. Y Chi, J. Am. Chem. Soc., 2006, V. 128, PP 16394−16397.
[22] T. Koivula, J. Simecek, J. Jalomäki, K. Helariutta and A. J. Airaksinen, Radiochim. Acta, 2011, V. 99, PP 293-300.
[23] M. Tredwell and V. Gouverneur, Angew. Chem. Int. Ed., 2012, V. 51, PP 11426 - 11437
[24] J.W. Su, R.R. Burnette, ChemPhysChem, 2008, V. 9, PP 1989-1996.
[25] X. Wang, H. Wang, Y. Tan, J. Comput. Chem., 2008, V. 29, PP 1423-1428.
[26] K. Hamacher, H.H. Coenen, G. Stocklin, Nucl. Med. Biol, 1986, V.27, PP 235-238
[27] US Patent 5,264,570: Nov. 23, 1993
[28] Н.А. Гомзина, Д.А. Васильев, Р.Н. Красикова, Радиохимия, 2002, Т. 44, С. 366-337.
[29] B. Shen, D. Loffler, K.P. Zeller, M. Ubele, G. Reischl, H.J. Machulla, Journal of Fluorine Chemistry, 2007, V. 128, PP 1461-1468