Файл: Дипломный проект состоит из 186 страниц, 36 таблиц, 2 рисунка, 19 источников и 8 листов графического материала. Тема дипломного проекта Проект производства формалина.rtf
Добавлен: 25.10.2023
Просмотров: 277
Скачиваний: 5
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
3. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
Химизм процесса
Образование формальдегида происходит при прохождении метаноло -воздушной смеси через слой катализатора "серебро на носителе" при температуре в зоне контактирования:(550 - 600)С при работе в "мягком" режиме, (660 - 700)С при работе в "жестком" режиме.
Образование формальдегида осуществляется в результате протекания параллельных реакций простого и окислительного дегидрирования метанола:
СН3 ОН → СН2 О + Н2 - 93,4 кДж/моль (3.1)
СН3 ОН + 1/2 О2 → СН2 О + Н2 О + 147,4 кДж/моль (3.2)
Наряду с этими реакциями в системе протекает целый комплекс побочных превращений.
СН3 ОН + 2/3 О2 → СО2 + 575,1 кДж/моль(3.3)
СН2 О + 1/2 О2 → НСООН + 270,4 кДж/моль(3.4)
НСООН + 1/2 О2 → СО2 + Н2 О + 14,5 кДж/моль(3.5)
НСООН → СО + Н2О - 53,7 кДж/моль(3.6)
СН2 О → СО + Н2 + 1,9 кДж/моль (3.7)
2 СН2 О + Н2 О → СН3 ОН + НСООН + 122,0 кДж/моль(3.8)
Н2+ 1/2 О2 → Н2 О + 241,8 кДж/моль(3.9)
2 СН3 ОН → СН2 (ОСН3 )2 + Н2 О + 131,0 кДж/моль(3.10)
СО + 1/2 О2 → СО2 + 283,0 кДж/моль(3.11)
2 СО → СО2 + С + 172,5 кДж/моль (3.12)
Реакции (3.3) и (3.4) являются равновесными. Доля метанола израсходованного по реакции (3.4) составляет около 60 %, а остальное, по реакции (3.3).
Превращение метанола в формальдегид происходит в результате контакта молекул спирта с кислородом, хемосорбированным на атомах серебра, т.е. активными центрами катализатора являются поверхностные окислы серебра. Процесс получения формальдегида в целом сопровождается выделением тепла, за счет которого поддерживается необходимая температура в зоне контактирования и равновесие реакции дегидрирования смещается вправо.
Побочные реакции снижают выход формальдегида и определяют состав выхлопных газов (абгазов).
3.1 Механизм процесса
Ключевые превращения осуществляются на поверхности катализатора. Метанол адсорбируется на поверхности окисленного серебра. На поверхности свободного неокисленного серебра метанол адсорбируется очень слабо, причем с ростом температуры, количество поглощенного продукта уменьшается. Превращение поглощенного продукта уменьшается молекул спирта с кислородом, химсорбированным на атомах серебра, т.е. активными центрами катализатора являются поверхностные окислы серебра. В процессе хемосорбции кислорода на атомах серебра на адсорбированный кислород, происходит его диссоциация на атомные ионы (атомарная адсорбция). Выделяют 3 типа (области) адсорбции в зависимости от степени окисления серебра. При степени окисления до 0,1 - 0,12 см
3 О2/м2 Ag, т.е. в пределах покрытия поверхности монослоем кислорода, один атом кислорода связан с двумя поверхностными атомами серебра (Ag2SО):
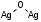 (3.14)
(3.14)С увеличением степени окисления до (0,22-0,26) см3 О2/м2Ag преобладает соединение, в котором атом кислорода связан с одним атомом поверхностного серебра (AgSO или Ag2SO2):
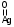 или
или 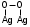 (3.15)
(3.15)При дальнейшем окислении возникает структура с большим содержанием кислорода на атом серебра:
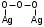 (3.16)
(3.16)Каталитическая специфичность серебра обуславливается особым состоянием кислорода на серебре. В то время как на других металлах при активированной адсорбции кислорода образуется только атомные ионы О- или О2-, вызывающие сгорание исходного продукта до углекислого газа, на серебре образуются поверхностные молекулярные ионы типа О2- или О22-. Поверхностный ион в состав поверхностного оксида Ag2+O2-. Атомные ионы, образующие с серебром активные центры при адсорбции метанола на них ослабляют или полностью разрывают химические связи в адсорбированной молекуле. Дальнейшие взаимодействия протекают между двумя хемосорбированными частицами, находящихся на соседних активных центрах или между хемосорбированной частицей и физически адсорбированной или налетающей из объема молекулой.
3.2 Термодинамика реакций
Реакции окислительного дегидрирования имеют тепловой эффект, зависящий от доли реакций окисления и особенно дегидрирования. Так как окисление протекает с выделением тепла, введением тех или иных количеств кислорода, можно широко вальировать эффект суммарного превращения. Это является одним из преимуществ окислительного дегидрирования – устраняется эндотермичность процесса и необходимость в постоянном подогреве реакционной массы. Практически для получения формальдегида для поддержания необходимой температуры в зоне контактирования, с учетом возмещения потерь тепла в окружающую среду. Необходимо, чтобы процесс шел на 55% через окисление и на 45% через дегидрирование. Тогда процесс можно осуществлять в реакторе адиабатического типа, не имеющего поверхности теплообмена. При таком соотношении реакций дегидрирования и окисления исходная паро-воздушная смесь должна содержать около 40% (объемные доли) метанола, что находится за верхним пределом взрываемости метанола в воздухе [36,5%].
Смещения равновесия реакций окислительного дегидрирования вправо обусловлено связыванием части водорода в воду, которая не принимает участия в равновесии реакций гидрирования – дегидрирования.
-CH2O
+0,5О2
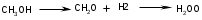 (3.17)
(3.17)Разбавление метанола на 10 - 12% водой также смещает равновесие в сторону выхода формальдегида, за счет подавления побочных реакций. Образованию побочных реакций препятствует недостаток кислорода в процессе, т.к. глубокое окисление не получает значительного развития. Выход формальдегида на пропущенное сырье достигает 80-85% при степени конверсии метанола 85-90%. При дегидрировании ввиду отщепления водорода всегда происходит увеличение объемов газа, поэтому повышение степени конверсии благоприятствует низкое давление. Поэтому для процессов дегидрирования выбирают давление, близкое к атмосферному, а в некоторых случаях процесс осуществляют в вакууме. В места вакуума можно применять разбавление реакционной массы водяным паром.
В производстве формалина метанол разбавляют на 10 - 12% водяным паром.
Наличие водяных паров в реакционной массе ведет к снижению парциальных давлений реагентов и росту равновесной степени конверсии.
3.3 Кинетика реакций
При температуре 600 - 700°С скорость превращения метанола в формальдегид лимитируется подводом реагентов к поверхности катализатора, т.е. процесс протекает во внедиффузионной области. Кинетическая область протекания реализуется при температуре ниже 300°С. Признаки превращения метанола в формальдегид наблюдается уже при температуре 200 - 240°С. Выход формальдегида формальдегида в этих условиях составляет примерно 1% при конверсии метанола 1,5 - 2%.
При температуре 200°С выход формальдегида 3,6% при конверсии метанола 4,6%. Реакции протекают в этом случае по окислительному механизму. При температуре 290 - 300°С реакция смещается в переходную область. При 300°С происходит «зажигание» катализатора. Температура самопроизвольно повышается до 600 - 700°С, соответствующей заданному соотношению О2:СН3ОН. Обратному переходу процесса в кинетическую область способствует снижению температуры до 350°С за счет увеличения скорости потока реагентов. В этом случае формальдегид является промежуточным продуктом реакции: при времени контакта (5 - 10)*10-3 секунд происходит накапливание его, а при дальнейшем времени контакта наблюдается его расходование. Конечный продукт реакции – углекислый газ. При 370 - 400°С процесс перемещается в область внешней диффузии. Протекание процесса в диффузионной области обуславливается значительной разности концентраций реагентов и продуктов реакции на поверхности серебра и в потоке. Само химическое взаимодействие между молекулами метанола и кислорода происходит очень быстро и
разогрев катализатора настолько велик, что он оказывается достаточным для поддержания высокой температуры реакции. Конверсия кислорода резко возрастает. На промышленных установках при (600 - 700)°С селективность достигает значений 91 - 93%. Объемное содержание водорода в газообразных продуктах 18 - 20%. То есть проведение реакции в диффузионной области преимущественней, т.к. резко возрастает активность и селективность катализатора, что приводит к значительному повышению производительности катализатора (на 1,5-2,0 порядка) и исключает необходимость подвода тепла из вне для поддержания температуры в реакторе. Максимальная селективность образования формальдегида 90% происходит при значении соотношения О2:СН3ОН в пределах 0,68:0,7. При движении горячей реакционной смеси от слоя катализатора происходит нарастание количества углекислого газа и водорода с одновременным уменьшением формальдегида. Для снижения этого процесса необходимо охлаждение реакционной смеси поверхностью с температурой не выше 170°С. Это осуществляется в подконтактном холодильнике.
4. ВЫБОР И ОБОСНОВАНИЕ ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ
Выбор технологической схемы обусловлен мощностью производства формалина и назначением готового продукта. Мощность производства составляет 380 тыс. тонн в год 37% формалина. Процесс оформлен в виде трех технологических ниток, единичной мощности 126,6 тыс. тонн в год, каждая. С целью снижения металлоемкости и принятых технологических решений ряд узлов выполнен общим для трех ниток: узел подготовки сырья, узел очистки годовых выбросов, узел очистки, опорожнения, продувки.
Процесс получения формалина представлен в виде трех параллельных ниток, состоящих из следующих узлов:
- подготовка сырья и получения метаноло-воздушной смеси;
- синтез формальдегида;
- получение формалина - ″сырца″ (абсорбция формалина);
- ректификация формалина - ″сырца″,
и узлов, выполненных общими для трех ниток:
- сбор и переработка некондиционных и дренируемых продуктов,
- факельная установка,
- очистка газовых выбросов,
- теплопункт,
- получение катализатора.
Некоторые заводы не включают в технологическую схему процесс ректификации, но как показывает практика затраты на эту стадию полностью себя оправдывают. Во-первых, исключается возможность получения нестандартного продукта; во-вторых, получается возможность получать как безметанольный продукт, так и формалин высокой концентрации.
Исходя из рассмотренных стадий получения технического формалина, характеризуем каждую из них по технологической схеме цеха производства формалина.
5. ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
5.1 Получение метаноло-воздушной смеси
Метанол из емкости поступает через обратные клапаны к I, II, III технологическим ниткам на "метанольные гребенки", где к "свежему" метанолу добавляется "возвратный" метанол с узлов ректификации. Метанол (для одной технологической нитки) от "метанольной гребенки" предварительно подогревается в 2-х нижних встроенных теплообменниках абсорбционной колонны поз.К1 до 65°С, и поступает для образования спиртовоздушной смеси в спиртоиспаритель. Чтобы снизить побочные реакции процесса получения формальдегида, метанол в смесителе поз.Х2 смешивается с деминерализованной или надсмольной водой.
Спиртоиспаритель состоит из испарителя поз.Е2а, выносной греющей камеры - теплообменника поз.Т1 и смонтированного под ней отстойника поз.Е2б.
Воздух из атмосферы, предварительно очищенный от пыли на фильтре поз.Ф1, подается воздуходувками поз.М1/1-3, с давлением (0,5 - 0,8) кгс/см2 и температурой (30 - 70)°С и расходом (3000 - 11000) м3/ч через обратный клапан в верхнюю часть выносной греющей камеры поз.Т1. На каждую технологическую нитку предусмотрено по три воздуходувки производительностью 6000 м3/ч каждая - две в работе, одна в резерве или ремонте.
Метаноло - водяная смесь из смесителя поз.Х2 с температурой (20 - 65)°С и расходом (6 - 14) м3/ч подается в отстойник спиртоиспарителя поз.Е2б, где в конической части отделяются и собираются механические примеси.
Уровень в испарителе поз.Е2а поддерживается подачей метанола. При уровне метанола в испарителе поз.Е2а 20% воздуходувки поз.М1/1-3 отключаются.
Метанол в спиртоиспарителе подогревается паром давлением 2 кгс/см2, подаваемым из паросборника поз.Е4 в выносную греющую камеру теплообменника спиртоиспарителя поз.Т1. Температура метанола в испарителе поз.Е2а поддерживается (52-85)°С в зависимости от концентрации метанола.
Образование метаноло - воздушной смеси происходит в верхней части выносной греющей камеры поз.Т1, куда через барботер подается воздух от воздуходувок поз.М1/1-3. Затем в испарителе поз.Е2а жидкий метанол отделяется, с помощью каплеотбойника, и метаноло - воздушная смесь поступает в перегреватель поз.Т2.