ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 25.10.2023
Просмотров: 195
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Обоснование выбора темы и ее актуальность
1.1. Общая характеристика протонной терапии
1.2. Известные эксперименты по облучению биологических объектов
1.3. Известные методы верификации положения
Глава 2. Экспериментальная часть
2.1. Выбор конструкции фантома для облучения яиц
3.1. Организация и планирование работ по теме
Поскольку протон намного тяжелее электрона, его взаимодействие с электронами не приводит к заметному отклонению от его первоначального направления. Когда протон проходит близко к ядру, и, если расстояние сближения не слишком мало, он отклоняется кулоновским отталкиванием, но не теряет энергии. Каждое отклонение может быть небольшим, но накопление таких отклонений, называемое «многократным кулоновским рассеянием», может привести к существенному латеральному растеканию протонов.
Если расстояние сближения мало, протоны также могут испытывать рассеяние на ядрах. Вероятность ядерных взаимодействий мала по сравнению с кулоновскими взаимодействиями. Однако она увеличивается с увеличением атомного номера ядра-мишени и энергии протонов. Подсчитано, что до 20 % протонов самых высоких энергий в терапевтическом диапазоне подвергаются ядерным взаимодействиям на своем пути. При ядерных взаимодействиях первичный протон сообщает ядру большую часть своей энергии и может рассеиваться на большой угол. 5
Ядерные взаимодействия могут быть дополнительно классифицированы как упругие и неупругие. При упругом рассеянии ядро только отскакивает, а полная кинетическая энергия сохраняется. При неупругом рассеянии ядро-мишень поглощает часть энергии и может подвергаться нескольким различным типам вторичных событий, таких как распад на более мелкие фрагменты, испускание мгновенных гамма-лучей, превращение в радиоактивное и т. д. Ядра отдачи и более тяжелые фрагменты поглощаются в основном в точке взаимодействия. Однако рассеянные протоны и особенно вторичные нейтроны могут преодолевать относительно большие расстояния и создавать «гало» малой дозы.6
Биологически протоны подобны фотонам. На основании многочисленных экспериментов in vitro и на животных предполагалось, что протоны обладают на 10 % более высокой относительной биологической эффективностью (ОБЭ) по сравнению с фотонами (т.е. ОБЭ = 1,1). В клинической практике физическую дозу в Гр, доставляемую протонами, умножают на 1,1, чтобы получить биологически эффективную дозу в Гр (ОБЭ). Однако эксперименты проводились в широком диапазоне противоречивых условий и имели большую вариабельность результатов. Все чаще признается, что текущая практика использования среднего ОБЭ, равного 1,1, может повлиять на качество протонной обработки. 7
В протонной терапии есть два основных метода доставки. Один из них называется пассивным рассеянием и состоит в создании широкого луча, другой называется активным сканированием и состоит в сканировании остронаправленных лучей по всему объему мишени. Однако данных о биологическом воздействии рассеянных и сканированных пучков протонов на нормальные ткани недостаточно. С одной стороны, пассивное рассеяние приводит к передозировке в здоровых тканях в латеральных отделах проксимальных слоев, с другой стороны, активное сканирование приводит к сильным различиям мощности дозы в нормальных и опухолевых тканях. Действительно, мощность дозы совершенно различна между проксимальным и дистальным слоями, где мощность дозы может достигать десятков Гр/с. Точно так же продолжительность фракции, создаваемой активным пучком протонов, может составлять от нескольких секунд в дистальной зоне до нескольких минут в проксимальном слое. Интрафракционирование также отличается, так как выбранная доза будет подаваться одним импульсом для самой дистальной части опухоли, тогда как она будет доставляться большим количеством импульсов для самой проксимальной части. Таким образом, эти свойства протонных пучков могут приводить к биологическим эффектам в окружающих здоровых тканях.
Протоны ускоряются до терапевтических энергий, обычно в диапазоне от 70 до 250 МэВ, с помощью циклотронов (рис. 2) или синхротронов (рис. 3).
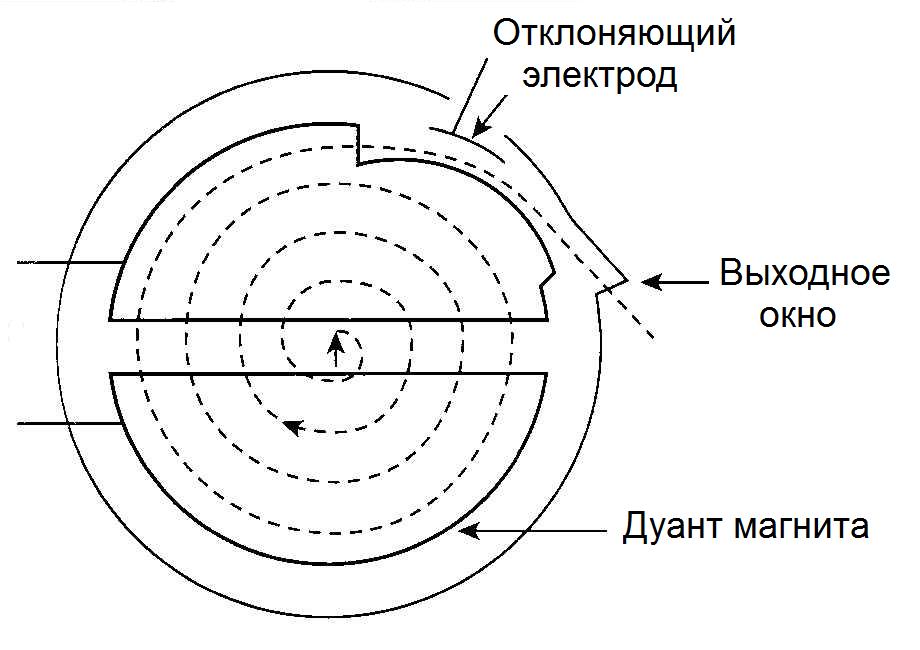
Рис. 2. Устройство циклотрона
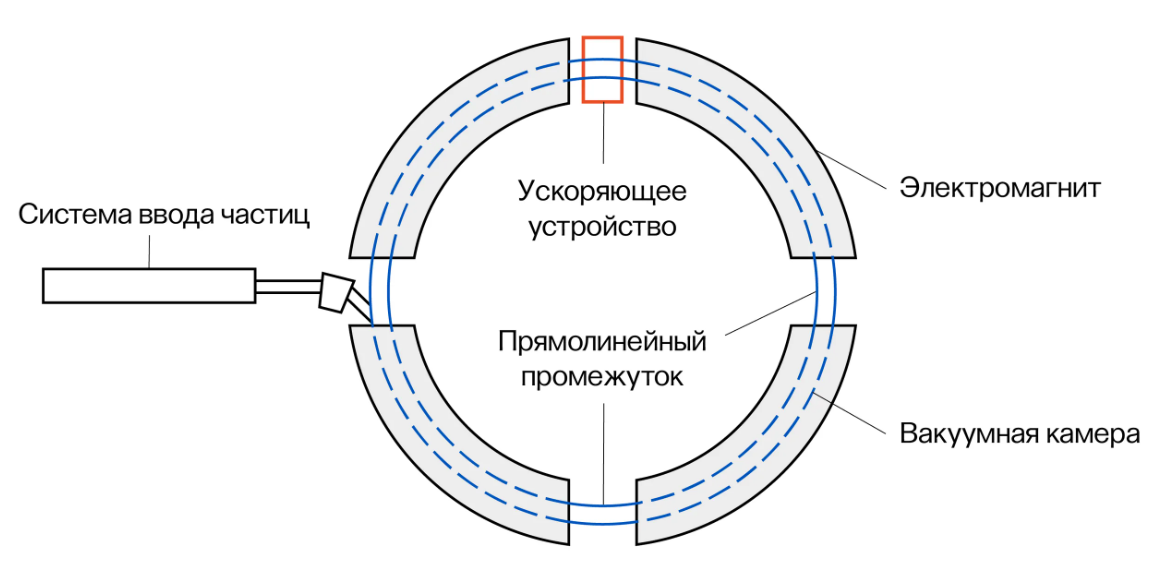
Рис. 3. Устройство синхротрона
Циклотроны производят непрерывный поток протонов. Они более компактны и имеют более высокую интенсивность излучения. Протоны ускоряются до максимальной энергии циклотрона, а требуемые более низкие энергии достигаются за счет электромеханической вставки поглотителей энергии на пути протонов между ускорителем и процедурным кабинетом.
Синхротроны, с другой стороны, ускоряют группы протонов до желаемой энергии. Каждая партия протонов может иметь разную энергию. Как правило, преимущества синхротронов заключаются в том, что они имеют большую энергетическую гибкость, меньший разброс энергии и более низкое энергопотребление. Независимо от типа ускорителя, выведенный узкий моноэнергетический пучок магнитно направляется по линии пучка к соплу, установленному, в большинстве случаев, на вращающемся портале в процедурном кабинете. Типичный ускоритель протонов может обслуживать несколько комнат. Учитывая высокую стоимость создания и эксплуатации многокомнатных центров протонной терапии, также доступны однокомнатные системы.
Использование магнитного сканирования пучков протонов последовательности падающих энергий позволяет проводить протонную терапию с модулированной интенсивностью (IMPT), в которой сканирующие пучки протонов последовательностей энергий используются для «лепки» распределения дозы вокруг сложных критических структур, что позволяет улучшить защиту этих структур без ущерба для охвата целей. Интенсивность пучков, состоящих из нескольких сканирующих лучей, направленных на опухоль с разных направлений, оптимизируется с помощью компьютерных математических алгоритмов, чтобы сбалансировать дозу опухоли с пределами допусков нормальной ткани. 8
На сегодняшний день большинство клинических данных, подтверждающих использование протонной терапии, получены в результате небольших нерандомизированных исследований. Ниже представлены данные о некоторых клинических исследованиях протонной терапии.
Дети особенно восприимчивы к поздним побочным эффектам радиоактивного воздействия. Учитывая значительное снижение облучения нормальных тканей с помощью протонной терапии и, следовательно, возможность снижения неблагоприятных эффектов, протонная терапия широко применяется для лечения рака у детей. Многочисленные публикации предполагают, что показатели контроля заболевания и выживаемости, наблюдаемые при протонной терапии, сравнимы с таковыми при фотонной терапии.
Заболеванием, для лечения которого используется протонная терапия, - это злокачественные новообразования черепа или носовых пазух. Для лечения этих опухолей требуются высокие дозы облучения. Однако непосредственная близость критических нормальных тканей, например, ствола мозга или оптических структур, часто препятствует доставке высоких доз фотонами даже с использованием самых передовых методов. Физические свойства протонов подходят для лечения этих сложных случаев. Исследователи из Института Пауля Шеррера, первыми применившие в клинической практике протонную терапию со сканирующим лучом опубликовали отличные результаты использования таких методов у пациентов с поражениями в области черепа.9
Протонная терапия также показывает особые перспективы в лечении опухолей головного мозга. Потенциальные преимущества протонной терапии при лечении опухолей головного мозга заключаются в уменьшении побочных эффектов, особенно когнитивной дисфункции, а также в потенциальном повышении дозы при радиационно-резистентных опухолях, таких как глиобластома. Wenkel и соавт. изучили 46 пациентов с доброкачественными менингиомами основания черепа, которых лечили комбинацией фотонов и протонов, и сообщили о безрецидивных показателях 100% и 88% через 5 и 10 лет соответственно10. Noel и соавт. также сообщили результаты лечения 51 пациента с менингиомами основания черепа с помощью фотонной и протонной терапии. Четырехлетняя местная контрольная и общая выживаемость составила 98% и 100% соответственно11.
Таким образом, первоначальные результаты, по-видимому, поддерживают использование терапии частицами при менингиомах, особенно при поражениях в непосредственной близости от критических структур.
Исследователи из Гейдельбергского университета, в котором используется технология доставки протонов с помощью сканирующего луча, также сообщили о 19 пациентах, получавших лечение от глиом низкой степени злокачественности. Подобно методам лечения на основе фотонов, их первоначальные результаты свидетельствуют о высоких показателях контроля над опухолью и приемлемых показателях токсичности.
12 Важно отметить, что в недавнем исследовании Shih и соавт. сообщили о результатах проспективного исследования, в которое были включены пациенты с глиомами II степени и оценивали когнитивную функцию и качество жизни после протонной терапии. В исследование были включены 20 пациентов с супратенториальными опухолями. При среднем периоде наблюдения 5,1 года показатели когнитивной функции были стабильными или даже улучшились по сравнению с исходным уровнем.13
Возможно, одной из наиболее технически сложных для лечения локализаций заболевания, особенно для протонной терапии, является рак легкого, в основном из-за чувствительности распределения дозы протонов к сильно гетерогенным тканям на пути протонов и к дыхательному движению. Более того, если дистальный край луча падает на участок легкого с низкой плотностью, чтобы обеспечить запасы, протоны будут продолжать движение и могут облучать большие участки легкого, пока не встретятся с тканями с более высокой плотностью, чтобы остановить их. Первоначальные ретроспективные исследования и исследования ранней фазы с одной группой предполагают превосходные профили токсичности и показатели контроля заболеваний для протонов. 27 , 51 – 5314
О раке молочной железы, одном из злокачественных новообразований, наиболее часто лечащемся с помощью лучевой терапии, имеется относительно мало сообщений о протонной терапии. Тем не менее, возрастает интерес к использованию протонной терапии как для пациентов, перенесших лампэктомию, так и для пациентов, нуждающихся в адъювантном облучении после мастэктомии. Первоначальные результаты показали хорошие результаты.15
Итак, хотя протонная терапия не нова, высокая стоимость создания и эксплуатации оборудования для протонной терапии ограничивает исследования и разработки, необходимые для максимизации ее клинической эффективности. Считается, что преимуществом протонов с точки зрения их физических характеристик является то, что они вносят меньшую дозу вне объема мишени, т. е. имеют меньшую интегральную дозу в организме в целом. В то время, как большой объем ткани вдали от мишени может получить значительно меньшую дозу, доза для объема нормальной ткани, непосредственно окружающей мишень, может быть выше для протонов. Уменьшить полутень падающих на пациента лучей можно
, используя апертуры и минимизируя размер пятна.16
Кроме того, изменения в анатомии пути протонов во время одной фракции и в течение курса протонной терапии могут нарушить конформность распределения доз. Это особенно верно для участков лечения, таких как легкие и голова и шея, где встречаются сложные неоднородности, где может быть трудно предотвратить доставку высоких доз к значительным объемам нормальных тканей в дистальных отделах.