Добавлен: 07.11.2023
Просмотров: 45
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Растворенные формы кадмия в природных водах представляют собой главным образом минеральные и органо-минеральные комплексы. Основной взвешенной формой кадмия являются его сорбированные соединения. Значительная часть кадмия может мигрировать в составе клеток гидробионтов.
В речных незагрязненных и слабозагрязненных водах кадмий содержится в субмикрограммовых концентрациях, в загрязненных и сточных водах концентрация кадмия может достигать десятков микрограммов в 1 дм3.
Соединения кадмия играют важную роль в процессе жизнедеятельности животных и человека. В повышенных концентрациях токсичен, особенно в сочетании с другими токсичными веществами.
ПДКв составляет 0.001 мг/дм3, ПДКвр — 0.0005 мг/дм3 (лимитирующий признак вредности — токсикологический).
Кобальт
В природные воды соединения кобальта попадают в результате процессов выщелачивания их из медноколчедановых и других руд, из почв при разложении организмов и растений, а также со сточными водами металлургических, металлообрабатывающих и химических заводов. Некоторые количества кобальта поступают из почв в результате разложения растительных и животных организмов.
Соединения кобальта в природных водах находятся в растворенном и взвешенном состоянии, количественное соотношение между которыми определяется химическим составом воды, температурой и значениями рН. Растворенные формы представлены в основном комплексными соединениями, в т.ч. с органическими веществами природных вод. Соединения двухвалентного кобальта наиболее характерны для поверхностных вод. В присутствии окислителей возможно существование в заметных концентрациях трехвалентного кобальта.
Кобальт относится к числу биологически активных элементов и всегда содержится в организме животных и в растениях. С недостаточным содержанием его в почвах связано недостаточное содержание кобальта в растениях, что способствует развитию малокровия у животных (таежно-лесная нечерноземная зона). Входя в состав витамина В12, кобальт весьма активно влияет на поступление азотистых веществ, увеличение содержания хлорофилла и аскорбиновой кислоты, активизирует биосинтез и повышает содержание белкового азота в растениях. Вместе с тем повышенные концентрации соединений кобальта являются токсичными.
В речных незагрязненных и слабозагрязненных водах его содержание колеблется от десятых до тысячных долей миллиграмма в 1 дм3, среднее содержание в морской воде 0.5 мкг/дм3. ПДКв составляет 0.1 мг/дм3, ПДКвр 0.01 мг/дм3.
Марганец
В поверхностные воды марганец поступает в результате выщелачивания железомарганцевых руд и других минералов, содержащих марганец (пиролюзит, псиломелан, браунит, манганит, черная охра). Значительные количества марганца поступают в процессе разложения водных животных и растительных организмов, особенно сине-зеленых, диатомовых водорослей и высших водных растений. Соединения марганца выносятся в водоемы со сточными водами марганцевых обогатительных фабрик, металлургических заводов, предприятий химической промышленности и с шахтными водами.
Понижение концентрации ионов марганца в природных водах происходит в результате окисления Mn(II) до MnO2 и других высоковалентных оксидов, выпадающих в осадок. Основные параметры, определяющие реакцию окисления, - концентрация растворенного кислорода, величина рН и температура. Концентрация растворенных соединений марганца понижается вследствие утилизации их водорослями.
Главная форма миграции соединений марганца в поверхностных водах - взвеси, состав которых определяется в свою очередь составом пород, дренируемых водами, а также коллоидные гидроксиды тяжелых металлов и сорбированные соединения марганца. Существенное значение в миграции марганца в растворенной и коллоидной формах имеют органические вещества и процессы комплексообразования марганца с неорганическими и органическими лигандами. Mn(II) образует растворимые комплексы с бикарбонатами и сульфатами. Комплексы марганца с ионом хлора встречаются редко. Комплексные соединения Mn(II) с органическими веществами обычно менее прочны, чем с другими переходными металлами. К ним относятся соединения с аминами, органическими кислотами, аминокислотами и гумусовыми веществами. Mn(III) в повышенных концентрациях может находиться в растворенном состоянии только в присутствии сильных комплексообразователей, Mn(YII) в природных водах не встречается.
В речных водах содержание марганца колеблется обычно от 1 до 160 мкг/дм3, среднее содержание в морских водах составляет 2 мкг/дм3, в подземных - n.102 - n.103 мкг/дм3.
Концентрация марганца в поверхностных водах подвержена сезонным колебаниям.
Факторами, определяющими изменения концентраций марганца, являются соотношение между поверхностным и подземным стоком, интенсивность потребления его при фотосинтезе, разложение фитопланктона, микроорганизмов и высшей водной растительности, а также процессы осаждения его на дно водных объектов.
Роль марганца в жизни высших растений и водорослей водоемов весьма велика. Марганец способствует утилизации CO2 растениями, чем повышает интенсивность фотосинтеза, участвует в процессах восстановления нитратов и ассимиляции азота растениями. Марганец способствует переходу активного Fe(II) в Fe(III), что предохраняет клетку от отравления, ускоряет рост организмов и т.д. Важная экологическая и физиологическая роль марганца вызывает необходимость изучения и распределения марганца в природных водах.
Для водоемов санитарно-бытового использования установлена ПДКв (по иону марганца), равная 0.1 мг/дм3.
Ниже представлены карты распределения средних концентраций металлов: марганца, меди, никеля и свинца, построенные по данным наблюдений за 1989 - 1993 гг. в 123 городах. Использование более поздних данных предполагается нецелесообразным, поскольку в связи с сокращением производства значительно снизились концентрации взвешенных веществ и соответственно, металлов.
Влияние на здоровье. Многие металлы являются составляющей пыли и оказывают существенное влияние на здоровье.
Марганец поступает в атмосферу от выбросов предприятий черной металлургии (60% всех выбросов марганца), машиностроения и металлообработки (23%), цветной металлургии (9%), многочисленных мелких источников, например, от сварочных работ.
В
 ысокие концентрации марганца приводят к появлению нейротоксических эффектов, прогрессирующего поражения центральной нервной системы, пневмонии. С
ысокие концентрации марганца приводят к появлению нейротоксических эффектов, прогрессирующего поражения центральной нервной системы, пневмонии. С
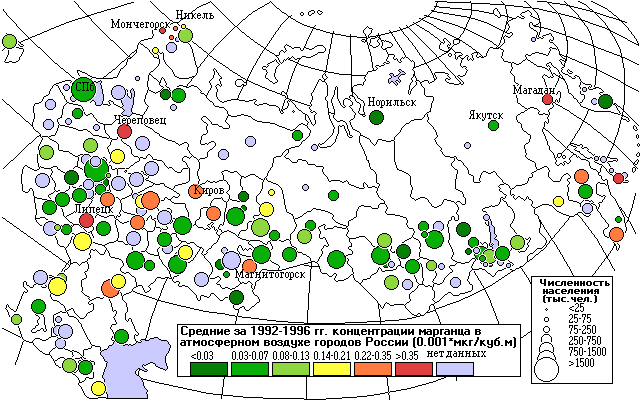
амые высокие концентрации марганца (0,57 - 0,66 мкг/м3) наблюдаются в крупных центрах металлургии: в Липецке и Череповце, а также в Магадане. Больше всего городов с высокими концентрациями Mn (0,23 - 0,69 мкг/м3) сосредоточено на Кольском полуострове: Заполярный, Кандалакша, Мончегорск, Оленегорск (см. карту).
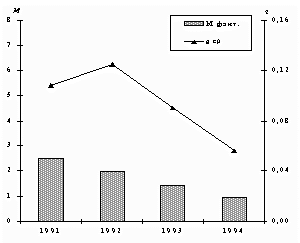
За 1991 - 1994 гг. выбросы марганца от промышленных источников снизились на 62%, средние концентрации – на 48%.
Медь
Медь - один из важнейших микроэлементов. Физиологическая активность меди связана главным образом с включением ее в состав активных центров окислительно-восстановительных ферментов. Недостаточное содержание меди в почвах отрицательно влияет на синтез белков, жиров и витаминов и способствует бесплодию растительных организмов. Медь участвует в процессе фотосинтеза и влияет на усвоение азота растениями. Вместе с тем, избыточные концентрации меди оказывают неблагоприятное воздействие на растительные и животные организмы.
Содержание меди в пресных природных водах колеблется от 2 до 30 мкг/дм3, в морских водах - от 0.5 до 3.5 мкг/дм3. Повышенные концентрации меди (до нескольких граммов в литре) характерны для кислых рудничных вод.
В природных водах наиболее часто встречаются соединения Cu(II). Из соединений Cu(I) наиболее распространены трудно растворимые в воде Cu2O, Cu2S, CuCl. При наличии в водной среде лигандов наряду с равновесием диссоциации гидроксида необходимо учитывать образование различных комплексных форм, находящихся в равновесии с акваионами металла.
Основным источником поступления меди в природные воды являются сточные воды предприятий химической, металлургической промышленности, шахтные воды, альдегидные реагенты, используемые для уничтожения водорослей. Медь может появляться в результате коррозии медных трубопроводов и других сооружений, используемых в системах водоснабжения. В подземных водах содержание меди обусловлено взаимодействием воды с горными породами, содержащими ее (халькопирит, халькозин, ковеллин, борнит, малахит, азурит, хризаколла, бротантин).
Предельно допустимая концентрация меди в воде водоемов санитарно-бытового водопользования составляет 0.1 мг/дм3 (лимитирующий признак вредности — общесанитарный), в воде рыбохозяйственных водоемов - 0.001 мг/дм3.
| Г 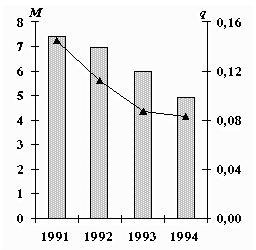 ород ород | M |
| Норильск | 2382,3 |
| Ревда | 1162,9 |
| Мончегорск | 933,7 |
| Красноуральск | 653,0 |
| Кольчугино | 140,1 |
| Никель | 81,8 |
| Заполярный | 81,0 |
Выбросы М (тыс.т/год) оксида меди и среднегодовые концентрации q (мкг/м3) меди.
Медь поступает в воздух с выбросами металлургических производств. В выбросах твердых веществ она содержится в основном в виде соединений, преимущественно оксида меди.
На долю предприятий цветной металлургии приходится 98,7 % всех антропогенных выбросов этого металла, из них 71% осуществляется предприятиями концерна “Норильский никель”, расположенными в Заполярном и Никеле, Мончегорске и Норильске, а еще примерно 25% выбросов меди осуществляются в Ревде, Красноуральске, Кольчугино и в других.
В
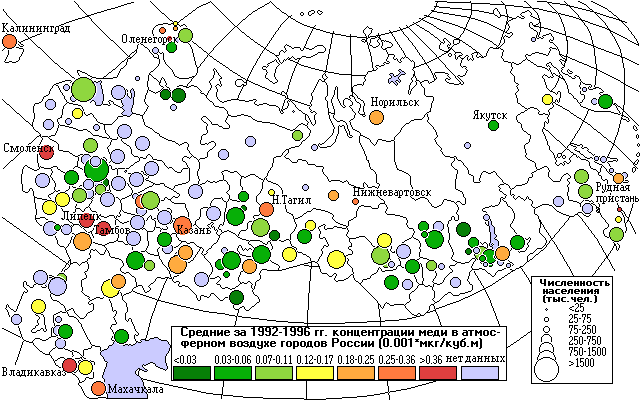
ысокие концентрации меди приводят к интоксикации, анемии и заболеванию гепатитом.
Как видно из карты, самые высокие концентрации меди отмечены в городах Липецк и Рудная Пристань. Повышены также концентрации меди в городах Кольского полуострова, в Заполярном, Мончегорске, Никеле, Оленегорске, а также в Норильске.
Выбросы меди от промышленных источников снизились на 34%, средние концентрации – на 42%.
Молибден
Соединения молибдена попадают в поверхностные воды в результате выщелачивания их из экзогенных минералов, содержащих молибден. Молибден попадает в водоемы также со сточными водами обогатительных фабрик, предприятий цветной металлургии. Понижение концентраций соединений молибдена происходит в результате выпадения в осадок труднорастворимых соединений, процессов адсорбции минеральными взвесями и потребления растительными водными организмами.