Файл: Лекция Ферменты структура, свойства, классификация. Регуляция активности ферментов.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 09.11.2023
Просмотров: 43
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Лекция 1. Ферменты: структура, свойства, классификация. Регуляция активности ферментов
Цель лекции
Уметь интерпретировать свойства и функции ферментов для диагностики и лечения болезней, связанных с нарушением функционирования ферментов. Уметь использовать знания о механизмах регуляции активности ферментов при изучении состояния обмена веществ, а также для обоснования использования препаратов, действующих по принципу ферментативных ингибиторов или активаторов.
План лекции
1. Определение ферментов
2. Классификация ферментов
3. Активность ферментов
4. Структура ферментов
5. Аллостерический центр
6. Кинетика ферментативных реакций
7. Свойства ферментов как биологических катализаторов
8. Специфичность ферментов
9. Регуляция активности ферментов: активация и ингибирование
9.1. Активаторы ферментов
9.2. Ингибирование ферментов
10. Аллостерическая регуляция
11. Изоферменты
12. Ферменты в медицине
Определение ферментов
Ферменты (энзимы) – это биологические катализаторы, образующиеся в клетках и по химической структуре представляющие собой простые или сложные белки.
Наука о ферментах называется энзимологией.
При определенных условиях, близких in vivo, ферменты как биологические катализаторы могут работать и in vitro, что используется в аналитических целях.
С химическими катализаторами ферменты объединяют следующие свойства:
1) ферменты работают в небольших количествах;
2) ферменты не изменяют положения равновесия реакции;
3) ферменты не изменяют направление реакции;
4) ферменты не расходуются в процессе реакции;
5) ферменты уменьшают величину энергии активации, необходимой для протекания реакции ( в активированном состоянии молекулы претерпевают превращения).
Классификация ферментов
На основе химичесой природы ферменты делят на две группы:
а) полностью белковые ферменты, например, РНКазы, и б) ферменты, состоящие из двух частей: белковой (апофермента) и небелковой (кофактора). Такие ферменты, являющиеся сложными белками, называются холоферментами.
Имеются две группы кофакторов
:
1) металлы (Co, Cu, Fe, Zn, Mg). Например, каталаза имеет Fe ,алкогольдегидрогеназа имеет Zn в качестве кофакторов; и
2) коферменты – это вещества органической природы, чаще всего являющиеся производными водорастворимых витаминов.
Кофакторы, как правило, термостабильны. Их связь с апоферментом характеризуется разной степенью родства. Чаще всего кофактор может быть отделен от апофермента путем диализа. Но имеются кофакторы (коферменты), которые ковалентно, то есть прочно, связаны со своим апоферментом. Таким образом, они не отделяются путем диализа и называются простетической группой.
Другой подход к классификации ферментов основан на типе катализируемых ими химических реакций. Согласно этому подходу, все ферменты разделены на шесть классов.
1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции различных типов.
А окисленный + В восстановленный ↔ А восстановленный + В окисленный
В живых организмах окисление осуществляется главным образом путем отщепления атомов водорода от субстратов-доноров (реакция - дегидрирование, ферменты - дегидрогеназы).
2. Трансферазы – класс ферментов, ускоряющих реакции межмолекулярного переноса атомных групп от одного соединения к другому.
RX + B ↔R + BX
3. Гидролазы – класс ферментов, катализирующих реакции расщепления органических соединений при участии воды.
А-В + Н2О ↔ А-Н + В-ОН
4. Лиазы– класс ферментов, катализирующих два типа реакций:
а) расщепление негидролитическим путем углерод-углеродных связей (С – С лиазы), углерод – кислородных связей (С – О лиазы), углерод – азотных связей (С N лиазы). Например, декарбоксилазы аминокислот:
R-CH(NH2)-COOH → R-CH2-NH2 + CO2
б) присоединение атомной группы по месту двойной связи (гидратазы).
5. Изомеразы – класс ферментов, ускоряющих процессы внутримолекулярных превращений с образованием изомеров. Могут быть реакции:
а) внутримолекулярного переноса атомных групп:
3-Фосфоглицерат ↔ 2-Фосфоглицерат (фермент фосфоглицеромутаза)
б) Внутримолекулярные окислительно-восстановительные реакции:
Дигидроксиацетонфосфат ↔ 3-Фосфоглицериновый альдегид (фермент триозофосфатизомераза)
6. Лигазы (синтетазы). Они катализируют реакции синтеза с использованием энергии АТФ (чаще всего) или других нуклеозидтрифосфатов.
А + В + АТФ → С + АДФ + Фн
Названия ферментам даются как с указанием из класса, так и тривиальные.
Лактат + НАД ↔ Пируват + НАДН2
Название фермента:
Лактатдегидрогеназа (тривиальное) или L-лактат (донор): НАД (акцептор) – оксидоредуктаза
Активность ферментов
Для оценки работы ферментов используется такое понятие как активность ферментов.
В связи с введением Международной системы единиц (СИ), в которой основной единицей времени является секунда, рекомендовано ввести единицу ферментативной активности катал. Это количество катализатора (фермента), способного превращать 1 моль субстрата в продукт в течение одной секунды.
1 катал (кат) = моль/с
В клинико-биохимических исследованиях активность ферметов выражается в каталах и его долях на единицу объема 1 литр. Например, кат/л, мккат/л.
Существуют также Международные единицы активности ферментов (МЕ), введенные Международным биохимическим союзом. 1 МЕ – это количество фермента, необходимого для превращения 1 микромоля субстрата в продукт в течение одной минуты.
1 МЕ = 1 мкмоль/1 мин = (1 мкмоль/60 с) = 1/60 мккат = 16,67 нкат.
Структура ферментов
Рассмотрим, какие участки различают в ферментах.
В конце 19 века Э. Фишером было постулировано, что любая ферментативная реакция начинается с образования промежуточного фермент-субстратного комплекса – ES:
E + S ↔ ES
E - enzyme - фермент (катализатор реакции)
S - substrate - субстрат (вещество, которое образуется в результате реакции)
При этом субстрат связывается не со всей поверхностью фермента, а лишь с его определенным участком, который называется активным центром (АЦ) фермента. В свою очередь, в АЦ фермента различают: а) центр связывания (якорный, контактный) – это участок, ответственный за присоединение субстрата; и б) каталитический центр – участок, ответственный за химические превращения субстрата.
АЦ локализован в углублении (нише, щели, кармане) поверхности фермента. В результате субстрат, связываясь с АЦ, оказывается не в водной среде цитоплазмы клетки, а в специфическом окружении функциональных групп АЦ, то есть попадает в ловушку.
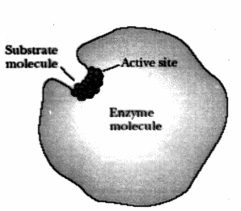
Главным условием формирования АЦ
является максимальное сближение в пространстве аминокислот, формирующих его. Это достигается благодаря третичному уровню организации пространственной структуры белка. Другими словами, аминокислоты, составляющие АЦ, на уровне первичной структуры белка могут находиться на расстоянии друг от друга, но на третичном уровне они должны быть максимально сближены.
При денатурации белков разрушаются третичная и вторичная структуры белков. Это приводит к удалению друг от друга совмещенных в пространстве аминокислотных остатков АЦ фермента, в результате чего активность фермента падает, вплоть до потери.
В пространственном сближении аминокислотных остатков большая роль принадлежит ковалентным дисульфидным связям, а также химически слабым связям таким как водородные, гидрофобные, электростатические, которые образуются между радикалами аминокислот.
Связывание субстрата с АЦ фермента происходит в нескольких точках. Это приводит к деформации субстрата и уменьшению его стабильности, то есть к активации. В результате субстрат постепенно преобразуется в продукт (Р - product), который утрачивает сродство к АЦ фермента. В итоге происходит высвобождение фермента и продукта реакции. Мы видим, что фермент, как и любой химический катализатор, не был израсходован в химической реакции. Схематически это можно представить в виде трех шагов:
1) E + S ↔ ES (образование фермент-субстратного комплекса);
2) ES ↔ ES* → EP (образование комплекса фермент-продукт в результате дестабилизации или активации субстрата);
3) EP → E + P (высвобождение фермента и продукта).
E + S ↔ ES↔ ES* → EP → E + P
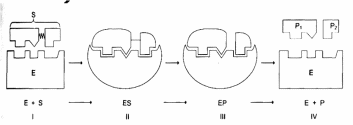
Таким образом,
-
субстрат соединяется с активным центром фермента в нескольких точках, что обеспечивает высокую избирательность и гарантию связывания (комплементарность субстрата и АЦ), а также ориентацию субстрата, необходимую для протекания реакции ;
;
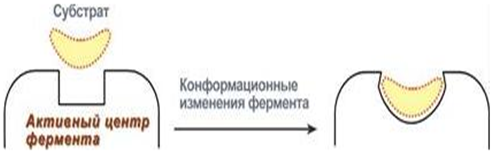

2) в ходе присоединения субстрата и в ходе катализа происходят конформационные изменения субстрата и фермента, что приводит к строгой комплементарности фермента и субстрата, или индуцированному соответствию фермента и субстрата
( Э. Фишер → Д. Кошланд).
Аллостерический центр
Некоторые ферменты, помимо активного, имеют и другой, или аллостерический (регуляторный) центр. Это участок связывания низкомолекулярных эффекторов (лигандов), которые либо повышают, либо уменьшают активность ферментов.
Такие ферменты называются аллостерическими ферментами, и, как правило, они состоят из нескольких субъединиц, или имеют четвертичную структуру, являясь олигомерами.
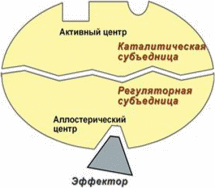
Кинетика ферментативных реакций
Основные этапы ферментативного катализа
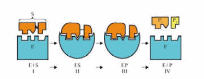
I Взаимная ориентация субстрата и фермента
II Образование фермент-субстратного комплекса (комплекса Михаэлиса)
III Образование фермент-продуктного комплекса
IV Выход продуктов из активного центра фермента
Свойства ферментов
В начале лекции были перечислены свойства ферментов как химических катализаторов, но у ферментов как у биологических катализаторов есть особые свойства, которые объясняются их белковой природой:
1) зависимость работы ферментов от температуры, рН среды, давления, то есть работа в физиологически мягких условиях;
2) очень высокая активность как катализаторов: 1 моль железа в составе каталазы (катализирует реакцию распада перекиси водорода на воду и кислород) в миллиард раз активнее, чем один моль железа как химического катализатора той же реакции;
3) высокая специфичность работы ферментов; и
4) влияние на работу ферментов эффекторов – активаторов и ингибиторов.
Термолабильность
Влияние температуры на активность ферментов
Биологические катализаторы имеют оптимальную температуру действия, которая зависит от
температуры среды, из которой выделен фермент. Например, для ферментов из организмов
теплокровных животных, в том числе человека, температурный оптимум составляет 37-38⁰ С,
для растений – 25⁰ С.
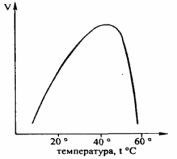
Активность химических катализаторов увеличивается с увеличением температуры среды.
Биологические же катализаторы (в большинстве), наиболее активны в районе 37⁰С, а при
нагревании до 80-100⁰С они полностью инактивируются. Происходит это потому, что при
сильном нагревании, белки (ферменты) подвергаются денатурации.