Файл: Теория по культивированию фенолразрушающих бактерий Культивирование.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 22.11.2023
Просмотров: 36
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Подготовила: Мустакимова Руфина Ришатовна
Теория по культивированию фенолразрушающих бактерий
Культивирование – создание оптимальных условий для обеспечения процессов жизнедеятельности и размножения микроорганизмов в искусственных системах.
В пищевой промышленности производные фенола обеспечивают консервирующие свойства в коптильном дыме. Некоторые из них используют в пищевой промышленности для предохранения жиров от прогорания. Многие фенолы являются антиоксидантами и защищают липиды мембран от окислительного разрушения. В составе пластмасс фенол не теряет своих летучих свойств, поэтому использование фенопластов в пищевой промышленности, производстве предметов быта категорически опасно. Таким образом, фенольные загрязнения в пищевой промышленности могут попадать в почву и в водоемы со сточными водами и ливневыми стоками.
Растения также продуцируют вещества, подавляющие или тормозящие рост фитопатогенов. Наиболее активными из них являются фенолы. В тканях растений фенолы встречаются в виде эфиров и гликозидов. Это пирокатехин, гидрохинон, пирогаллол, фенольные спирты, альдегиды и кислоты.
Стрептомицеты и близкие роды. Это гетерогенная группа, для всех таксонов которой характерны клеточные стенки, содержащие L-диаминопиколиновую кислоту и глицин. Нити мицелия не распадаются на фрагменты и могут образовывать обильный воздушный мицелий с длинными цепочками спор (роды Streptomyces и Streptoverticilium). Для других родов (Intrasporangium, Kineosporia, Sporichthya) характерно слабое развитие воздушного мицелия либо полное его отсутствие и разнообразные по форме споры.
В группу входит пять родов: Streptomyces, Streptoverticillium, Intrasporangium, Kineosporia, Sporichthya. Основное местообитание представителей этих родов – почва, но есть патогенные для человека и животных или растений виды. Типовой род – Streptomyces. Все стрептомицеты – облигатные аэробы. Они нетребовательны к питательным субстратам, не нуждаются в факторах роста, преимущественно сапрофиты. Стрептомицеты широко распространены в почвах разных типов и играют большую роль в минерализационных процессах. Их наличие обусловливает специфический запах свежевспаханной почвы. Из стрептомицетов Str. griseus было выделено масло,
названное геосмином, обладающее таким запахом. Стрептомицеты хорошо развиваются при низкой влажности почвы, поэтому в почвах засушливых климатических зон они численно преобладают над всеми микроорганизмами.
Повсеместное распространение актиномицетов рода Streptomyces связано с наличием у них активных ферментных систем, позволяющих разрушать и использовать самые разнообразные соединения. Так, у актино386 мицетов выявлена способность продуцировать такие гидролитические ферменты, как протеазы, амилазы, кератиназы, хитиназы, активные окислительно-восстановительные ферменты группы полифенолоксидаз, обес-печивающие расщепление устойчивых фенольных соединений, входящих в состав гумуса. Некоторые актиномицеты осуществляют трансформацию полициклических соединений – стероидов – в биологически активные соединения – стероидные гормоны (преднизолон, кортизон). Среди актиномицетов особенно много продуцентов антибиотиков. Например, Str. aureofaciens– продуцент тетрациклина, Str. griseus – продуцент стрептомицина, Str. venezuelae – продуцент хлорамфеникола и др. Одновременно с образованием тетрациклина бактерии вида Str. aureofaciens синтезируют также витамин В12 и его аналоги. Витамины группы В способны продуцировать почти все стрептомицеты. Многие из них образуют каротиноидные пигменты, черно-коричневые меланины и синефиолетовые антоцианы.
Средство для деструкции фенола
Изобретение относится к биотехнологии и микробиологии и может быть использовано для разложения токсичных органических соединений, а именно для разложения фенола. Средство для деструкции фенола в среде, содержащей фенол в концентрации 0,5-2,2 г/л, представляет собой штамм Rhodococcus opacus BKM Ac-2546 D, иммобилизованный на поликапроамидном волокне. Изобретение позволяет повысить деструкцию фенола. 1 ил., 1 табл.
Изобретение относится к биотехнологии и микробиологии и может быть использовано для разложения токсичных органических соединений, в частности для разложения фенола.
Фенол - одно из токсичных ароматических соединений.
Существует два принципиально различных способа очистки сточных вод от фенолов - это химический и микробиологический.
Химические методы очистки требуют наличия специального оборудования, реактивов и т.д.
Например, метод очистки сточных вод от фенола электрогидравлическим воздействием высоковольтного короткоимпульсного электрического разряда [патент RU 2326055, C02F 1/48, 8.10.2008] требует специальное оборудование, позволяющее получать электрический разряд в 25-30 кВ и включающее источник импульсов, систему охлаждения и термоизоляции. Кроме того, обеззараживание проводится в присутствии перекиси водорода, которая является сильным окислителем и опасна в концентрированном виде.
Процесс озонирования водно-фенольных сточных вод (Тенишев Ю.С. Проблема очистки сточных термальных вод от фенолов. - М.: Мингазпром, 1982. - 35 с.) требует строгого контроля за рН и вреден для персонала из-за присутствия озона.
Очистка от фенолов с помощью связывания сорбентами (см. Тенишев Ю.С. Проблема очистки сточных термальных вод от фенолов. - М.: Мингазпром, 1982. - 35 с.), требует регенерации носителя при высоких температурах (700-800°С) и биохимической доочистки воды.
Биологическая очистка сточных вод не требует сложного оборудования, ее эффективность зависит, в основном, от максимальных концентраций токсиканта, к которым устойчив штамм-деструктор и которые не приводят к ингибированию процесса биоразложения.
Известен штамм бактерий Serratia marcescens В-1248 [патент RU 2074254, C12N 1/20, 27.02.1997], осуществляющий деградацию фенола и 2,4-дихлорфенола.
Недостатком описываемого штамма является низкая концентрация фенола, который разлагается данным штаммом. Авторы приводят пример с концентрацией до 100 мг/л фенола для неиммобилизованой и 0,75 г/л для иммобилизованной культуры. Другой недостаток способа деструкции фенола с использованием известного штамма - большая длительность процесса деградации (7 сут) и иммобилизации данной культуры на носителе (17 дней).
Известен штамм бактерий Agrobacterium tumefaciens ВКПМ В-6489, осуществляющий деградацию фенола [патент RU2077575, C12N 1/20, 20.04.1997]. Он использовался для разложения фенола в концентрации 75 мг/л.
Недостаток этого штамма - также длительное предварительное культивирование перед использованием его для очистки.
Наиболее близким по техническому решению к изобретению является штамм бактерий Aureobacterium saperdae 6-204 - деструктор фенола, окисляющий в иммобилизованном состоянии на биофильтре фенол в высоких концентрациях (1,5-2,0 г/л) при более низкой температуре (15-20°С) [патент RU 2201446, C12N 1/20, 27.03.2003]. Штамм бактерий Aureobacterium saperdae 6-204 устойчив в длительном непрерывном процессе, не нуждается в дополнительных факторах роста.
Недостатком данного штамма является его неспособность осуществлять деструкцию фенола за один этап, биофильтр с использованием Aureobacterium saperdae 6-204 является многоуровневым, на каждом из пяти уровней которого происходит 10-кратная убыль фенола.
Задачей изобретения является получение штамма-деструктора фенола, способного осуществлять эффективное разложение фенола в высоких концентрациях за один этап.
Задача решается тем, что предлагается штамм бактерий Rhodococcus opacus 1G, способный к разложению фенола.
Штамм бактерий Rhodococcus opacus 1G депонирован во Всероссийской коллекции культур микроорганизмов и хранится под номером ВКМ Ас 2546 D.
Штамм Rhodococcus opacus ВКМ Ас-2546 D выделен методом накопительных культур из почв, загрязненных нефтью, в районе г.Самара.
Штамм Rhodococcus opacus ВКМ Ac-2546 D обладает следующими свойствами.
Культурально-морфологические свойства штамма: неподвижный актиномицет, грамположительный, аэробный, основные сахара в составе клеточной стенки - арабиноза и галактоза. На богатой среде образует колонии светло-розового цвета. На минеральной агаризованной среде с фенолом в качестве единственного источника углерода и энергии образует мелкие, практически бесцветные колонии.
Физиолого-биохимические свойства штамма: аэроб, температурный оптимум +30°С до +37°С, оптимум рН нейтральный или слегка щелочной: 7-8, каталазоположительный, не требует для роста тиамина, хорошо растет на стандартных лабораторных средах. На минеральной среде в качестве ростовых субстратов использует маннозу, D-галактозу, L-рамнозу, сахарозу, мальтозу, лактозу, бензоат, п-гидроксибензоат, п-толуилат, п-крезол, фталат, терефталат, дизельное топливо, ацетат, бутират, этанол, цитрат, изопропанол, ацетамид, анисовую и феруловую кислоты. Не растет на минеральных средах с L-рамнозой, D-целлобиозой, L-серином, L-аланином, L-аспаргином, нафталином, монохлорфенолами, 2,4-ди-, 2,3,5- и 2,4,5-трихлорфенолами.
Штамм бактерий Rhodococcus opacus ВКМ Ac-2546 D отличается от известных штаммов-бактерий, являющихся деструкторами фенола.
При хранении на агаризованной среде с фенолом в качестве единственного источника углерода и энергии штамм длительное время сохраняет жизнеспособность. Способность разлагать фенол не исчезает при пересевах на неселективных средах.
В неиммобилизованном состоянии он способен разлагать фенол в концентрациях, равных 0.75 г/л.
Штамм легко иммобилизируется на носителях различного типа. Иммобилизация клеток приводит к увеличению концентраций фенола, разлагаемых данным штаммом, до 2.2 г/л.
Деградация фенола проходит с образованием пирокатехина и его последующим орто-расщеплением. Установлено, что ключевой фермент этого пути - пирокатехин 1,2-диоксигеназа - характеризуется высокой избирательностью к субстрату - пирокатехину. Афинность к фенолу и замещенным фенолам и бензоатам у этого фермента низкая, что указывает на перспективность использования штамма Rhodococcus opacus ВКМ Ac-2546D для очистки стоков от фенольных загрязнений.
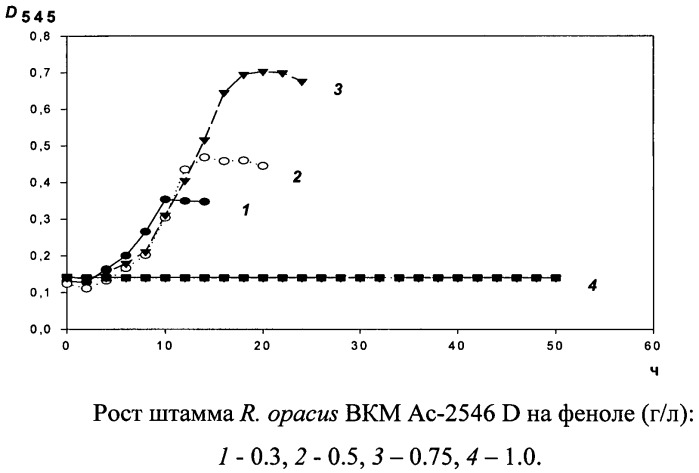
Штамм бактерий Rhodococcus opacus ВКМ Ас-2546D способен к росту на феноле. На чертеже показан рост штамма Rhodococcus opacus ВКМ Ас-2546 D на феноле (г/л): 1-0.3, 2-0.5, 3-0,75, 4-1,0.
Из данных, представленных на чертеже, понятно, что при росте штамма штамма Rhodococcus opacus ВКМ Ac-2546 D на феноле продолжительность лаг-фазы составляет около 6 ч. При концентрации фенола 0.3 г/л фенол полностью исчезает менее чем за 12 часов, максимальная величина оптической плотности D545 равняется 0.35 о.е. Это говорит о способности штамма Rhodococcus opacus ВКМ Ac-2546 D эффективно разлагать умеренно-высокие концентрации токсиканта за короткий период времени. Оптическую плотность растворов определяли на спектрофотометре Shimadzu UV-160 (Япония).
При концентрации субстрата 0.5 г/л культура достигает максимальной величины D545 0.5 за 14 часов. Удельная скорость роста (µ) равняется 0.05. Время удвоения (td) - 1.4 ч. За 14 ч инкубации культура использует практически весь субстрат. Дополнительное внесение субстрата в тех же количествах через 6-8 ч голодания сопровождается дальнейшим ростом культуры без какой-либо задержки.
При концентрации фенола 0.75 г/л максимальное значения D545 достигается за 20 ч и равняется 0.7 о.е.
Рост при более высоких концентрациях фенола отсутствует.
Тем не менее, дробное внесение фенола (по 0.25-0.5 г/л) приводит к росту культуры до D545 0.8-1.0 о.е., суммарное потребление субстрата увеличивается до 2 г/л.
Штамм бактерий Rhodococcus opacus ВКМ Ac-2546 D разлагает фенол как в виде нативных, так и в виде иммобилизованных клеток.
Штамм бактерий Rhodococcus opacus ВКМ Ac-2546 D может быть иммобилизован на поликапроамидном волокне или на вспененном вермикулите.
В таблице показано влияние типа носителя на биодеградативную способность штамма бактерий Rhodococcus opacus ВКМ Ac-2546 D.
Из данных таблицы можно сделать вывод о том, что поликапроамидное волокно является лучшим носителем для иммобилизации данного штамма