ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 22.11.2023
Просмотров: 127
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
следующим образом:
{mAgI,nI-,zAl3+[3(z-x)-n)] }3x
}3x
Влияние неиндифферентного электролита
Неиндифферентным называется электролит, содержащий ионы, способные достраивать кристаллическую решетку. Например, при введении в золь
{mAgI, nAg+(n-x) }х
}х небольшого количества KI наблюдается увеличи-вается ионная сила раствора, приводящее к повышению z-потенциала. Избыточное количество KI будет реагировать с AgNO3 и образовывать дополнительное коли-чество дисперсных частиц AgI. На их поверхности уже будут адсорбироваться иодид-ионы и обуславливать отрицательный заряд поверхности. Потенциалоп-ределяющими ионами уже будут иодид-ионы, а противоионами – ионы К+: {mAgI, nI- (n-x) K+}х K+.В этом случае перезарядки изменяется знак не только дзета-потенциала, но и электротермо-динамического (j-) потенциала.
небольшого количества KI наблюдается увеличи-вается ионная сила раствора, приводящее к повышению z-потенциала. Избыточное количество KI будет реагировать с AgNO3 и образовывать дополнительное коли-чество дисперсных частиц AgI. На их поверхности уже будут адсорбироваться иодид-ионы и обуславливать отрицательный заряд поверхности. Потенциалоп-ределяющими ионами уже будут иодид-ионы, а противоионами – ионы К+: {mAgI, nI- (n-x) K+}х K+.В этом случае перезарядки изменяется знак не только дзета-потенциала, но и электротермо-динамического (j-) потенциала.
Коагуляция золей смесями электролитов (совместная коагуляция)
Коагуляция осложняется при применении смеси электролитов. При этом воз-можны 3 варианта действия электролитов. Аддитивность – суммарное коагули-рующее действие электролитов. Имеет место при отсутствии взаимодействия меж-ду ионами разных электролитов, т.е. когда электролиты содержат противоионы одинаковой валентности. Если один электролит присутствует в количестве 70% от его порога коагуляции, то для вызова коагуляции необходимо взять второй элек-тролит в количестве 30% от его порога коагуляции.
следующим образом:
{mAgI,nI-,zAl3+[3(z-x)-n)]
Влияние неиндифферентного электролита
Неиндифферентным называется электролит, содержащий ионы, способные достраивать кристаллическую решетку. Например, при введении в золь
{mAgI, nAg+(n-x)
Коагуляция золей смесями электролитов (совместная коагуляция)
Коагуляция осложняется при применении смеси электролитов. При этом воз-можны 3 варианта действия электролитов. Аддитивность – суммарное коагули-рующее действие электролитов. Имеет место при отсутствии взаимодействия меж-ду ионами разных электролитов, т.е. когда электролиты содержат противоионы одинаковой валентности. Если один электролит присутствует в количестве 70% от его порога коагуляции, то для вызова коагуляции необходимо взять второй элек-тролит в количестве 30% от его порога коагуляции.
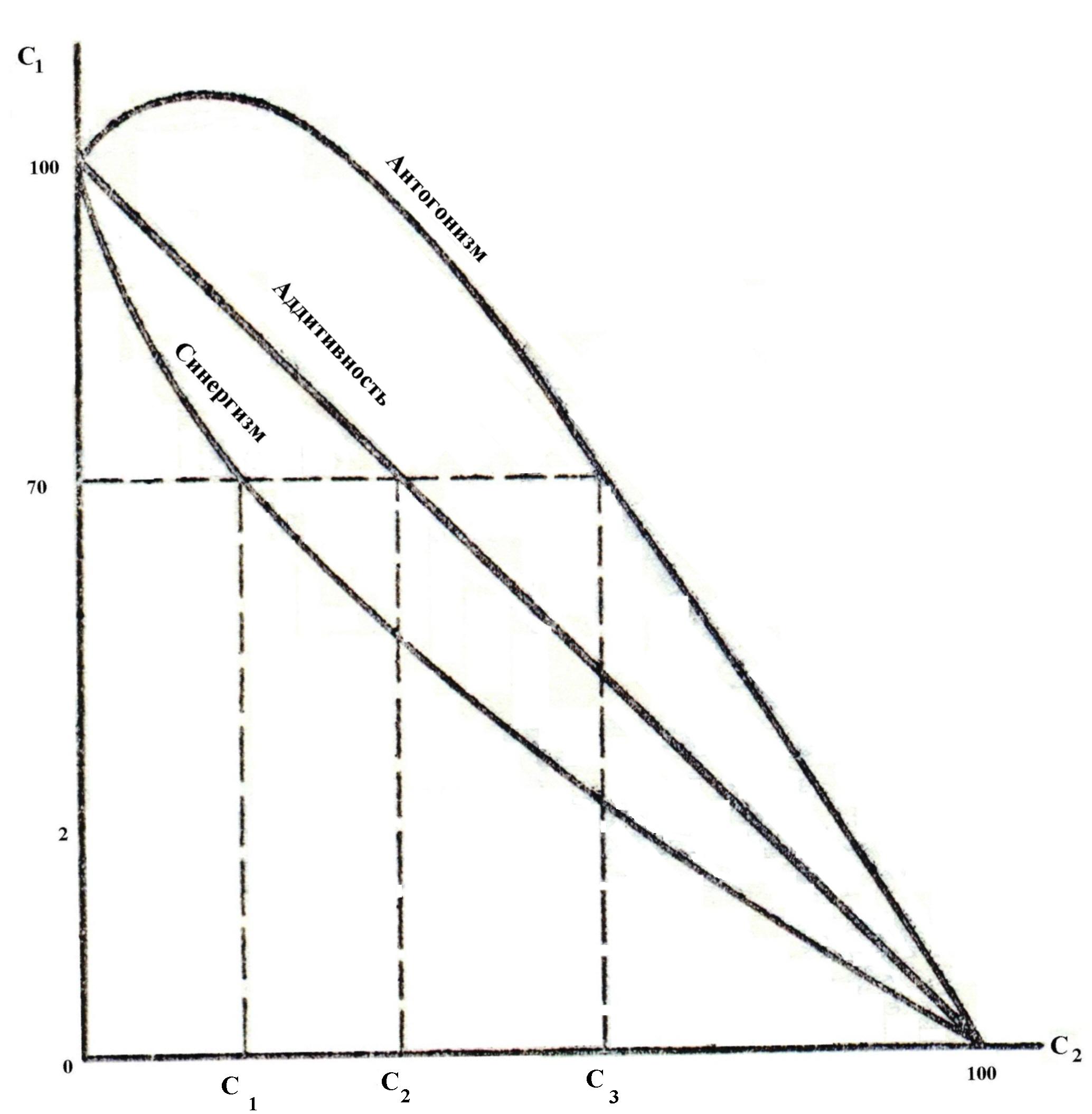 | Синергизм – явление взаимного усиления коагули-рующего действия электролитов. Обусловлено химическим взаимодействием ионов смеси с образованием ионов с большим зарядом, чем исходные ионы. В связи с этим, согласно правила Шульца-Гарди, новообразованные ионы обладают большей коагулирующей способностью. Поэтому, чтобы вызвать коагуляцию, второй электролит должен быть взят в количестве, меньше 30% от его порога коагуляции. |
Антогонизм ( пептизация) – явление взаимного ослабления коагулирующей способности электролитов. Обусловлено образованием новых ионов, обладающих меньшим зарядом по сравнению с зарядом исходных ионов. Поэтому, чтобы вызвать коагуляцию, их суммарная концентрация должна быть больше 100%.
Взаимная коагуляция золей
Взаимная коагуляция наблюдается при смешении золей с разноименно заряженными частицами. Разноименно заряженные частицы притягиваются друг к другу с образованием агрегатов вследствие исчезновения электростатического отталкивания, т.е взаимной нейтрализации зарядов. Наиболее полно она наблюдается тогда, когда заряды частиц приблизительно равны.
Взаимная коагуляция имеет место в жидкостях организма, используется при выделении каучука из латекса, при очистке промышленных вод, крашении тканей и волокон, в водоподготовке.
Например, природные воды содержат большое количество примесей коллоидных веществ (песок, глина и др.), имеющих отрицательный заряд:
{ m xAl2O3.ySiO2.zMe2O.nSiO44−(n−q)Men+}q−.qMen+
Для их нейтрализации вводят коагулянты (сульфаты алюминия, железа, аммонийные квасцы). В воде эти соли гидролизуются и образуют коллоидные частицы с положительным зарядом:
Fe2(SO4)3 + H2O → Fe(OH)3 + H2SO4
{mFe(OH)3. nFe3+3(n−x)HSO4−]x+.xHSO4−
Эти гранулы взаимно нейтрализуются с отрицательно заряженными частицами и выпадают в осадок, которого отфильтровывают и таким образом получают очищенную (осветленную) воду.
Кинетика коагуляции
Теория кинетики коагуляции разработана Смолуховским. Кинетика коагу-ляции выражается скоростью коагуляции, т.е. изменением численной концентра-ции частиц в единицу времени. В зависимости от концентрации коагулирующего электролита ход коагуляции подразделяют на скрытую и явную.
При небольшой концентрации электролита коагуляция незаметна на глаз и называется скрытой коагуляцией. При этом заряд коллоидных частиц большой и поэтому только некоторые частицы (имеющие максимальную скорость движения) могут преодолеть силы электростатического отталкивания. По мере увеличения концентрации электролита заряд частиц постепенно нейтрализуется, дзета-потен-циал уменьшается и достигает критического значения. В этой точке коагуляция становится заметной на глаз и такая коагуляция называется явной.
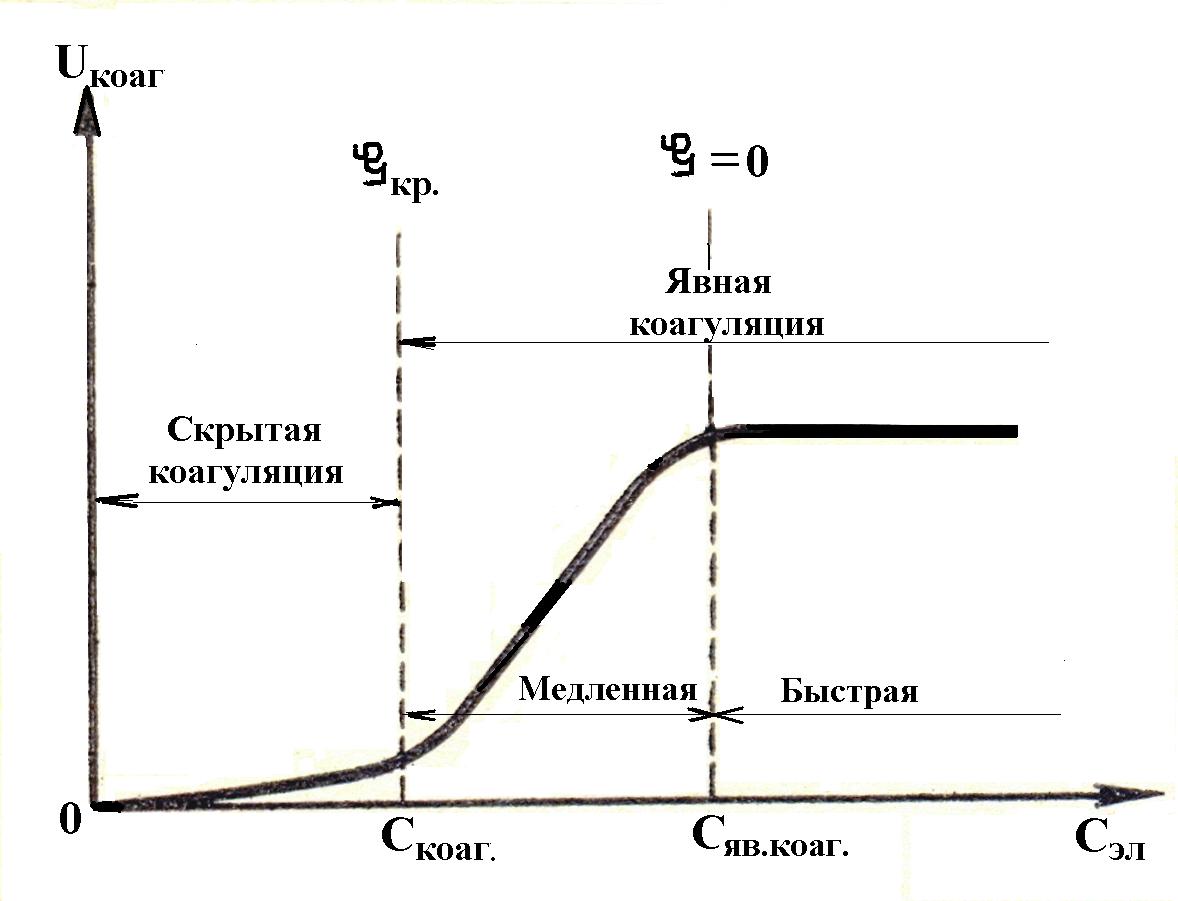 Рис. Кинетика коагуляции | Явная коагуляция подразделяется на медлен-ную и быструю. При концентрации электро-лита, чуть больше порога коагуляции, дзета-потенциал частиц становится меньше крити-ческого, но еще не равен нулю. Поэтому не каждое столкновение ведет к слипанию частиц и их оседанию. Вследствие этого явная коагу-ляция протекает медленно. По мере увеличе-ния концентрации электролита скорость коагуляции увеличивается, частицы нейтрали- |
зуются и заряд становится равным нулю. При этом ничто не мешает коагуляции: каждое столкновение ведет к объединению частиц. Практически все частицы коагулируют одновременно. Поэтому явная коагуляция протекает быстро. Скорость коагуляции уже не зависит от дальнейшего увеличения концентрации электролита. Минимальная концентрация электролита, которая вызывает быструю явную коагуляцию, называют критическим порогом быстрой коагуляции.
Порядок изменения частиц при коагуляции
Смолуховским был исследован порядок изменения (последовательность укрупнения) или агрегации частиц при коагуляции. Первичные (одиночные) час-
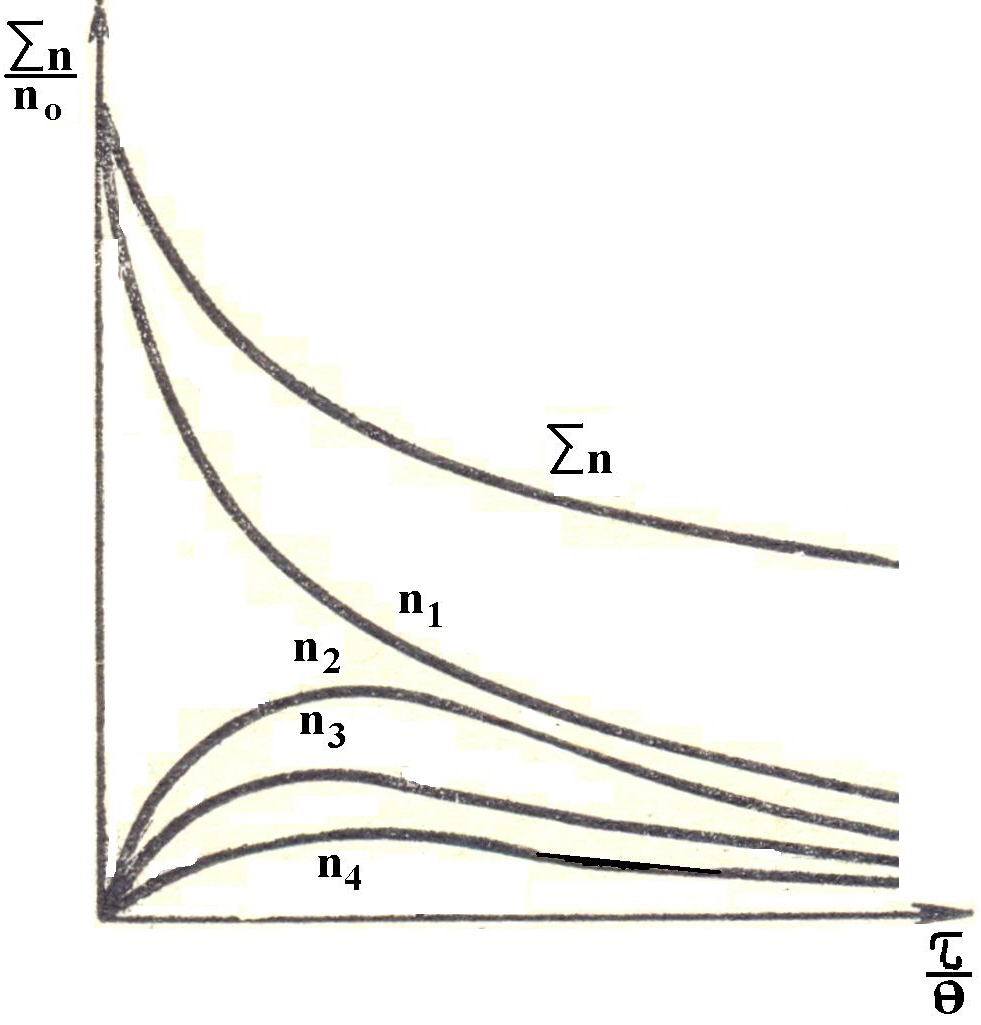 других системах наблюдается | тицы сталкиваясь, образуют двойные частицы, которые в свою очередь, соприкасаясь друг с другом и одиночными частицами, образуют тройные и четверные частицы и т.др. При этом число одиночных частиц уменьшается, а число частиц каждого следующего порядка сначала увеличивается, а затем уменьшается до нуля вследствие образования более крупных агрега-тов. В результате образуются крупные, рыхлые агрегаты, состоящие из множества мелких час-тиц разного порядка (размера). Данная теория разработана для монодисперсной системы. В отклонение от такого поведения. |
Лекция № 6
тема: Устойчивость и коагуляция коллоидных систем
Виды устойчивости гидрофобных золей. Под устойчивостью дисперсной системы понимают сохранение дисперсности, равномерного распределения частиц в дисперсионной среде. Как известно, лиофобные коллоиды ввиду высокой поверхностной энергии, большего поверхностного натяжения и поверхностной активности термодинамически неустойчивы, т.е. для них характерно явление «коагуляции».
Коагуляция ( с лат. «свертывание, затвердевании») представляет собой слипание частиц ДФ и их оседание, т.е. это потеря агрегативной устойчивости системы.
В 1920 г. Н.П.Песков ввёл понятие об агрегативной и седиментационной (кинетической) устойчивости.
Кинетическая устойчивость позволяет системе сохранять равномерное распределение частиц в объеме, т.е. противостоять действию силы тяжести и процессам оседания или всплытия частиц. Основным условием (количественной мерой) этой устойчивости является дисперсность вещества и наличие броуновского движения.
Агрегативная устойчивость – это способность системы противостоять агрегации частиц ДФ. Различают электростатический, адсорбционно-сольватный, гидродинамический и другие факторы агрегативной устойчивости дисперсных систем.
Электростатический фактор обусловлен электростатическими силами отталкивания вследствие наличия двойного электрического слоя. Одноименно заряженные частицы отталкиваются друг от друга, что мешает слипанию и укрупнению частиц. Чем толще диффузный слой (больше дзета-потенциал), тем сильнее взаимоотталкивание частиц.
Адсорбционно-сольватный фактор связан с наличием сольватной оболочки: частицы всегда имеют сольватную (гидратную) оболочку. Эта упругая оболочка препятствует сближению с другими частицами и играет роль амортизатора (буфера).
Гидродинамические факторы снижают скорость агрегации частиц вследствие изменения вязкости среды, плотности ДФ и дисперсионной среды.
В реальных лиофобных системах агрегативная устойчивость в основном определяется электростатическим и адсорбционно-сольватными факторами. Поэтому количественной мерой агрегативной устойчивости является величина дзета-потенциала.
Факторы, вызывающие коагуляцию. Поскольку лиофобные системы обладают избыточной поверхностной энергией, они агрегативно неустойчивы. Процесс укрупнения частиц происходит самопроизвольно, т.к. это приводит к уменьшению удельной поверхности и снижению поверхностной энергии Гиббса.
Коагуляцию вызывают следующими факторами:
− механическим воздействием (встряхивание, перемешивание раствора, увеличение концентрации);
− изменением температуры (повышение температуры приводит к коагуляции лиофильных золей, а понижение – лиофобных золей);
− добавление электролита;
− удалением стабилизирующего электролита (в ходе диализа путём ионного обмена или связывания его ионов в малодиссоциирующее соединение);
− пропусканием электрического тока (электрофорез или электроосмос);
− добавлением другого коллоидного раствора с другими противоионами (нейтрализация).
Наиболее важным фактором является добавление электролита, при котором наблюдается резкое изменение ДЭС и дзета-потенциала.
Правила коагуляции электролитами
Коагуляция наблюдается при добавлении некоторого количества любого электролита, химически не реагирующего с дисперсной фазой системы. Наблюдениями Г.Шульце было установлено, что коагуляцию вызывает один из ионов электролита. Этот ион называют ионом-коагулятором. Причём, коагулирующая способность иона возрастает с увеличением заряда иона в геометрической прогрессии при соотношении 1:100:1000 (правило значности или правило Шульце). Ландау, Дерягиным установлено, что коагулирующая способность изменяется в соответствии 6-ой степени заряда ионов: 16:26:36 = 1:64:729.
Позже М.Гарди выявил, что заряд коагулирующего иона всегда противоположен заряду гранулы мицеллы (правило Гарди). Следовательно, отрицательная гранула коагулирует под влиянием положительно заряженных ионов, а положительно заряженная гранула – под действием анионов добавляемого электролита.
Закономерности, найденные Шульце и Гарди объединены в одно правило (правило Шульце-Гарди): коагулирующим действием обладает тот ион электролита, заряд которого противоположен заряду гранулы и коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора.
Для характеристики и сравнения различных электролитов используется понятие «порог коагуляции» − это минимальная концентрация добавляемого электролита, при которой начинается (наблюдается) коагуляция:
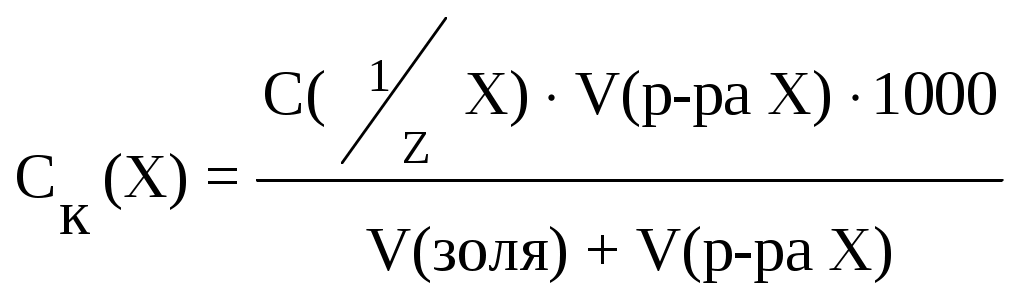 , моль/л.
, моль/л.Порог коагуляции зависит от ряда условий: от момента фиксирования после добавления электролита; от метода наблюдения; от концентрации исследуемого раствора и добавляемого электролита. Порог коагуляции определяют путем измерения светорассеяния или титрованием коллоидного раствора электролитом до начала явной коагуляции.
Величина, обратная порогу коагуляции называют коагулирующей способностью: