Файл: Аналитическая химия фотометрический метод определения меди в растворе.docx
Добавлен: 23.11.2023
Просмотров: 92
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Уфимский государственный нефтяной технический университет»
Институт нефтепереработки и нефтехимии ФГБОУ ВО УГНТУ в г. Салавате
Кафедра «Химико-технологические процессы»
Аналитическая химия
«ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ В РАСТВОРЕ»
Отчёт по лабораторной работе №1
ХТП-18.03.01-02.01.00
Выполнил:
студенты гр. БТП-21-21 А. А. Акулова
Д. А. Ильина
Проверил:
канд. техн. наук, доцент Ф. Р. Опарина
Салават
2023
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
-
Взаимодействие вещества с электромагнитным излучением
Это взаимодействие сопровождается явлениями, из которых наиболее важны испускание, поглощение и рассеяние излучения. Возникающие сигналы несут качественную и количественную информацию о веществе. Качественную информацию несет частота сигнала (интенсивное свойство), связанная с природой вещества, количественную – интенсивность сигнала (экстенсивное свойство), зависящая от его количества. Совокупность всех частот (длин волн) электромагнитного излучения называют электромагнитным спектром. Интервал длин волн от 10-10 до 10-1 м разбивают на области (рисунок 1.1.1): ультрафиолетовая (УФ) область – 10 – 380 нм; видимый спектр – 380 – 750 нм; инфракрасная область – 750 - 105 нм.
| Ультрафиолетовая Область  Электронное возбуждение | Видимая область Электронное возбуждение | Инфракрасная область   Молекулярные колебания |
10 380 750 10
5
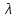 ,нм
,нм Рис. 1 - Электромагнитный спектр излучения
Происхождение атомных спектров
В отсутствие внешних воздействий атом находится в основном состоянии, т.е. обладает наименьшей энергией Е0.


Е3
Е2
Е1
Е0








Рис. 2 - Энергетические переходы в атоме
При получении энергии извне атом возбуждается:
Атом
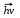 Атом
Атом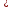 .
.Электроны при этом могут переходить на другие энергетические уровни (рисунок 1.1.2). Поскольку энергетические уровни строго квантованы, то вещество поглощает электромагнитное излучение избирательно, т.е. те кванты света, которые соответствуют разности энергии между энергетическими уровнями:
hν = ΔЕ.
Частота поглощаемого излучения определяется разностью энергии между электронными орбиталями.
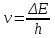 ,
,где h – постоянная Планка.
Вещество состоит из множества одинаковых атомов, способных переходить на разные энергетические уровни. Совокупность всех фотонов одной и той же частоты составляет
спектральную линию, совокупность всех линий называют спектром вещества. Спектр поглощения (абсорбции) получают, помещая исследуемое вещество в поле электромагнитного излучения (например, на пути светового потока).
Для получения спектра испускания (эмиссионный спектр) атомы вещества предварительно переводят в возбужденное состояние, что достигается подведением какого-либо вида энергии, после возбуждения атомы через 10-9 – 10-7 с возвращаются в основное состояние, испуская фотоны либо теплоту. В последнем случае переход будет безизлучательным.
Происхождение молекулярных спектров
Молекулы состоят из двух и более атомов, соединенных между собой в определенном порядке химическими связями, образующимися при взаимодействии внешних электронов. Энергетическое строение молекулы сложнее, чем у атома. Наряду с движением электронов происходит колебательное движение самих атомов, вернее их ядер, и вращение молекулы как целого. Поэтому в любом состоянии энергия молекулы складывается из электронной, колебательной и вращательной энергии:
Е = Еэл + Екол + Евр.
Наибольший вклад в полную энергию вносит энергия электронов, наименьшей – энергия вращения молекулы:
Еэл >> Екол >> Евр.
Так же как и атом, молекула может существовать только в определенных энергетических состояниях, называемых энергетическими уровнями (орбиталями). Каждому электронному состоянию отвечают колебательные уровни, а каждому колебательному уровню – вращательные. Любой уровень, помимо главного, побочного, магнитного и спино спинового, характеризуется колебательными и вращательными квантовыми числами.
В спектроскопии чаще всего используют возбуждение молекулы под действием электромагнитного излучения. При этом молекула поглощает фотоны с энергией, равной разности энергии её орбиталей. Совокупность всех поглощенных частот составляет поглощение молекулы (молекулярный абсорбционный спектр). Возбуждение молекул другими видами энергии, например, в плазме не применяют, так как большинство веществ в этих условиях разлагается. Число энергетических состояний молекул велико и энергии отдельных переходов бывают настолько близки, что различить их невозможно. Поэтому в молекулярных спектрах спектральные линии с близкими частотами сливаются в одну
полосу поглощения.
Возвращение молекулы из возбужденного состояния в основное протекает сложнее, чем у атома. Возможны два пути: 1) безизлучательный переход с выделением теплоты при столкновении молекул с другими частицами; 2) часть энергии выделяется в форме теплоты, другая часть излучается в виде фотона (вторичное излучение).
-
Оптические спектроскопические методы анализа
По происхождению аналитического сигнала выделяют следующие основные оптические спектроскопические методы.
Атомно–абсорбционная спектроскопия основана на поглощении атомами излучения от внешнего источника.
Атомно-эмиссионная спектроскопия основана на испускании излучения атомами, возбужденными кинетической энергией плазмы, дугового или искрового разряда и т. п. Испускаемый свет разлагается диспергирующим элементом в спектр. Каждый атом имеет свой характерный спектр, анализ которого позволяет определить вид атома и его содержание в пробе.
Абсорбционная молекулярная спектроскопия, основанная на энергетических переходах валентных электронов и поглощении молекулами видимого и УФ – излучения, называется спектрофотомерией.
Абсорбционная молекулярная спектроскопия, основанная на колебательных переходах и поглощений ИК-излучения, называется инфракрасной спектроскопией.
Люминесцентная спектроскопия основана на электронных переходах при возвращении из возбужденного состояния в основное и сопровождающегося вторичным излучением света. Если для возбуждения используется УФ или видимый свет, то метод анализа называется фотолюминесценцией.
Наибольшее распространение нашел метод спектрофотомерии.
-
Основанные количественные соотношения
В результате поглощения свет раствором происходит уменьшение интенсивности светового потока.

раствор
Jо J


Рис. 3 - Схема фотометрического анализа
Количество электромагнитного излучения, поглощенного раствором, пропорционально концентрации поглощающих частиц и толщине слоя раствора.
Этот закон называются законом Бугера – Ламберта – Бера и выражается уравнением:
J = Jо∙ 10 -εℓc (1.3.1)
где Jо и J – интенсивности потоков света, направленного на раствор и прошедшего через него; С – концентрация вещества, моль/л; ℓ - толщина светопоглощающего слоя, см; ε – молярный коэффициент поглощения.
Обозначим:
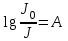 , (1.3.2)
, (1.3.2)где А – оптическая плотность (абсорбционность) раствора часто используют величину, называемую пропусканием Т :
 (1.3.3).
(1.3.3).Из уравнений (1.3.1) и (1.3.2) получается выражение
А =ε∙ℓ∙c . (1.3.4)
Оптическая плотность (абсорбционность) прямо пропорциональна концентрации раствора и толщина слоя. Если ℓ = const (используется одна кювета), то градуировочный график имеет вид прямой.
А

А4
А3
А2
А1

 С
СС1 С2 С3 С4
Рис. 4 - Градуировочный график
Оптическая плотность – экстенсивное свойство. Поэтому оптическая плотность смеси вещества равна сумме оптических плотностей каждого из них:
А = ε1∙С1∙ℓ + ε 2∙С2∙ℓ + …εm∙Сm∙ℓ (1.3.5)
Закон аддитивности (суммирование) широко используется в аналитической химии.
1.4 Молярный коэффициент поглощения
Если С = 1 моль/л, ℓ = 1 см, то А = ε, то есть молярный коэффициент светопоглощения, представляет собой оптическую плотность 1 М раствора, помещенного в кювету с толщиной слоя 1 см. Величина молярного коэффициента светопоглощения ε зависит от длины света проходящего света, температуры раствора и природы растворенного вещества и не зависит от толщины поглощающего слоя и концентрации раствора.
Молярный коэффициент светопоглощения отражает индивидуальные свойства соединений и является их определяющей характеристикой. Многие органические соединения имеют высокий молярный коэффициент в УФ – области, так для пиридина ε = 80000 (при λ = 174 нм), для нафталина ε = 112000 (при λ = 220 нм). Многие неорганические вещества имеют низкий коэффициент поглощения (ε < 100), поэтому их переводят в интенсивно окрашенные соединения. Так, для соединения цинка с дитизоном молярный коэффициент достигает значения ε = 94000.