Файл: Химия нефти и газа л. 78 Методы разделения и концентрирования компонентов нефти.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 56
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
, а он становится сильно электроположительным. Если молекула, имеющая такие атомы водорода, сближается с молекулой, имеющей атом с неподеленной электронной парой, то между ними устанавливается водородная связь.
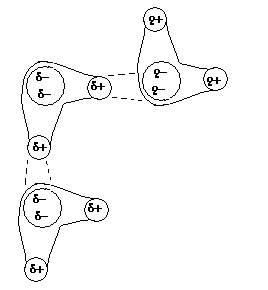
Водородные связи способны образовывать молекулы воды, органических кислот, спиртов, аминов. Из адсорбентов водородные связи могут образовывать кремнеземы (силикагель, диатомиты, пористые стекла).
Специфические взаимодействия могут происходить между полярными и неполярными молекулами. Главное, чтобы имелись подвижные электронные пары и свободные электронные орбитали. Например ароматические углеводороды способны специфически взаимодействовать с адсорбентами, имеющими на поверхности локализованные электрические заряды.
Статические сорбционные процессы сравнительно слабо применяются в исследовании нефтей. Но можно решить ряд сложных задач разделения и концентрирования некоторых групп веществ.
Например на сорбентах неоднородной пористости можно сконцентрировать полярные вещества нефти – арены и гетероатомные компоненты. К таким адсорбентам относятся оксиды кремния SiO2, а также оксиды щелочных и щелочноземельных элементов (наиболее широко используются Al2O3 , Fe2O3 или их смеси). Главное их свойство - поверхность у них имеет заряд, адсорбция идет по принципу ориентационного взаимодействия. Фильтрация молекул через такие сорбенты не идет, то есть они неоднородной пористости (встречаются поры мелкие и крупные), главное, чтобы была достаточно развита поверхность адсорбции. И нужная полярность, которую регулируют добавляя к адсорбенту воду.
Силикагели – гель кремниевой кислоты. Это основной сорбент для жидкостно-адсорбционной хроматографии и лучший для разделения смесей нефтяных углеводородов и нефтяных смолистых веществ. Выпускаются крупнопористые и мелкопористые силикагели различных марок АСКГ, КСМГ, КСКГ (2,8-7,0 мм), МСМК (0,25-2,0 мм) . Для колоночной хроматографии нефтей подходят силикагели с размером частиц 100-250 мкм.
На поверхности силикагелей имеются силанольные и силоксановые группы, и три слоя сорбированной воды за счет которых и обеспечивается его разнообразная адсорбционная активность.
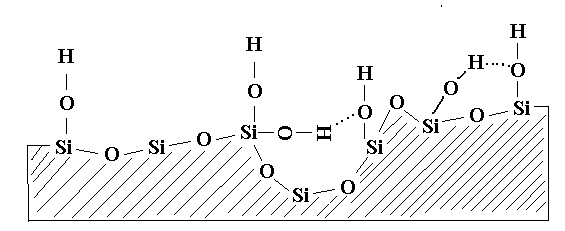
Состояние водных слоев на поверхности силикагеля:
Верхний слой слабо сорбированной воды
, удаляется при 18-700С сухим растворителем.
Средний слой слабо сорбированной воды, удаляется при 100-1200С сухим растворителем.
Нижний слой сильно сорбированной воды, удаляется прокаливанием при 200-6500С.
Контролируя количество воды на поверхности сорбента можно контролировать его адсорбционную активность.
Оксид алюминия. Тоже часто применяемый адсорбент для разделения нефтяных веществ. Причем хорошо разделяет как полярные молекулы, так и неполярные. Это свойство оксида алюминия объясняется его амфотерным характером. Так жк как у силикагелей активность оксида алюминия зависит от его влагосодержания. Наиболее активная форма – безводная, увлажняя разнам количеством воды можно получить набор адсорбентов с разной емкостью. Для разделения нефтей подходит дезактивированная 10% воды.
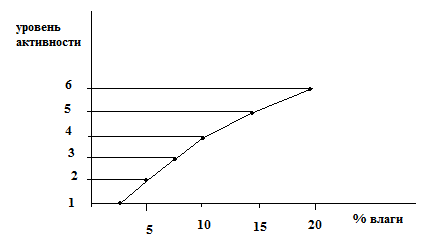
В зависимости от содержания воды различают 6 степеней активности оксида алюминия:
Неполярные вещества нефти – алканы, циклоалканы, изоалканы – разделяют с помощью неполярных сорбентов, например, активированных углей.
Активированные угли – это неполярные сорбенты. Удельная поверхность составляет 1000-1700 м2/г, поэтому силы взаимодействия углей с молекулами разделяемых веществ очень велики. Область их применения ограничивается разделением газов.
Есть и селективные адсорбенты с помощью которых можно выделить из нефти молекулы строго определенного размера – это цеолиты.
Молекулярные сита. К молекулярным ситам относят обычно цеолиты – пористые кристаллы природных или синтетических алюмосиликатов кальция, натрия и некоторых др. металлов. Поры их кристалов имеют размеры, близкие к размерам молекул жидких или газообразных веществ. Те вещества, которые могут проникнуть в поры цеолитов, сорбируются в кристаллах цеолитов, более крупные молекулы не сорбируются. Так как цеолиты выпускаются с разным размером пор, есть возможность очень четкого разделения разных веществ.
Особенностью молекулярных сит, отличающей их от других типов сорбентов, является строгая однородность структуры и размеров пор.
Механизм прохождения молекул через окна пор цеолитов сложный много фазный процесс. Здесь одновременно проявляются силы притяжения и отталкивания молекул
, значительно влияет строение молекул. Так молекулярные сита с расмером «окон» около 5 А хорошо сорбируют парафиновые УВ нормального строения, а разветвленные молекулы не сорбируются.
Недостатком цеолитов как адсорбентов является их высокая влагоемкость и способность взаимодействовать с кислотами с потерей адсорбционной способности. Некоторые вещества сорбируются в порах безвозвратно. Поэтому область их применения ограничена.
Также известны эти методы как методы удаления нефтяных компонентов из природных смесей веществ. Например, при техногенном нефтяном загрязнении экосистем метод статической адсорбции углеводородов может быть применен для связывания, изолирования и удаления нефтяного загрязнения.
Экстракция
Экстракция – это частный случай абсорбции.
При соприкосновении водного раствора вещества А с каким-либо неводным растворителем, не смешивающимся или ограниченно смешивающимся с водой, растворенное вещество А будет распределяться между обоими растворителями и через некоторое время в такой системе установится равновесие
АВ ↔ АО, где вещество А в воде и органическом растворителе, соответственно.
Процесс переноса растворенного вещества из одной жидкой фазы в другую, с ней не смешивающуюся или ограниченно смешивающуюся, называют жидко-жидкостным распределением.
В общей форме, когда перераспределяется вещество не только между жидкостями, но и твердыми фазами, между твердой и жидкой фазой, жидкой и газовой или твердой и газовой – процесс называют экстракцией.
Экстракция - процесс избирательного извлечения одного или нескольких компонентов из их раствора или смеси жидких или твердых веществ с помощью растворителя (экстрагента), не смешивающегося с указанной выше жидкой или твердой фазой.
Причиной экстракции является различная растворимость веществ в двух взаимно несмешивающихся жидкостях. При соприкосновении двух взаимно нерастворимых жидкостей экстрагируемое вещество распределяется между ними, концентрируясь преимущественно в одной из них.
То есть используется свойство вещества лучше растворяться в одном растворителе, чем в другом.
Экстрагент – растворитель, в который избирательно переходит извлекаемое вещество.
Экстракция складывается из следующих простых операций:
1. Приведение исходной смеси веществ в контакт с экстрагентом
2. механического разделения образовавшихся фаз
3. Удаление и регенерация экстрагента из каждой фазы.
В случае разделения нефти:
Экстрагетом может выступать вода, если мы извлекаем водорастворимые соли из нефти, или органический растворитель. Например, сернистые и ароматические вещества экстрагируются из нефти диметилфорамидом.
Количественной характеристикой экстракции являются степень разделения
(или степень извлечения).
В простейшем случае, когда одно индивидуальное вещество распределяется между двумя несмешивающимися жидкостями (при постоянных Т и Р и химическая форма его не меняется), система подчиняется закону распределения, который выражается формулой:
Кр = а2/а1,
где Кр – коэффициент распределения вещества; а2 и а1 – активности вещества в растворителях. Активность – это сборное понятие, которое включает в себя и парциальное давление вещества и ионную силу и растворимость и др. Иногда ее можно заменить более понятной величиной – концентрацией (когда растворы идеальные и вещество не диссоциирует на ионы, молекулы не взаимодействуют друг с другом):
Кр = С2/С1,
тогда становится понятным, что эта величина характеризует избирательность растворителя к компоненту. Чем выше Кр, тем лучше вещество растворяется во втором растворителе, чем в первом.
Процент экстракции (степень извлечения в %) рассчитывается по формуле:
Е% = 100/(1 + (V1/KpV2)) , где V1 и V2 – объемы первичного раствора и раствора-экстрагента.
Требования к экстрагентам:
В лабораторных условиях процесс ЖЖ-экстракции обычно проводят в делительной воронке.

Водородные связи способны образовывать молекулы воды, органических кислот, спиртов, аминов. Из адсорбентов водородные связи могут образовывать кремнеземы (силикагель, диатомиты, пористые стекла).
Специфические взаимодействия могут происходить между полярными и неполярными молекулами. Главное, чтобы имелись подвижные электронные пары и свободные электронные орбитали. Например ароматические углеводороды способны специфически взаимодействовать с адсорбентами, имеющими на поверхности локализованные электрические заряды.
Статические сорбционные процессы сравнительно слабо применяются в исследовании нефтей. Но можно решить ряд сложных задач разделения и концентрирования некоторых групп веществ.
Например на сорбентах неоднородной пористости можно сконцентрировать полярные вещества нефти – арены и гетероатомные компоненты. К таким адсорбентам относятся оксиды кремния SiO2, а также оксиды щелочных и щелочноземельных элементов (наиболее широко используются Al2O3 , Fe2O3 или их смеси). Главное их свойство - поверхность у них имеет заряд, адсорбция идет по принципу ориентационного взаимодействия. Фильтрация молекул через такие сорбенты не идет, то есть они неоднородной пористости (встречаются поры мелкие и крупные), главное, чтобы была достаточно развита поверхность адсорбции. И нужная полярность, которую регулируют добавляя к адсорбенту воду.
Силикагели – гель кремниевой кислоты. Это основной сорбент для жидкостно-адсорбционной хроматографии и лучший для разделения смесей нефтяных углеводородов и нефтяных смолистых веществ. Выпускаются крупнопористые и мелкопористые силикагели различных марок АСКГ, КСМГ, КСКГ (2,8-7,0 мм), МСМК (0,25-2,0 мм) . Для колоночной хроматографии нефтей подходят силикагели с размером частиц 100-250 мкм.
На поверхности силикагелей имеются силанольные и силоксановые группы, и три слоя сорбированной воды за счет которых и обеспечивается его разнообразная адсорбционная активность.

Состояние водных слоев на поверхности силикагеля:
Верхний слой слабо сорбированной воды
, удаляется при 18-700С сухим растворителем.
Средний слой слабо сорбированной воды, удаляется при 100-1200С сухим растворителем.
Нижний слой сильно сорбированной воды, удаляется прокаливанием при 200-6500С.
Контролируя количество воды на поверхности сорбента можно контролировать его адсорбционную активность.
Оксид алюминия. Тоже часто применяемый адсорбент для разделения нефтяных веществ. Причем хорошо разделяет как полярные молекулы, так и неполярные. Это свойство оксида алюминия объясняется его амфотерным характером. Так жк как у силикагелей активность оксида алюминия зависит от его влагосодержания. Наиболее активная форма – безводная, увлажняя разнам количеством воды можно получить набор адсорбентов с разной емкостью. Для разделения нефтей подходит дезактивированная 10% воды.
В зависимости от содержания воды различают 6 степеней активности оксида алюминия:
-
Наивысшая I-я по Брокману – 2-3 % воды -
II-я по Брокману – 5-7,5 % воды и т.д.

Неполярные вещества нефти – алканы, циклоалканы, изоалканы – разделяют с помощью неполярных сорбентов, например, активированных углей.
Активированные угли – это неполярные сорбенты. Удельная поверхность составляет 1000-1700 м2/г, поэтому силы взаимодействия углей с молекулами разделяемых веществ очень велики. Область их применения ограничивается разделением газов.
Есть и селективные адсорбенты с помощью которых можно выделить из нефти молекулы строго определенного размера – это цеолиты.
Молекулярные сита. К молекулярным ситам относят обычно цеолиты – пористые кристаллы природных или синтетических алюмосиликатов кальция, натрия и некоторых др. металлов. Поры их кристалов имеют размеры, близкие к размерам молекул жидких или газообразных веществ. Те вещества, которые могут проникнуть в поры цеолитов, сорбируются в кристаллах цеолитов, более крупные молекулы не сорбируются. Так как цеолиты выпускаются с разным размером пор, есть возможность очень четкого разделения разных веществ.
Особенностью молекулярных сит, отличающей их от других типов сорбентов, является строгая однородность структуры и размеров пор.
Механизм прохождения молекул через окна пор цеолитов сложный много фазный процесс. Здесь одновременно проявляются силы притяжения и отталкивания молекул
, значительно влияет строение молекул. Так молекулярные сита с расмером «окон» около 5 А хорошо сорбируют парафиновые УВ нормального строения, а разветвленные молекулы не сорбируются.
Недостатком цеолитов как адсорбентов является их высокая влагоемкость и способность взаимодействовать с кислотами с потерей адсорбционной способности. Некоторые вещества сорбируются в порах безвозвратно. Поэтому область их применения ограничена.
Также известны эти методы как методы удаления нефтяных компонентов из природных смесей веществ. Например, при техногенном нефтяном загрязнении экосистем метод статической адсорбции углеводородов может быть применен для связывания, изолирования и удаления нефтяного загрязнения.
Экстракция
Экстракция – это частный случай абсорбции.
При соприкосновении водного раствора вещества А с каким-либо неводным растворителем, не смешивающимся или ограниченно смешивающимся с водой, растворенное вещество А будет распределяться между обоими растворителями и через некоторое время в такой системе установится равновесие
АВ ↔ АО, где вещество А в воде и органическом растворителе, соответственно.
Процесс переноса растворенного вещества из одной жидкой фазы в другую, с ней не смешивающуюся или ограниченно смешивающуюся, называют жидко-жидкостным распределением.
В общей форме, когда перераспределяется вещество не только между жидкостями, но и твердыми фазами, между твердой и жидкой фазой, жидкой и газовой или твердой и газовой – процесс называют экстракцией.
Экстракция - процесс избирательного извлечения одного или нескольких компонентов из их раствора или смеси жидких или твердых веществ с помощью растворителя (экстрагента), не смешивающегося с указанной выше жидкой или твердой фазой.
Причиной экстракции является различная растворимость веществ в двух взаимно несмешивающихся жидкостях. При соприкосновении двух взаимно нерастворимых жидкостей экстрагируемое вещество распределяется между ними, концентрируясь преимущественно в одной из них.
То есть используется свойство вещества лучше растворяться в одном растворителе, чем в другом.
Экстрагент – растворитель, в который избирательно переходит извлекаемое вещество.
Экстракция складывается из следующих простых операций:
1. Приведение исходной смеси веществ в контакт с экстрагентом
2. механического разделения образовавшихся фаз
3. Удаление и регенерация экстрагента из каждой фазы.
В случае разделения нефти:
Экстрагетом может выступать вода, если мы извлекаем водорастворимые соли из нефти, или органический растворитель. Например, сернистые и ароматические вещества экстрагируются из нефти диметилфорамидом.
Количественной характеристикой экстракции являются степень разделения
(или степень извлечения).
В простейшем случае, когда одно индивидуальное вещество распределяется между двумя несмешивающимися жидкостями (при постоянных Т и Р и химическая форма его не меняется), система подчиняется закону распределения, который выражается формулой:
Кр = а2/а1,
где Кр – коэффициент распределения вещества; а2 и а1 – активности вещества в растворителях. Активность – это сборное понятие, которое включает в себя и парциальное давление вещества и ионную силу и растворимость и др. Иногда ее можно заменить более понятной величиной – концентрацией (когда растворы идеальные и вещество не диссоциирует на ионы, молекулы не взаимодействуют друг с другом):
Кр = С2/С1,
тогда становится понятным, что эта величина характеризует избирательность растворителя к компоненту. Чем выше Кр, тем лучше вещество растворяется во втором растворителе, чем в первом.
Процент экстракции (степень извлечения в %) рассчитывается по формуле:
Е% = 100/(1 + (V1/KpV2)) , где V1 и V2 – объемы первичного раствора и раствора-экстрагента.
| Так как С = M/V (отношение массы к объему), то формула приобретает вид: Кр = M2V1/M1V2 M2/M1 = KpV2/V1, Учитывая, что М1 + М2 = 1, имеем систему уравнений, при решении которых получаем, что количество вещества в каждой фазе можно вычислить по уравнениям: М1 = 1/(1 + Кр(V2/V1)) ; M2 = Kp(V2/V1)/(1 + Kp(V2/V1)) Исходя из этих формул можно рассчитать и полноту (степень) экстракции и количество ступеней экстракции, необходимое для максимального выделения вещества. |
| Пример: определить степень извлечения (?) вещества из 10 мл водного раствора, встряхиванием с 5 мл хлороформа. Коэффициент извлечения равен 410. Е% = 100/(1 + (10/410*5)) = 99,5 % |
Требования к экстрагентам:
-
Селективность -
большое отличие по плотности от исходного раствора -
низкая вязкость -
химическая инертность -
нетоксичность -
низкая стоимость
В лабораторных условиях процесс ЖЖ-экстракции обычно проводят в делительной воронке.