Файл: Кафедра физики расчётнографическая работа 1 Вариант 8 Мальцева Ю. Е. Группа зи221 Номер студенческого билета.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.12.2023
Просмотров: 143
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
. Термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой. Все тела, находящиеся за пределами границ рассматриваемой системы, называются окружающей средой. Поскольку одно и тоже тело, одно и тоже вещество при разных условиях может находится в разных состояниях, (пример: лед – вода – пар, одно вещество при разной температуре) вводятся, для удобства, характеристики состояния вещества – так называемые параметры состояния.
Перечислим основные параметры состояния вещества:
Температура тела - определяет среднюю кинетическую энергию неупорядоченного движения молекул газа. Наиболее распространенная в Европе шкала Цельсия ????0,???? где нулевая температура – температура замерзания воды при атмосферном давлении, а температура кипения воды при атмосферном давлении принята за 100 градусов Цельсия (° С).
Температура ????, выраженная по абсолютной шкале, называется абсолютной (термодинамической) температурой. Соотношение для перехода от градусов Цельсия к градусам Кельвина:
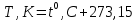 (5.1)
(5.1)
Давление ???? – численно равно силе на единичную площадь этой поверхности, направленной по нормали к поверхности тела:
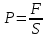 . (5.2)
. (5.2)
Для измерения давления применяются различные единицы измерения. В системе измерения СИ единицей давления служит Паскаль (Па).
Объём ???? служит мерой пространства, занятого термодинамической системой. В системе измерения СИ единицей объёма служит кубический метр (м3).
Уравнение состояния идеального газа (уравнение Клапейрона- Менделеева) для произвольной массы газа ???? выражается формулой
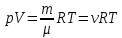 , (5.3)
, (5.3)
где ???? – объём газа; ???? – давление газа; ???? – молярная массы газа; ???? – количество молей вещества; ???? – универсальная газовая постоянная, равная 8,31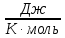 , ???? - термодинамическая температура в градусах Кельвина.
, ???? - термодинамическая температура в градусах Кельвина.
Каждый моль вещества содержит одно и то же количество молекул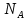 . Поэтому удобно использовать постоянную Больцмана
. Поэтому удобно использовать постоянную Больцмана 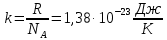
, где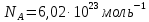 – число частиц в 1 моле вещества (число Авогадро).
– число частиц в 1 моле вещества (число Авогадро).
Тогда уравнение состояния идеального газа можно записать в виде
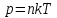 , (5.4)
, (5.4)
где ???? – число молекул в единице объема (концентрация молекул).
Одним из важнейших понятий термодинамики является внутренняя энергия тела ????. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно–кинетической теории, внутренняя энергия вещества складывается из кинетической энергии всех атомов, молекул и потенциальной энергии их взаимодействия друг с другом.
В идеальном газе частицы взаимодействуют только непосредственно в моменты соударений, поэтому потенциальной энергией их взаимодействия можно пренебречь. Тогда внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия идеального газа ???? рассчитывается по формуле:
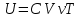 , (5.5)
, (5.5)
где ???? – количество молей вещества; ???? – термодинамическая температуры в градусах кельвина; ???????? – молярная теплоёмкость идеального газа при постоянном объёме.
Внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния. Это значит, что изменение внутренней энергии не зависит от того, как система была переведена из одного состояния в другое (а зависит лишь от характеристик первоначального и конечного состояний), и всегда, в любых процессах для идеального газа определяется выражением:
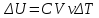 . (5.6)
. (5.6)
Теплоёмкостью вещества называется отношение переданного системе количества теплоты ???????? к происшедшему при этом изменению температуры ????????:
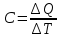 (5.7)
(5.7)
Молярной теплоёмкость называется количество тепловой энергии ????????, которую необходимо сообщить одному молю вещества, для изменения его температуры на один градус кельвина.
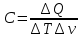
где ∆???? – количество молей вещества; ???????? – количество тепловой энергии; ???????? – изменение температуры.
Различают молярную теплоёмкость ???????? при постоянном объёме и молярную теплоёмкость ????р при постоянном давлении. Они связаны соотношением Майера
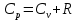 , (5.8)
, (5.8)
где ???? – универсальная газовая постоянная.
Теплоёмкость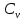 определяется по формуле
определяется по формуле
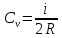 (5.9)
(5.9)
где ???? – число степеней свободы молекулы, которое определяется как число независимых переменных (координат), полностью определяющих положение системы в пространстве.
Учитывая соотношением Майера, теплоёмкость ???????? определяется по формуле
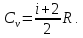 (5.10)
(5.10)
Помимо молярной теплоёмкости ???????? и ????р, различают удельную теплоёмкость ???????? и ????р, которые связаны с молярной теплоёмкостью соотношениями
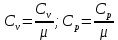
(5.11)
где ???? – молярная массы газа.
Работа, совершаемая газом. При изменении объема на бесконечно малую величину
dV газ совершает элементарную работу ???????? = ????????????, при изменении объема от V1 до V2 работа определяется по формуле
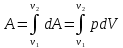 (5.12)
(5.12)
где p – давление газа. При изобарическом процессе (p = const) работа определяется наиболее просто А = ????????????, где ???????? - изменении объема газа от V1 до V2.
Первое начало термодинамики:
Внутренняя энергия идеального газа может изменяться либо в результате совершения над системой работы, либо сообщением ей теплоты. Иными словами, имеются две формы передачи энергии от одних тел к другим: работа и теплота. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения энергии: теплота Q, сообщаемая системе, расходуется на изменение ее внутренней энергии U и на совершение ею работы А против внешних сила. Это утверждение носит название первое начало термодинамики, которое выражается уравнением
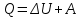 (5.13)
(5.13)
где U – изменение внутренней энергии системы, Q - количество полученной системой теплоты (считается, что Q > 0, если теплота подводится к системе, и Q < 0, если система отдает теплоту), А – работа системы над внешней средой (считается, что A > 0, если система совершает ее против внешних сил и A < 0, если внешние силы совершают работу над системой). В СИ количество теплоты Q выражается в джоулях [Дж].
Процессы в термодинамике
Изохорный процесс – это процесс, протекающий в термодинамической системе при постоянном объёме (V = const). При изохорном процессе газ не совершает работы над внешними телами. Элементарная работа равна dA = pdV = 0, поэтому и полная работа А = 0. Первое начало термодинамики приобретает вид
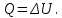 (5.14)
(5.14)
Изобарный процесс – это процесс, протекающий в термодинамической системе при постоянном давлении (p = const). При изобарном процессе расширения объем газа увеличивается от
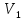 до
до 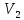 и газ совершает работу
и газ совершает работу
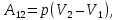 (5.15)
(5.15)
Изотермический процесс – это процесс, протекающий в термодинамической системе при постоянной температуре (T = const). При T = const внутренняя энергия системы не изменяется:
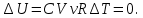 (5.16)
(5.16)
Поэтому первое начало термодинамики запишется виде
???? = ???? (5.17)
Изотермическими являются процессы кипения, плавления, конденсации, происходящие при постоянном внешнем давлении. Работа при изотермическом расширении газа рассчитывается по формуле ????2 ????1
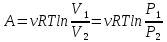 , (5.18)
, (5.18)
где ???? - количество молей вещества; ???? - универсальная газовая постоянная, ???? - термодинамическая температуры в градусах кельвина; ????1????2 - начальный и конечный объём; ????1, ????2 - начальное и конечное давление.
Адиабатический процесс — это процесс, протекающий в термодинамической системе при отсутствии теплообмена между системой и окружающей средой (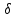 Q = 0). Адиабатическими являются все быстропротекающие процессы (процесс распространения звука в среде; процесс расширения и сжатия горючей смеси в цилиндрах двигателя внутреннего сгорания). Первое начало для адиабатического процесса записывается в виде
Q = 0). Адиабатическими являются все быстропротекающие процессы (процесс распространения звука в среде; процесс расширения и сжатия горючей смеси в цилиндрах двигателя внутреннего сгорания). Первое начало для адиабатического процесса записывается в виде
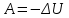 . (5.19)
. (5.19)
При адиабатическом процессе работа совершается за счет изменения внутренней энергии системы. Если газ совершает работу над внешними силами, то его внутренняя энергия уменьшается, если над газом внешние силы совершают работу, то его внутренняя энергия увеличивается.
Уравнение адиабатического процесса записывается через координаты P, V в виде
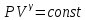 , (5.20)
, (5.20)
где величина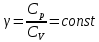 показатель адиабаты. Если выразить давление P из закона Клапейрона, то уравнение адиабатического процесса можно записать через координаты Т, V в виде
показатель адиабаты. Если выразить давление P из закона Клапейрона, то уравнение адиабатического процесса можно записать через координаты Т, V в виде
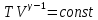 . (5.21)
. (5.21)
Для одноатомных газов (i = 3)
Перечислим основные параметры состояния вещества:
Температура тела - определяет среднюю кинетическую энергию неупорядоченного движения молекул газа. Наиболее распространенная в Европе шкала Цельсия ????0,???? где нулевая температура – температура замерзания воды при атмосферном давлении, а температура кипения воды при атмосферном давлении принята за 100 градусов Цельсия (° С).
Температура ????, выраженная по абсолютной шкале, называется абсолютной (термодинамической) температурой. Соотношение для перехода от градусов Цельсия к градусам Кельвина:
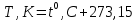 (5.1)
(5.1) Давление ???? – численно равно силе на единичную площадь этой поверхности, направленной по нормали к поверхности тела:
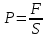 . (5.2)
. (5.2) Для измерения давления применяются различные единицы измерения. В системе измерения СИ единицей давления служит Паскаль (Па).
Объём ???? служит мерой пространства, занятого термодинамической системой. В системе измерения СИ единицей объёма служит кубический метр (м3).
Уравнение состояния идеального газа (уравнение Клапейрона- Менделеева) для произвольной массы газа ???? выражается формулой
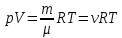 , (5.3)
, (5.3) где ???? – объём газа; ???? – давление газа; ???? – молярная массы газа; ???? – количество молей вещества; ???? – универсальная газовая постоянная, равная 8,31
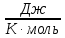 , ???? - термодинамическая температура в градусах Кельвина.
, ???? - термодинамическая температура в градусах Кельвина. Каждый моль вещества содержит одно и то же количество молекул
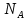 . Поэтому удобно использовать постоянную Больцмана
. Поэтому удобно использовать постоянную Больцмана 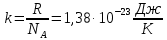
, где
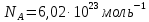 – число частиц в 1 моле вещества (число Авогадро).
– число частиц в 1 моле вещества (число Авогадро). Тогда уравнение состояния идеального газа можно записать в виде
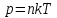 , (5.4)
, (5.4) где ???? – число молекул в единице объема (концентрация молекул).
Одним из важнейших понятий термодинамики является внутренняя энергия тела ????. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно–кинетической теории, внутренняя энергия вещества складывается из кинетической энергии всех атомов, молекул и потенциальной энергии их взаимодействия друг с другом.
В идеальном газе частицы взаимодействуют только непосредственно в моменты соударений, поэтому потенциальной энергией их взаимодействия можно пренебречь. Тогда внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия идеального газа ???? рассчитывается по формуле:
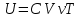 , (5.5)
, (5.5) где ???? – количество молей вещества; ???? – термодинамическая температуры в градусах кельвина; ???????? – молярная теплоёмкость идеального газа при постоянном объёме.
Внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния. Это значит, что изменение внутренней энергии не зависит от того, как система была переведена из одного состояния в другое (а зависит лишь от характеристик первоначального и конечного состояний), и всегда, в любых процессах для идеального газа определяется выражением:
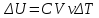 . (5.6)
. (5.6) Теплоёмкостью вещества называется отношение переданного системе количества теплоты ???????? к происшедшему при этом изменению температуры ????????:
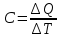 (5.7)
(5.7) Молярной теплоёмкость называется количество тепловой энергии ????????, которую необходимо сообщить одному молю вещества, для изменения его температуры на один градус кельвина.
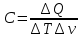
где ∆???? – количество молей вещества; ???????? – количество тепловой энергии; ???????? – изменение температуры.
Различают молярную теплоёмкость ???????? при постоянном объёме и молярную теплоёмкость ????р при постоянном давлении. Они связаны соотношением Майера
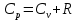 , (5.8)
, (5.8) где ???? – универсальная газовая постоянная.
Теплоёмкость
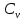 определяется по формуле
определяется по формуле 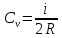 (5.9)
(5.9) где ???? – число степеней свободы молекулы, которое определяется как число независимых переменных (координат), полностью определяющих положение системы в пространстве.
-
Одноатомная молекула идеального газа имеет три степени свободы поступательного движения, т.е. i=3. -
Двухатомная молекула идеального газа имеет три степени поступательного движения и две степени свободы вращательного движения, т.е. i=5. -
Трехатомная молекула идеального газа имеет три степени поступательного движения и три степени вращательного движения, т.е. i=6.
Учитывая соотношением Майера, теплоёмкость ???????? определяется по формуле
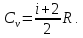 (5.10)
(5.10) Помимо молярной теплоёмкости ???????? и ????р, различают удельную теплоёмкость ???????? и ????р, которые связаны с молярной теплоёмкостью соотношениями
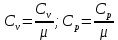
(5.11)
где ???? – молярная массы газа.
Работа, совершаемая газом. При изменении объема на бесконечно малую величину
dV газ совершает элементарную работу ???????? = ????????????, при изменении объема от V1 до V2 работа определяется по формуле
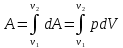 (5.12)
(5.12) где p – давление газа. При изобарическом процессе (p = const) работа определяется наиболее просто А = ????????????, где ???????? - изменении объема газа от V1 до V2.
Первое начало термодинамики:
Внутренняя энергия идеального газа может изменяться либо в результате совершения над системой работы, либо сообщением ей теплоты. Иными словами, имеются две формы передачи энергии от одних тел к другим: работа и теплота. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения энергии: теплота Q, сообщаемая системе, расходуется на изменение ее внутренней энергии U и на совершение ею работы А против внешних сила. Это утверждение носит название первое начало термодинамики, которое выражается уравнением
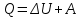 (5.13)
(5.13) где U – изменение внутренней энергии системы, Q - количество полученной системой теплоты (считается, что Q > 0, если теплота подводится к системе, и Q < 0, если система отдает теплоту), А – работа системы над внешней средой (считается, что A > 0, если система совершает ее против внешних сил и A < 0, если внешние силы совершают работу над системой). В СИ количество теплоты Q выражается в джоулях [Дж].
Процессы в термодинамике
Изохорный процесс – это процесс, протекающий в термодинамической системе при постоянном объёме (V = const). При изохорном процессе газ не совершает работы над внешними телами. Элементарная работа равна dA = pdV = 0, поэтому и полная работа А = 0. Первое начало термодинамики приобретает вид
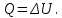 (5.14)
(5.14) Изобарный процесс – это процесс, протекающий в термодинамической системе при постоянном давлении (p = const). При изобарном процессе расширения объем газа увеличивается от
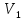 до
до 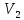 и газ совершает работу
и газ совершает работу 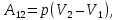 (5.15)
(5.15) Изотермический процесс – это процесс, протекающий в термодинамической системе при постоянной температуре (T = const). При T = const внутренняя энергия системы не изменяется:
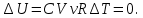 (5.16)
(5.16) Поэтому первое начало термодинамики запишется виде
???? = ???? (5.17)
Изотермическими являются процессы кипения, плавления, конденсации, происходящие при постоянном внешнем давлении. Работа при изотермическом расширении газа рассчитывается по формуле ????2 ????1
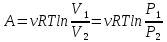 , (5.18)
, (5.18) где ???? - количество молей вещества; ???? - универсальная газовая постоянная, ???? - термодинамическая температуры в градусах кельвина; ????1????2 - начальный и конечный объём; ????1, ????2 - начальное и конечное давление.
Адиабатический процесс — это процесс, протекающий в термодинамической системе при отсутствии теплообмена между системой и окружающей средой (
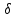 Q = 0). Адиабатическими являются все быстропротекающие процессы (процесс распространения звука в среде; процесс расширения и сжатия горючей смеси в цилиндрах двигателя внутреннего сгорания). Первое начало для адиабатического процесса записывается в виде
Q = 0). Адиабатическими являются все быстропротекающие процессы (процесс распространения звука в среде; процесс расширения и сжатия горючей смеси в цилиндрах двигателя внутреннего сгорания). Первое начало для адиабатического процесса записывается в виде 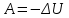 . (5.19)
. (5.19) При адиабатическом процессе работа совершается за счет изменения внутренней энергии системы. Если газ совершает работу над внешними силами, то его внутренняя энергия уменьшается, если над газом внешние силы совершают работу, то его внутренняя энергия увеличивается.
Уравнение адиабатического процесса записывается через координаты P, V в виде
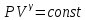 , (5.20)
, (5.20) где величина
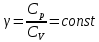 показатель адиабаты. Если выразить давление P из закона Клапейрона, то уравнение адиабатического процесса можно записать через координаты Т, V в виде
показатель адиабаты. Если выразить давление P из закона Клапейрона, то уравнение адиабатического процесса можно записать через координаты Т, V в виде 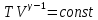 . (5.21)
. (5.21) Для одноатомных газов (i = 3)