ВУЗ: Казахский национальный медицинский университет им. С.Д. Асфендиярова
Категория: Шпаргалка
Дисциплина: Химия
Добавлен: 05.02.2019
Просмотров: 12577
Скачиваний: 45

28. свОйства кОвалентнОй связи
длина связи — расстояние между центрами свя
занных ядер. Оно зависит от вида связанных атомов,
а также от типа связи (простая, двойная или тройная)
между атомами.
валентный угол (угол между связями) определя
ется прежде всего типом электронных орбиталей,
образующих связь. В зависимости от типа гибриди
зации атома углерода углы между связями равны
109°28’ (sp
3
), 120° (sp
2
) или 180°(sp). Реальные ва
лентные углы несколько отличаются от теоретически
рассчитанных.
Энергия связи — энергия, необходимая для разру
шения одной ковалентной связи в молекуле в газооб
разном состоянии. Показатель отражает прочность
связи. Примеры энергии углеродуглеродных связей:
С—С 335 кДж/моль, С=С 628 кДж/моль, С≡С 837
кДж/моль. Энергия диссоциации — энергия, необ
ходимая для гомолитического расщепления отде
льной связи на составляющие атомы. Энергия диссо
циации отличается от энергии связи тем, что расщеп
ление обязательно идет до атомов, а при определении
энергии связи молекул, содержащих более 2 атомов, в
результате расщепления связи не может образоваться
2 атомов, образуются многоатомные частицы. Для
двухатомных молекул энергия диссоциации равна
энергии связи. полярность связи характеризует
смещение электронной пары, образующей связь, в
сторону одного из связанных атомов (поляризацию).
Такое смещение обусловлено неодинаковой электро
отрицательностью (электроноакцепторностью, т.е.
способностью притягивать электроны) различных
атомов. В результате у атома, к которому направлено

смещение электронной плотности, появляется час
тичный отрицательный заряд, а у соседнего — час
тичный положительный.
На степень поляризации связи оказывают влияние
соседние группы или атомы, а также внешние воз
действия (молекулы растворителя, молекулы реаген
та в процессе реакции).
Смещение электронной плотности полярной усвя
зи обозначают прямой стрелкой, совпадающей с ва
лентной чертой, смещение полярной кратной свя
зи — изогнутой стрелкой:
поляризуемость связи — смещение электронно
го облака по отношению к ядрам под влиянием вне
шнего электромагнитного поля. Поляризуемость оп
ределяется легкостью смещения электронов связи.
По поляризуемости рсвязь значительно превосходит
усвязь. Полярность связей и поляризуемость опре
деляет реакционную способность и механизм реак
ций органических соединений.
Неравномерное распределение электронной плот
ности ковалентной связи создает разделение заря
дов, которое характеризуется дипольным момен-
том м. Суммарный дипольный момент молекулы яв
ляется векторной суммой связей, определяют экспе
риментально. Дипольный момент отдельной связи
можно непосредственно измерить только для двух
атомных молекул. В симметрично построенных моле
кулах дипольный момент равен нулю. На основании
значений дипольных моментов молекул можно полу
чить информацию об их строении.
δ
+
δ
–
δ
+
δ
–
С
Сl
С=C

29. прОмежутОчные частицы
(радикалы, карбкатиОны,
карбаниОны)
В процессе химической реакции происходят раз
рыв химических связей в реагирующих молекулах и
образование новых. Если в результате разрыва связи
у каждого из атомов останется по одному электрону
из пары, такой разрыв называют гомолитическим, а
образующиеся незаряженные частицы с неспаренны
ми электронами — радикалами. Разрыв связи может
произойти и таким образом, что электронная пара
связи окажется у одного из атомов, который тем са
мым получит лишний электрон и с ним отрицатель
ный заряд. Такой разрыв связи называют гетероли-
тическим, а образующиеся частицы — катионом и
анионом. Если положительный заряд возник на ато
ме углерода, то такой катион называют карбкатио-
ном, а отрицательный — карбанионом.
Радикалы, карбкатионы, карбанионы — частицы,
промежуточно образующиеся в ходе химических ре
акций, они исключительно реакционноспособны и
обычно не могут существовать в свободном виде про
должительное время.
На стабильность, устойчивость промежуточных час
тиц оказывает влияние строение молекулы в целом.
Превращение карбкатионов в стабильные продукты
происходит по двум основным путям: взаимодей
ствие с частицами, имеющими электронную пару;
отщепление протона от соседнего атома.
Образование устойчивых соединений из карбанио
нов чаще всего происходит в результате их реакций с
протоном или частицей, имеющей вакантную орби
таль на внешней электронной оболочке.

30. индукциОнный и мезОмерный
Эффект. Эффект гиперкОнъЮгации
Электронное облако симметрично относительно
середины связи только в том случае, если с обоих
концов связи находятся атомы (группы атомов) с оди
наковой электроноакцепторностью. Если ковалентная
связь соединяет два атома (группы атомов) с различ
ной электроноакцепторностью, то чем она больше, тем
сильнее смещено электронное облако в сторону бо
лее электро отрицательного атома, вслед ствие чего
на атомах появляются частичные положительные и
отрицательные заряды.
индукционный эффект (I-эффект) — это передача
электронного влияния заместителей по цепи σсвязи.
Если атом или группа атомов оттягивает на себя элек
троны связи, то считают, что атом или группа обладает
отрицательным индукционным эффектом (–I), если
отталкивает от себя электроны, то положительным
индукционным эффектом (+I).
Нарушение равномерного распределения электрон
ной плотности в молекуле, смещение электронной
плотности могут быть следствием мезомерного эф-
фекта (эффект сопряжения). Он характерен для со
единений, содержащих кратные связи или атомы с не
поделенными электронными парами. Такой мезомер
ный эффект называют положительным. Карбонильная
группа может служить примером, в котором проявляет
ся отрицательный мезомерный эффект (–М).
Эффект гиперконъюгации — эффект у, рсопря
жения, при котором происходит перекрывание орби
тали связи С—Н и р-орбитали.
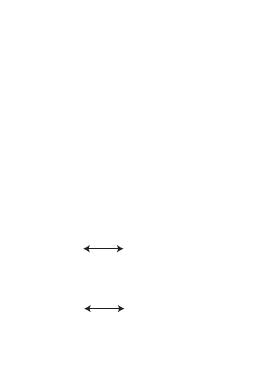
31. теОрия резОнанса
Теорию резонанса (Л. Полинг, 1928) применяют
для описания химической связи молекул, строение
которых невозможно представить однозначно с по
мощью символики структурных формул. Согласно ей,
если для соединения можно написать несколько воз
можных структур (канонические формы), отличаю
щихся только распределением электронов, в которых
положение атомов одинаково, то реальная молекула
представляется как гибрид этих структур. Сами кано
нические формы не существуют, а строение реальной
молекулы является чемто средним между этими
структурами. На схемах такие структуры связывают
стрелкой с двумя остриями (↔). Например, структуру
органических нитросоединений и анионов карбоно
вых кислот описывают с помощью резонансных
структур. Обе связи N—O, как и обе связи С—О,
имеют одинаковые межатомные расстояния и вклю
чают одинаковое число электронов.
Энергия реальной молекулы меньше, чем энергия
любой из отдельных резонансных структур.
нитросоединение
карбоксилат-ион
||
||
R—N
+
—
—
O
O
–
R—N
+
O
O
–
||
||
R—C —
—
O
O
–
R—C
O
O
–