ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.12.2023
Просмотров: 41
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«ТЮМЕНСКИЙ ИНДУСТРИАЛЬНЫЙ УНИВЕРСИТЕТ»
Институт дополнительного и дистанционного образования
Кафедра Общей и специальной химии
Лабораторная работа №3
«Титрование растворов (метод нейтрализации)»
по дисциплине: «ОСНОВЫ ИНЖЕНЕРНО ХИМИИ» ВАРИАНТ № 8
Выполнил студент группы
БТПб(до)з-20-2
Волков Максим Юрьевич
Номер зачетной книжки 20-10-000298
Проверил: Агейкина О.В.
Тюмень, 2021
Лабораторная работа «Титрование растворов (метод нейтрализации)»
Цель работы: знакомство с титриметрическим анализом. Освоить технику титрования. Определить концентрацию раствора при помощи кислотно-основного титрования
Опыт 1. Определение молярной концентрации эквивалента (эквивалентной концентрации) раствора щелочи по стандартному раствору соляной кислоты.
Ход работы. С помощью пипетки отбирают аликвоту раствора щелочи V(NaOH) (10 мл) и помещают его в колбу для титрования. Затем добавляют 2-3 капли индикатора метилоранжа и титруют стандартным раствором соляной кислоты до перехода окраски индикатора из желтой в розовую. Объем титранта (кислоты) пошедшей на титрование V(HCl) замеряют по бюретке. Титрование проводят 2-3 раза, до сходящихся результатов. Для расчетов берут средний объем титранта.
NaOH+HCl → NaCl+H2O прямое кислотно-основное титрование
ОН- + Н+ → Н2О
Метилоранж в щелочной среде желтый, красно-розовый в кислой среде. Последняя избыточная капля соляной кислоты обуславливает изменение окраски на розовый.
Объем титранта:
V1(HCl)= 10,5 мл
V2(HCl)= 10,00 мл
V3(HCl)= 9,90 мл
 ????(HCl) =(10,05+10,00)/2 = 10,025 мл
????(HCl) =(10,05+10,00)/2 = 10,025 мл
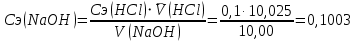 моль/дм3 или 100,25 моль/м3
моль/дм3 или 100,25 моль/м3
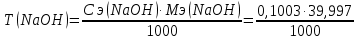 =0,004012 г/см3
=0,004012 г/см3
КП (NaOH)=0,1003/0,1 = 1,003
Вывод:
Прямая ацидиметрия позволяет определить точную концентрацию щелочи, концентрация которой со временем меняется.
3. Что означает термин «стандартизированный» раствор?
Стандартизированные (установленные) растворы - готовят сначала раствор приблизительно требуемой концентрации, а затем его стандартизируют по первичному стандарту-установочному веществу.
4. Какая мерная посуда применяется при титровании? Бюретки, пипетки, микробюретки, цилиндр, мерная колба.
5. На каком законе основаны вычисления в титриметрическом анализе? Приведите основные расчетные формулы.
Закон эквивалентов.


7.Что такое точка эквивалентности? Как она фиксируется?
Точка эквивалентности – момент, когда число эквивалентов добавляемого титранта (Т) эквивалентно или равно числу эквивалентов определяемого вещества (Х) в образце.
Момент, при котором заканчивают титрование, называют конечной точкой титрования (к.т.т).
Конечную точку титрования определяем при помощи индикаторов, которые изменяют свою окраску - это и будет подтверждение точки эквивалентности.
Лабораторная работа 4.1.2 «Определение жесткости воды титриметрическим методом»
Цель работы: определить жесткость исследуемой воды при помощи кислотно-основного и комплексонометрического титрования.
Опыт 1. Определение карбонатной жёсткости воды
Ход работы.
1. При помощи мерного цилиндра отбирают 100 мл исследуемой воды и переливают её в коническую колбу для титрования. Добавляют в воду 2-3 капли раствора индикатора метилового оранжевого.
2. Титруют пробу воды 0,1 н. раствором соляной кислоты (по каплям) при постоянном перемешивании до тех пор, пока раствор не поменяет окраску с желтой на оранжево-розовую.
Титрование проводят не менее двух раз (до совпадения результатов), каждый раз доливая в бюретку соляной кислоты до нулевого деления.
Ca(HCO3)2+2HCl→CaCl2+2H2O+2CO2↑
HCO3- + Н+ → H2O+CO2↑
Mg(HCO3)2+2HCl→ MgCl2+2H2O+2CO2↑
HCO3- + Н+ → H2O+CO2↑
Ацидиметрия, прямое титрование
Объем титранта :
V1(HCl)= 2,00 мл
V2(HCl)= 2,10 мл
V3(HCl)= 1,90 мл
Vср= (V2+ V3/2) = (2,10+1,90)/2=2,00 мл
Растворенные гидрокарбонаты в воде гидролизуются, поэтому вода, содержащая гидрокарбонаты кальция и магния, имеет щелочную реакцию среды:
НСО3 - + Н2О ⇄ Н2СО3 + ОН-

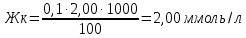
Вывод:
Карбонатную жесткость определяют методом титрования исследуемой воды соляной кислотой, при этом растворенные в воде гидрокарбонаты количественно реагируют с соляной кислотой.
Опыт 2. Определение общей жёсткости воды
Ход работы.
1. В коническую колбу на 250 мл помещают 100мл исследуемой водопроводной воды, добавляют с помощью пробирки с делениями 5 мл аммиачной буферной смеси и присыпают несколько кристалликов индикатора эриохрома черного до вишнево-красной окраски. Добавление индикатора проводят постепенно небольшими порциями при интенсивном перемешивании пробы.
2. Приготовленную пробу воды титруют раствором трилона Б до перехода вишнево-красной окраски индикатора в синюю.
Титрование проводят не менее двух раз (до совпадения результатов), каждый раз доливая в бюретку трилон Б до нулевого деления.
V1(Тр.Б)= 5,45 мл
V2(Тр.Б)= 5,40 мл
V3 (Тр.Б) =5,50 мл
 ???? (Тр.Б) =(5,45+5,40+5,50)/2=5,45 мл
???? (Тр.Б) =(5,45+5,40+5,50)/2=5,45 мл
Молекулярное уравнение на примере сульфата магния:
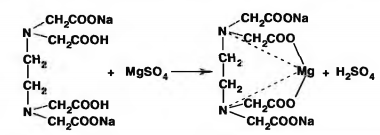
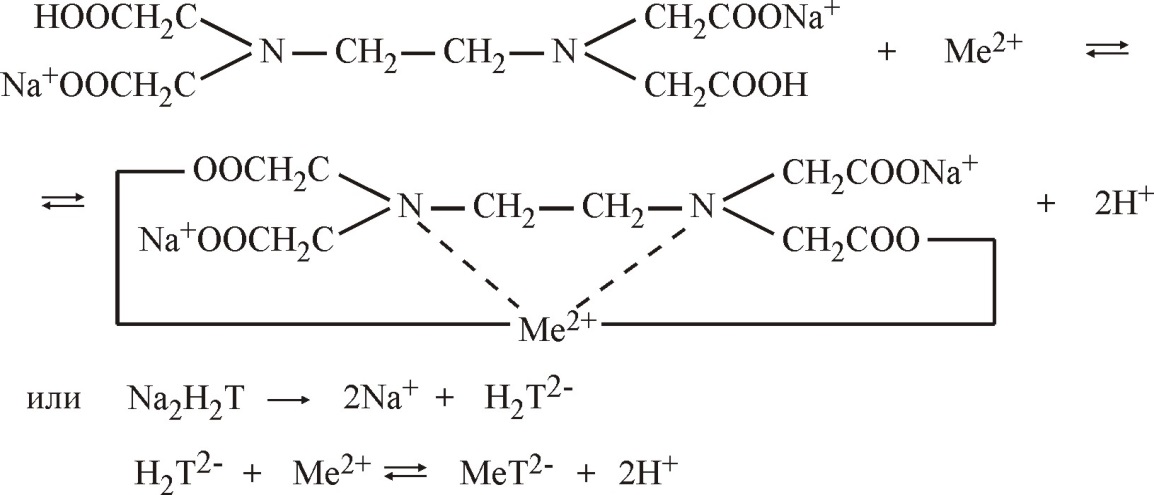
Взаимодействие трилона Б с ионами кальция и магния в значительной степени зависит от рН среды и наиболее полно протекает в слабо щелочной среде (рН
10), поэтому в пробу
воды добавляют аммиачную буферную смесь, состоящую из гидроксида и хлорида аммония (NH4OH и NH4Cl).
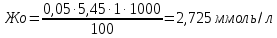
Вода мягкая. Показатель для воды питьевой в пределах нормы.
Жнк = Жо - Жк = 2,725-2,00=0,725 ммоль/л
Вывод: общую жесткость воды определяют комплексонометрическим методом (трилонометрия).
1. В чем сущность комплексонометрического титрования?
Метод комплексообразования (комплексонометрическое титрование или комплексонометрия) основан на том, что титрант образует с анализируемым катионом прочное комплексное соединение, растворимое в воде. Связывание определяемого иона в комплекс тем полнее, чем прочнее образующийся комплекс, т.е. чем больше константа его устойчивости.
2. Концентрацию каких веществ можно определить с помощью комплексонометрии?
Комплексометрически можно определять как ионы-комплексообразователи, так и ионы или молекулы, служащие лигандами.
Трилонометрическим методом определяют:
А) общую жесткость воды,
Б) практически все катионы щелочноземельных металло и тяжелых металлов,
В) в фармацевтическом анализе – лекарственные формы, содержащие катионы щелочноземельных металлов.
7. На чем основано определение временной, постоянной и общей жесткости воды?
Временная жесткость – на реакции гидрокарбонатов с соляной кислотой. Гидрокарбонаты, гидролизуясь, создают щелочную среду. Избыточная капля титранта создают кислую среду, индикатор меняет свой цвет.
Общая жесткость - на образовании хелатов с ЭДТА в аммиачном буфере.
Постоянную жесткость определяют как разность между общей и временной жесткостью.