ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.12.2023
Просмотров: 36
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Основная часть
Аргентометрический титриметрический метод анализа основан на применении в качестве осадителя стандартного раствора серебра нитрата:
Аg+ + Наl- ↔ АgНаl↓
Стандартный раствор 0,1 моль/дм3 серебра нитрата может быть приготовлен:
- как первичный стандартный раствор;
- вторичный стандартный раствор.
Для приготовления первичного стандартного 0,1 моль/дм3 раствора AgNО3 рассчитанную навеску химически чистой соли AgNО3 взвешивают на аналитических весах, переносят в мерную колбу, растворяют в дистиллированной воде, доводят объем раствора до метки, тщательно перемешивают и переносят в склянку из темного стекла.
При приготовлении вторичного стандартного раствора АgNО3 рассчитанную навеску соли взвешивают на технических весах, переносят через воронку в склянку из темного стекла, добавляют цилиндром необходимый объем дистиллированной воды и тщательно перемешивают. Полученный вторичный стандартный раствор AgNО3 стандартизуют по химически чистым стандартным веществам KCl или NaCl или же по их растворам.
Концентрация стандартных растворов серебра нитрата изменяется при длительном хранении. Причиной нестойкости растворов серебра нитрата является их светочувствительность, потому эти растворы следует хранить в склянках из темного стекла либо в посуде, обернутой черной бумагой или покрытой черным лаком, и в защищенном от света месте. Их концентрацию необходимо периодически проверять.
-
Кривые титрования
Кривые титрования в аргентометрии обычно строят в координатах pAg – V, где pAg – взятый с обратным знаком логарифм концентрации ионов Ag+, V — объем титранта. В качестве титранта выступают AgNO3 или KSCN, может быть взят также раствор NaCl.
Рассчитаем кривую титрования 100,0 мл 0,10 М раствора NaCl раствором 0,10 М AgNO3, принимая для простоты расчетов, что объем раствора при титровании не изменяется и разница между активностью и концентрацией ионов несущественна.
В водном растворе NaCl диссоциирован нацело, поэтому концентрация хлорид-ионов С1- в начальной точке кривой титрования, когда титрант еще не добавлялся, равна концентрации NaCl, т. е. 0,10 моль/л и рСl = 1,00.
Добавление 1,00 мл раствора AgNO3
к NaCl вызовет образование осадка AgCl, и концентрация хлорид-ионов С1- в растворе уменьшится. Равновесные концентрации ионов в растворе будут равны: [Ag+] = х, [С1-] = 0,099 + х. В соответствии с правилом произведения растворимости [Ag+] [С1-] = = 1,78 *10-10 можно записать: х(х + 0,099) = 1,78 * 10-10, откуда х = [Ag+] = = ( 1,78 * 10-10 ) / 0,099 = 1,8 * 10-9 моль/л, или pAg = 8,74.
Добавление 90,0 мл раствора AgNO3 свяжет примерно 90% хлорида в осадок AgCl, и в растворе останутся равновесные концентрации [Ag+] = х и [С1-] = =0,01 + x. Из ПР получаем = (1,78 * 10-10 ) / (1,0*10-2 ) = 1,78 * 10-8 моль/л, что соответствует pAg =7,74.
Если добавить 99,0 мл раствора AgNO3, то концентрация [Ag+] = х и [С1-] = =1,0 * 10-3 + x, откуда х = [Ag+] = (1,78 * 10-10 ) / (1,0*10-3 ) = 1,78 * 10-7 моль/л, или pAg =6,74.
После добавления 99,9 мл раствора AgNO3, в анализируемом растворе останется примерно 0,1 % взятого для титрования количества хлорида, т. е. в растворе будет [Ag+] = х и [С1-] = 10-4 + x и х = (1,78 * 10-10 ) / (1,0*10-4 ) = =1,78 * 10-6 моль/л, откуда pAg = 5,74.
При добавлении 100,0 мл раствора AgNO3 достигается точка эквивалентности, в которой концентрации ионов Ag+ и С1 - одинаковы: [Ag+] = [С1] = =
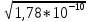 = 1,33 * 10-5 моль/л и pAg = 4,88.
= 1,33 * 10-5 моль/л и pAg = 4,88. Избыток в 0,10 мл раствора AgNO3 сверх эквивалентного приводит к концентрации [Ag+] = 10-4 + х и [С1] = х, а так как х << 1,0 * 10-4, то [Ag+] = = 1,0 * 10-4 моль/л и pAg = 4,0.
Избыток в 1,00 мл раствора AgNO3 дает [Ag+] = = 1,0 * 10-3 моль/л и pAg =3,0.
Результаты проделанных расчетов представлены графически на рис. 1. Кривая аргентометрического титрования, как показывает этот рисунок, сохраняет традиционный вид. Сначала от первых капель до оттитровывания 90% имеющегося хлорида pAg изменяется всего на одну единицу, затем то же изменение pAg вызывает только 9,0 мл раствора AgNO3, а в области точки эквивалентности наблюдается скачок титрования. Добавление 0,2 мл раствора AgNO3 в этой области (от 99,9 до 100,1 мл) вызывает изменение pAg от 5,74 до 4,00, т. е. почти на две единицы. Величина скачка титрования возрастает с увеличением концентрации реагирующих веществ и с уменьшением температуры, так как понижение температуры вызывает уменьшение ПР. Зависимость величины скачка титрования от ПР можно проследить, если рассчитать область скачка титрования для реакции взаимодействия AgNO3 с бромидом и иодидом натрия. Результаты расчетов также представлены на рис. 1, где наглядно видно увеличение скачка титрования с уменьшением ПР соли серебра, образующейся при титровании.
Раздельное аргентометрическое определение нескольких анионов в смеси удается только при значительном различии ПР образующихся осадков. Так, теоретически возможно последовательное титрование трех галогенид-ионов раствором AgNO3: вначале осаждается иодид, дающий наименее растворимый осадок, затем бромид и хлорид. На практике при таком титровании возможны систематические погрешности, связанные с адсорбцией и соосаждением ионов.
| Стадия титрования | Степень оттитрованности | рAg |
| До ТЭ | 0 < f < 1 | pПР-рС+lg(1-f) |
| В ТЭ | f = 1 | 1/2рПР |
| После ТЭ | f > 1 | рС-lg(f-1) |
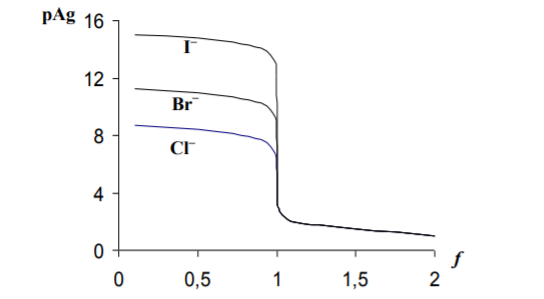
Рис. 1. Кривые аргенометрического титрования: 1 – NaCl, 2 — NaBr, 3 — NaI
2. Индикаторы
В аргентометрии применяют различные способы установления точки эквивалентности как с помощью индикаторов, так и без них.
-
Безындикаторные способы
Хлорид - ионы определяют по так называемому способу равного помутнения (метод Гей-Люссака). При этом анализируемый раствор титруют стандартным раствором серебра нитрата, конец титрования определяют путем отбора двух проб титруемого раствора в две пробирки вблизи конечной точки титрования: в одну из них прибавляют каплю стандартного раствора серебра нитрата, в другую – каплю стандартного раствора натрия хлорида такой же концентрации. В недотитрованном растворе появляется помутнение в пробирке с серебра нитратом, в перетитрованном - в пробирке с натрия хлоридом. В конечной точке титрования раствор в обеих пробирках имеет одинаковое помутнение.
Бромид- и йодид- ионы определяют безындикаторным способом просветления. Суть его состоит в том, что при добавлении к анализируемому раствору из бюретки небольшими порциями стандартного раствора серебра нитрата в начале образуется коллоидный раствор серебра бромида, а в момент эквивалентности происходят коагуляция коллоидных частиц и осаждение их в виде творожистых хлопьев
, раствор при этом осветляется. Этот метод достаточно точен, но в настоящее время применяется редко.
Из современных безындикаторных методов в аргентометрии чаще всего применяется потенциометрическое определение точки эквивалентности с использованием серебряных или галогенид-селективных электродов.
-
Индикаторные способы
Выбор индикатора по кривой титрования. При выборе индикатора выбирают такой ион, который образует окрашенное соединение с ионом серебра в пределах скачка титрования, то есть при рАg = 4...6 ед. наиболее пригодным оказывается K2CrО4, т. к. ПР = 1,1 * 10 -12 и анион CrO42- образуют окрашенный осадок с ионами серебра при концентрации последних, отвечающих значениям в пределах скачка на кривой титрования.
Произведем расчет концентрации хромат-ионов, при которой произойдет образование осадка Ag2CrО4 в конечной точке титрования:
2Аg+ + CrO42- ↔ Ag2CrО4↓
Концентрация ионов серебра в этот момент равна: [Аg+] =
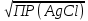 = =
= =  = 1,33*10 -5 моль/ дм3.
= 1,33*10 -5 моль/ дм3.ПР(Ag2CrО4) = [Аg+]2[СrО42-], отсюда [СrО42-] = ПР / [Ag+]2.
Подставив в эту формулу значение равновесной концентрации ионов серебра, получаем:
[СrО42-] = ПР / [Ag+]2 = 1,1 ∙ 10-12 / (1,33 ∙ 10-5)2 = 1,1 ∙ 10-12 / 1,78 ∙ 10-10 ≈ ≈ 0,6 ∙ 10-2 моль/дм3
Таким образом, если концентрация хромат-ионов в растворе будет не менее 0,6∙10 -2 моль/дм3, то после полного осаждения Сl -ионов образуется кирпично-красный осадок серебра хромата, что укажет на конец титрования.
В зависимости от применяемого индикатора в аргентометрии различают следующие методы:
-
метод Мора, основанный на реакции между ионами серебра и галогенид - ионами в присутствии индикатора - раствора калия хромата; -
метод Фольгарда (тиоцианатометрия), основанный на реакции между ионами серебра и тиоцианат-ионами в присутствии ионов железа (III) в качестве индикатора; -
метод Фаянса - Ходакова основан на применении адсорбционных индикаторов.
2.2. МЕТОД МОРА
Титрантом метода является раствор 0,1 (или 0,05; 0,02; 0,01) моль/дм
3 серебра нитрата. В качестве индикатора используют раствор 0,01 моль/дм3 калия хромата, применение которого основано на дробном осаждении. Суть метода заключается в том, что при титровании галогенид-ионов в присутствии хромат-ионов в первую очередь осаждаются галогенид-ионы:
Hal - + Ag + ↔ AgHal↓
Когда определяемые галогенид-ионы практически полностью осаждаются в виде AgHal, только тогда начинает выпадать кирпично-красный осадок Ag2СrО4:
СrО42- + 2Ag+ ↔ Ag2СrО4↓
Это обусловлено различной растворимостью солей АgНаl и Ag2CrO4↓. Рассмотрим это на примере титрования раствора 0,1 моль/дм3 КСI раствором 0,1 моль/дм3 AgNО3 в присутствии индикатора - раствора 0,01 моль/дм3 K2CrО4. В растворе АgСl величина ПР(AgCl) = 1,78 ∙ 10 -10 достигается при концентрации ионов Ag+, равной:
[Ag+] = ПР (AgCl) / [Cl-] = 1,78 ∙ 10-10 / 10-1 = 1,78 ∙ 10-9 моль/дм3.
Осаждение Ag2CrО4 с величиной ПР = 1,1 ∙ 10-12 начнется при концентрации ионов серебра, равной:
[Ag+] =
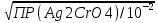 =
= 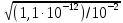 = 1,05 ∙ 10-5
= 1,05 ∙ 10-5Так как ПР (AgCl) достигается при меньшей концентрации ионов серебра (1,78 ∙ 10-9 моль/дм3), чем ПР (Ag2CrО4) ( [Ag+] = 1,05 ∙ 10 -5 моль/дм3), то первым осаждается АgСl.
По мере прибавления титранта концентрация ионов серебра в растворе возрастает, и при [Ag+] = 1,05 ∙ 10-5 моль/дм3 наряду с AgСl образуется осадок AgCrO4. Титрование заканчивают, когда взмученный в жидкости осадок от одной капли титранта (раствора серебра нитрата) приобретает красно-оранжевую окраску (начало выпадения осадка AgCrO4).
В этот момент концентрация хлорид-ионов в растворе будет равна:
[Cl-] = ПР(AgCl) / [Ag+] = 1,78 ∙ 10-10 / 1,05 ∙ 10-5 = 1,7 ∙ 10-5 моль/дм3.
Следовательно, в данных условиях выпадение осадка серебра хромата начинается только после практически полного осаждения Сl-ионов.
Условия титрования по методу Мора:
1. Титрование следует проводить в нейтральной или слабощелочной среде (6,5≤ рН≤ 10). Метод нельзя применять:
а) в кислой среде из-за растворяемости осадка Ag2CrО4:
2Аg2СгО4. + 2Н+ → 4Аg+ + Cr2O72- + Н2О
б) в щелочной среде из-за разложения титранта с образованием осадка Аg