ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.01.2024
Просмотров: 181
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Федеральное
Государственное бюджетное образовательное учреждение высшего
образования
Уфимский государственный авиационный технический университет
филиал в городе Ишимбае
Кафедра ОПД
Задачник по химии
Для студентов заочного отделения
Составитель: ст. преподаватель
Костернова С.П.
Ишимбай 2012
Тема I. СТРОЕНИЕ АТОМА
Задание 1.1. Для приведенных в варианте (табл. I.1) 4-х химических элементов определить:
А) группу и период, в которых находится данный элемент в периодической таблице Д.И. Менделеева. Сколько протонов и нейтронов у данного атома?
Б) электронную формулу атома элемента, валентные электроны и указать, к какому семейству относится данный элемент;
В) электронную конфигурацию атома в возбуждённом состоянии, перечислить все теоретически возможные степени окисления для нормального и возбужденного состояния атома и привести примеры соединений, в которых данный элемент имеет разные степени окисления;
Г) набор четырёх квантовых чисел для последнего электрона атома;
Д) как изменяются радиус атома, энергия ионизации, электроотрицательность, окислительные и восстановительные свойства по периодам и группам таблицы Д.И. Менделеева.
Пример решения 1.1
Элемент 34Se (Селен)
А) Исходя из положения данного элемента в таблице Д.И. Менделеева определяем, что селен, имеющий порядковый номер 34, находится в 4 периоде и VI A группе.
Число протонов (p+) равно порядковому номеру элемента в таблице Д.И. Менделеева. Число нейтронов рассчитывается по формуле:
n0 = Ar- p+.
Для селена: число протонов- p+ = 34,
Число нейтронов - n
0 = 79- 34=45.
Б). Чтобы записать электронную формулу атома селена воспользуемся общей формулой распределения электронов по энергетическим уровням и подуровням:
1s22s22p63s23p64s23d104p65s24d105p66s25d14f145d2-106p67s26d15f146d2-10 ...
Записываем электронную формулу, валентные электроны и определяем, к какому семейству относится данный элемент.
Электронная формула селена: 34Se 1s22s22p63s23p64s23d104p4.
Валентные электроны находятся на 4-м энергетическом уровне: 4s24p4. Так как последний электрон на р-подуровне, то селен относится к элементам р-семейства.
В) Чтобы записать степени окисления элемента, нужно иметь ввиду, что степень окисления – это условный заряд атома в соединении, указывающий сколько электронов оттянуто или притянуто к атому элемента. Все металлы способны только отдавать электроны, они находятся слева от границы Цинтля, проходящей по линии, соединяющей элементы 5В и 85At. Отдавая электроны, атом элемента приобретает положительный заряд. Все металлы являются восстановителями.
Справа от границы Цинтля находятся элементы, которые являются окислителями. Самый электроотрицательный элемент – 9F. Это самый сильный окислитель. Фтор способен только принимать электроны и, кроме степени окисления, равной "0" (в соединении F2) может иметь степень окисления (-1).
Остальные элементы, расположенные между границей Цинтля и фтором, несмотря на преимущественные окислительные свойства могут как отдавать, так и принимать электроны и имеют степени окисления как со знаком "+", так и со знаком "-" в зависимости от атома элемента, вступающего с ним в связь. Знаки при степенях окисления показаны на схеме.
Чтобы определить степени окисления селена записываем валентные электроны для селена в нормальном состоянии.
34Se
4р
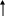
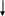
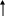
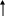
4s
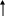
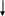
Селен может не только принимать, но и отдавать электроны.
Учитывая число "посадочных мест", определяем, что селен может принять 1 или 2 электрона, а имея в виду, что неспаренных электронов также 2, делаем вывод, что селен может отдать 1 или 2 электрона. Селен в нормальном состоянии имеет следующие степени окисления: –2, –1, 0, +1, +2, устойчивыми из них являются –2, 0, +2.
Далее записываем валентные электроны для селена в возбужденном состоянии. При получении дополнительной энергии происходит распаривание неподеленных пар электронов. Электроны переходят в более высокое энергетическое состояние. Следует отметить, что переход электронов происходит только в пределах внешнего уровня, в данном случае четвертого.
4d
4p
4s
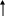
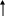
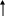
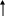
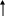


3
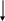 4Se*
4Se*В возбужденном состоянии увеличиваются возможности селена к отдаче электронов, поэтому теоретически возможные степени окисления Se в возбужденном состоянии атома следующие: -2, -1, 0, +1, +2, +3, +4, +5, +6. Однако устойчивыми степенями окисления являются: - 2, 0, +2, +4, +6.
Приведем примеры соединений, в которых селен имеет различные степени окисления (табл. 1.1). В случае затруднений при ответе на данный вопрос следует воспользоваться учебниками по химии для ВУЗов.
Таблица 1.1
| Степень окисления | Формула соединения | Название |
| 0 | Se | Селен |
| 2- | H2Se | Селенистый водород |
| 4+ | H2SeO3 | Селенистая кислота |
| 6+ | H2SeO4 | Селеновая кислота |
Г

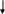
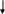
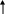
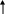
4p
 ) Определим последний электрон атома селена:
) Определим последний электрон атома селена: 
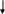
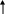
4s
-1 0 1 -ml
34Se
Набор квантовых чисел для данного электрона:
n=4, (электрон находится на 4 энергетическом уровне)
l=1 (электрон находится на p- подуровне, значит у него p-орбиталь)
ml=1
s=+1/2
Д) В справочной литературе приводятся разные выражения для радиуса атома (металлический, орбитальный, эффективный и др.). За эффективный радиус атома принимают половину расстояния между ядрами атомов, связанных в молекулу в ее устойчивом состоянии.
Энергия ионизации, I (эВ/атом) – это энергия, которая необходима, чтобы оторвать от невозбуждённого атома один электрон. Энергия ионизации выражается в размерности энергии кДж/моль.
Э0 – 1e- →Э+, процесс окисление
восстановитель ион
Энергия сродства к электрону,F,(кДж/моль) – энергетический эффект присоединения электрона к нейтральному атому или иону.
Э0 + 1e- →Э-, процесс восстановление
Окислитель ион
Электроотрицательность, (Э.О.) - способность атома принимать электроны.
Рассмотрим изменение свойств атомов элементов по периоду слева направо:
1) заряд ядра и суммарный заряд электронов увеличиваются – сила притяжения между ядром и электронами возрастает;
2) число энергетических уровней остается постоянным;
3) у элементов больших периодов заполняется d-подуровень (а начиная с 6 периода и f-подуровень) – действует эффект d- и f-сжатия.
В конечном итоге: сила притяжения между ядром и электронами возрастает, радиус атома уменьшается, энергия ионизации увеличивается, восстановительная активность снижается, усиливаются окислительные свойства и электроотрицательность.
Рассмотрим изменение свойств атомов s- и p-элементов (по группам сверху вниз):
1) заряд ядра и суммарный заряд электронов возрастают;
2) число энергетических уровней увеличивается, электроны уда-ляются от ядра, и сила притяжения уменьшается;
3) d- и f-сжатие действует слабо, так как эти электроны остаются во внутренних оболочках.
Таким образом по группе сверху вниз: радиус атома увеличивается; энергия ионизации уменьшается, восстановительная активность возрастает, а окислительные свойства и электроотрицательность уменьшаются.
Проанализируем изменение свойств атомов d-элементов по группе сверху вниз (правая часть d-семейства):
1) заряд ядра и суммарный заряд электронов возрастают;
2) число энергетических уровней увеличивается, но незначи-тельно;
3) очень сильно действует эффект d и f-cжатия, так как d- и f- подуровни все более близки к заполнению.
В результате – радиус атома уменьшается, энергия ионизации возрастает, восстановительная активность уменьшается, электроотрицательность также уменьшается.
Следует иметь в виду, что, если элемент находится в левой части d-семейства, эффект d- и f-сжатия действует слабо, так как на d- и f-подуровнях еще мало электронов. Поэтому сохраняются закономерности, характерные для изменения по группам свойств s- и p-элементов.
Данный элемент (селен) относится к семейству р-элементов. По периоду слева направо от калия до криптона сила взаимодействия между ядром и электронами увеличивается, радиус атома уменьшается, энергия ионизации возрастает, восстановительная активность уменьшается, электроотрицательность возрастает.
По группе сверху вниз от кислорода до полония сила взаимодействия между ядром и электронами возрастает, радиус атома уменьшается, восстановительная активность уменьшается, электроотрицательность уменьшается.
Таблица I.1
| Номер | Символы химических элементов | |||
| варианта | s- | p- | d- | f- |
| 1 | 87Fr | 5B | 80Hg | 71Lu |
| 2 | 88Ra | 6C | 79Au | 70Yb |
| 3 | 56Ba | 7N | 78Pt | 69Tm |
| 4 | 55Cs | 8O | 77Ir | 68Er |
| 5 | 38Sr | 9F | 76Os | 67Ho |
| 6 | 37Rb | 13Al | 75Re | 66Dy |
| 7 | 55Cs | 14Si | 74W | 65Tb |
| 8 | 56Ba | 15P | 73Ta | 64Gd |
| 9 | 87Fr | 16S | 72Hf | 63Eu |
| 10 | 88Ra | 17Cl | 57La | 62Sm |
| 11 | 56Ba | 31Ga | 89Ac | 61Pm |
| 12 | 55Cs | 32Ge | 104Rf | 60Nd |
| 13 | 87Fr | 33As | 105Db | 59Pr |
| 14 | 88Ra | 34Se | 106Sg | 58Ce |
| 15 | 20Ca | 35Br | 48Cd | 90Th |
| 16 | 4Be | 50Sn | 47Ag | 91Pa |
| 17 | 3Li | 51Sb | 46Pd | 92U |
| 18 | 38Sr | 52Te | 45Rh | 93Np |
| 19 | 20Ca | 53I | 44Ru | 94Pu |
| 20 | 37Rb | 49In | 43Tc | 95Am |
| 21 | 19K | 81Tl | 42Mo | 96Cm |
| 22 | 12Mg | 82Pb | 41Nb | 97Bk |
| 23 | 11Na | 83Bi | 40Zr | 98Cf |
| 24 | 4Be | 84Po | 39Y | 99Es |
| 25 | 3Li | 85At | 30Zn | 100Fm |
| 26 | 19K | 81Tl | 29Cu | 101Md |
| 27 | 20Ca | 82Pb | 28Ni | 102No |
| 28 | 11Na | 83Bi | 27Co | 103Lr |
| 29 | 12Mg | 84Po | 26Fe | 98Cf |
| 30 | 38Sr | 85At | 25Mn | 99Es |
Тема II. ХИМИЧЕСКАЯ СВЯЗЬ
Задание 2.1. Для указанных по варианту молекул (табл. II.1), с позиций метода валентных связей показать образование молекул, дать характеристику связям и молекуле.
Пример решения 2.1
Алгоритм характеристики химических связей и молекул.
Характеристика связи:
-
Определить сколько связей. Атомы каких элементов образуют связи? -
Определить перекрыванием каких орбиталей образована связь? Какова связь по положению? -
На основании данных об относительной электроотрицательности определить какова полярность связи.
Характеристика молекулы:
-
Определить какова форма молекулы? -
Определить каков валентный угол? -
Определить электрический момент диполя молекулы μм, который равен векторной сумме электрических моментов диполей связи, имеющихся в молекуле. Сделать заключение о полярности молекулы. Если суммарный момент диполя молекулы равен нулю (молекула симметрична), то молекула неполярная, если суммарный момента диполя молекулы не равен нулю (молекула не симметрична), то молекула полярная.
Примеры характеристик химических связей и молекул.
Молекула BeH2.(Рис. 1).
Характеристика связей:
-
2 Be-H -
s-sp-σ – связь -
ОЭО(Be) =1,47 ; ОЭО (H) = 2,1, следовательно сдвиг электронной плотности происходит в сторону атома H, и связь полярная.
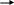 Beδ+ Hδ-.
Beδ+ Hδ-.Характеристика молекулы:
-
Форма молекулы: линейная. -
Валентный угол: 1800 . -
Молекула неполярная, т.к. μм = 0.
Молекула BH3.(Рис. 2).
Характеристика связей:
-
3 B-H -
s-sp2-σ – связь -
ОЭО(B) =2,01 ; ОЭО (H) = 2,1, следовательно сдвиг электронной плотности происходит в сторону атома H, и связь полярная.
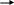 Bδ+ Hδ-.
Bδ+ Hδ-.Характеристика молекулы:
-
Форма молекулы: плоский треугольник. -
Валентный угол: 1200 . -
Молекула неполярная, т.к. μм = 0.
Молекула CH4.(Рис. 3).
Характеристика связей:
-
4 C-H -
s-sp3-σ – связь -
ОЭО(C) =2.50 ; ОЭО (H) = 2,1, следовательно сдвиг электронной плотности происходит в сторону атома C, и связь полярная.
 Cδ- Hδ+.
Cδ- Hδ+.Характеристика молекулы:
-
Форма молекулы: тетраэдр. -
Валентный угол: 1090 . -
Молекула неполярная, т.к. μм = 0.
Молекула NH3.(Рис. 4).
Характеристика связей:
-
3 N-H -
s-sp3-σ – связь -
ОЭО(N) =3,07 ; ОЭО (H) = 2,1, следовательно сдвиг электронной плотности происходит в сторону атома N, и связь полярная.
 Nδ- Hδ+.
Nδ- Hδ+.Характеристика молекулы:
-
Форма молекулы: пирамида. -
Валентный угол: 1070 . (В атоме N есть неподелённая электронная пара, поэтому валентный угол уменьшается со 1090 до 1070.) -
Молекула полярная, т.к. в атоме N есть неподелённая электронная пара.
Молекула H2O.(Рис. 5).
Характеристика связей:
-
2 O-H -
s-sp3-σ – связь -
ОЭО(O) =3,50 ; ОЭО (H) = 2,1, следовательно сдвиг электронной плотности происходит в сторону атома O, и связь полярная.
 Oδ- Hδ+.
Oδ- Hδ+.Характеристика молекулы:
-
Форма молекулы: угловая.Валентный угол: 1040 . (В атоме O есть 2 неподелённые электронные пары, поэтому валентный угол уменьшается со 1090 до 1040.) -
Молекула полярная, т.к. в атоме О есть неподелённые электронные пары.
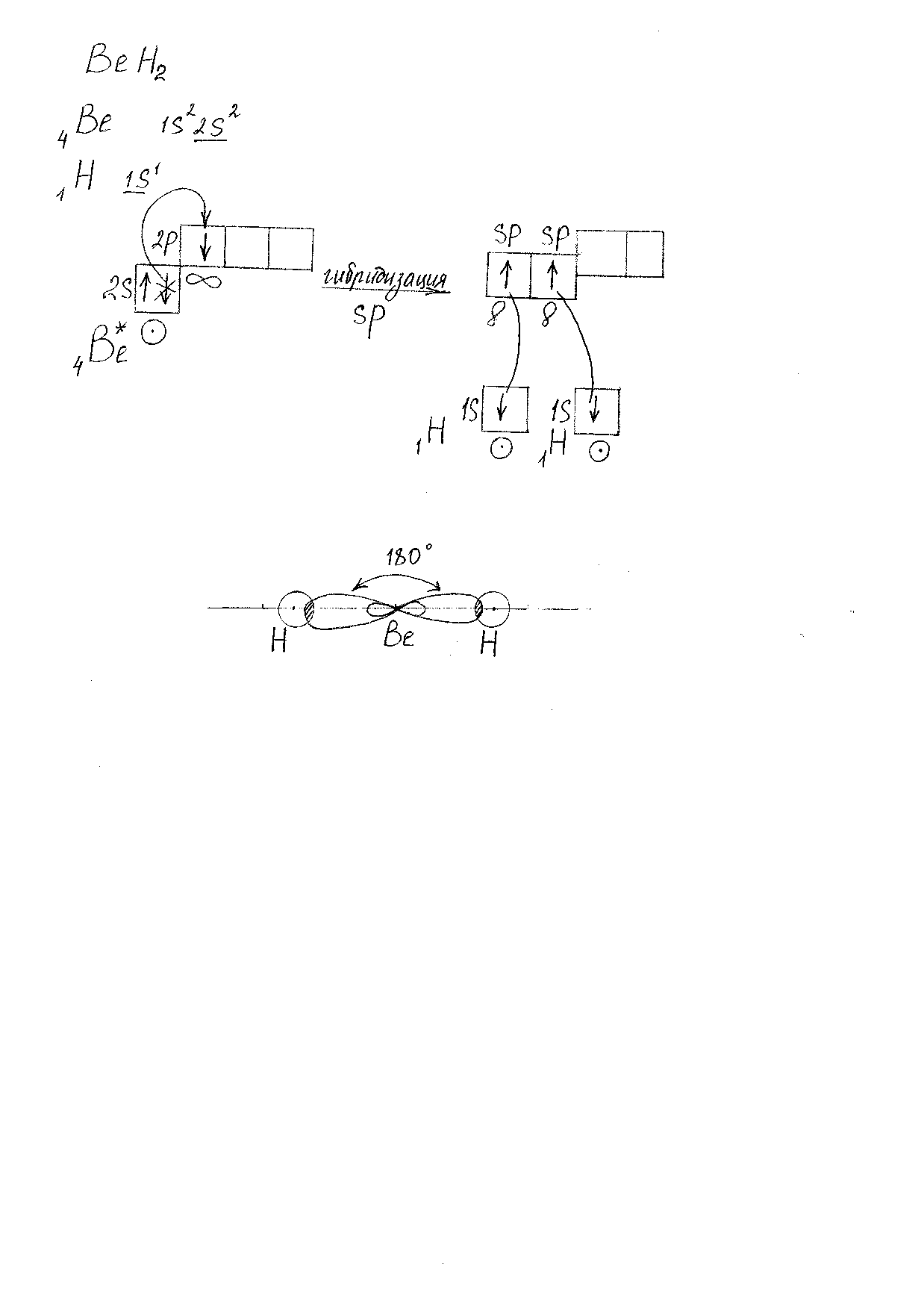
Рис. 1. Модель молекулы BeH2.
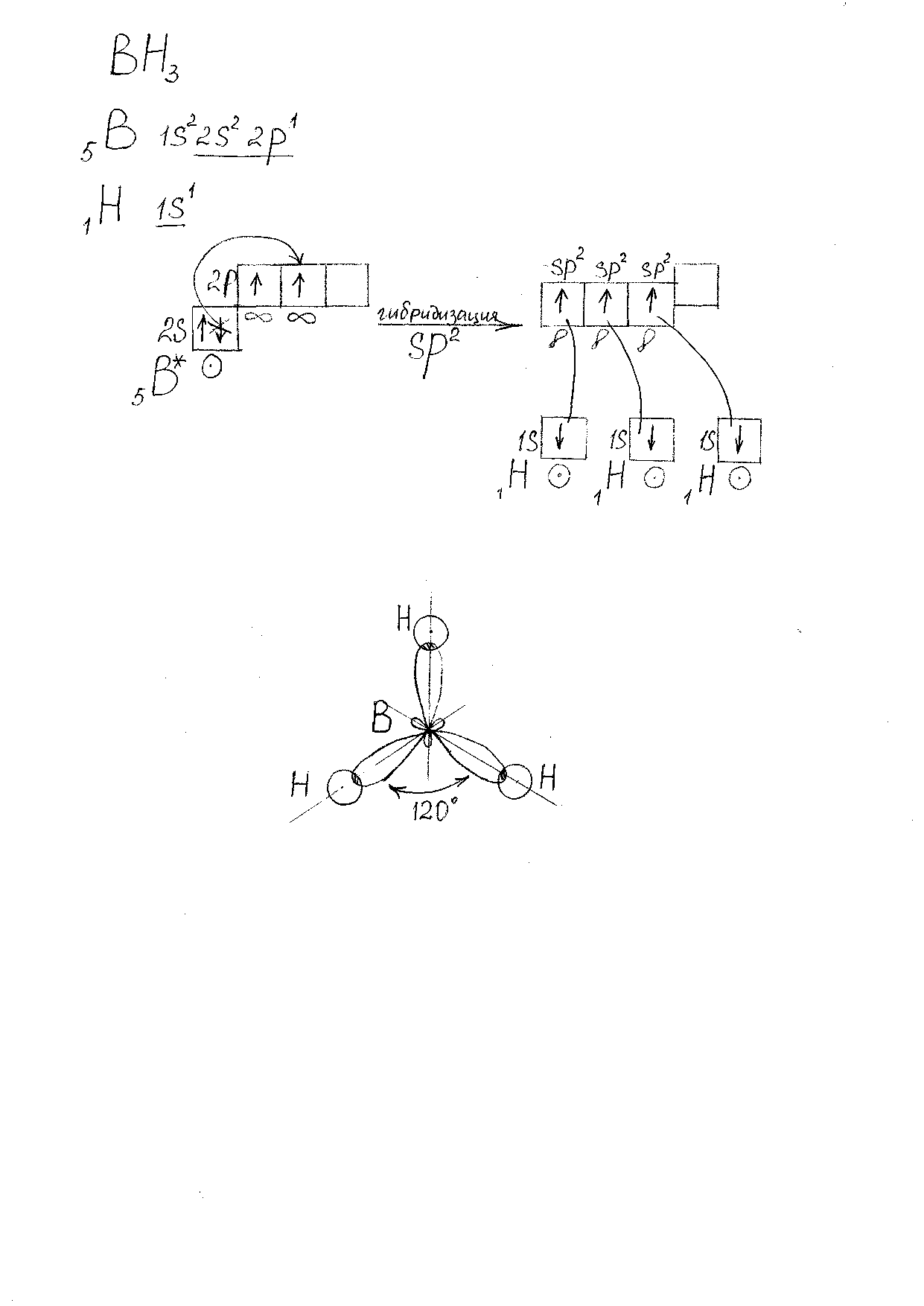
Рис. 2. Модель молекулы BH3.
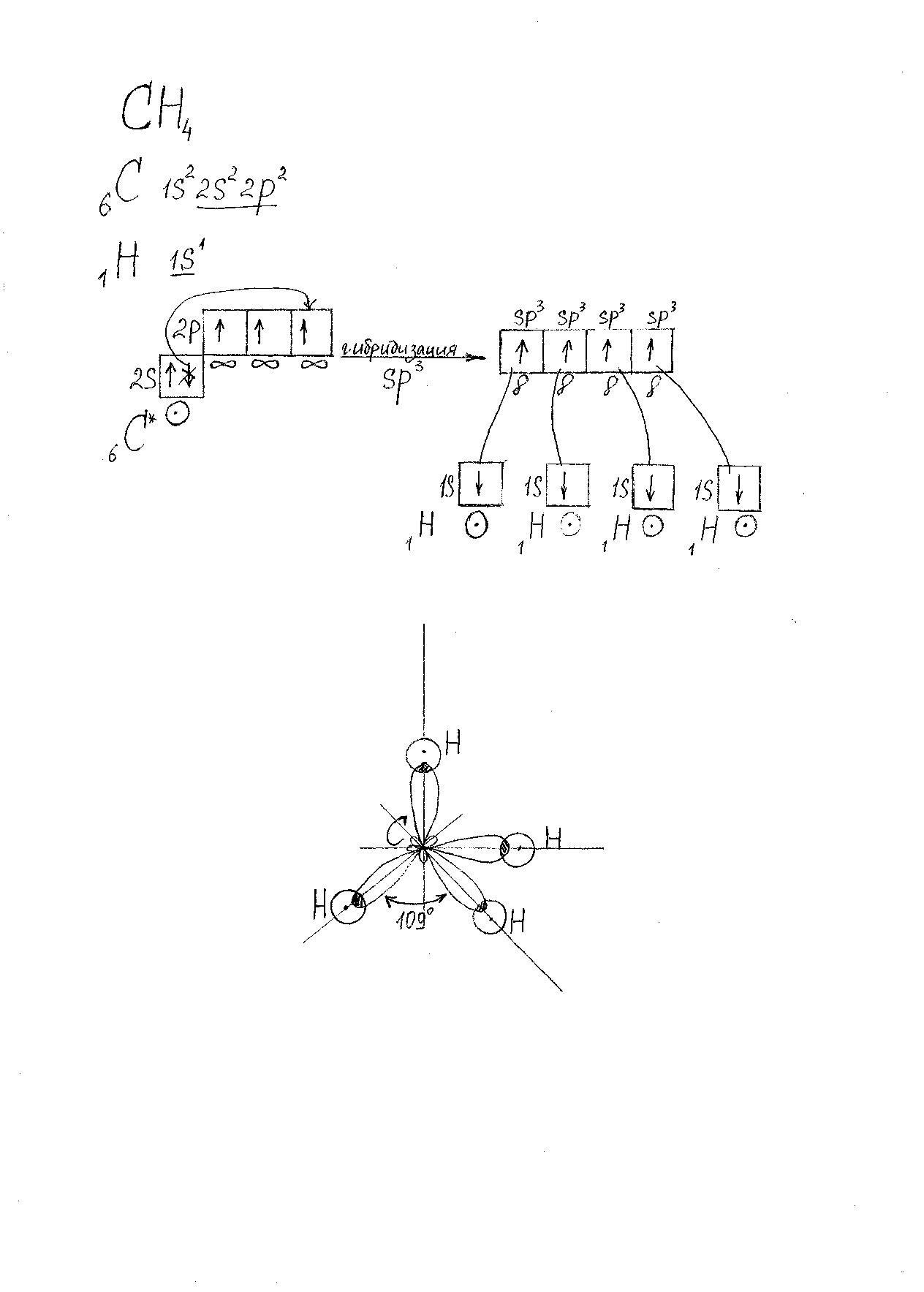
Рис. 3. Модель молекулы CH4.
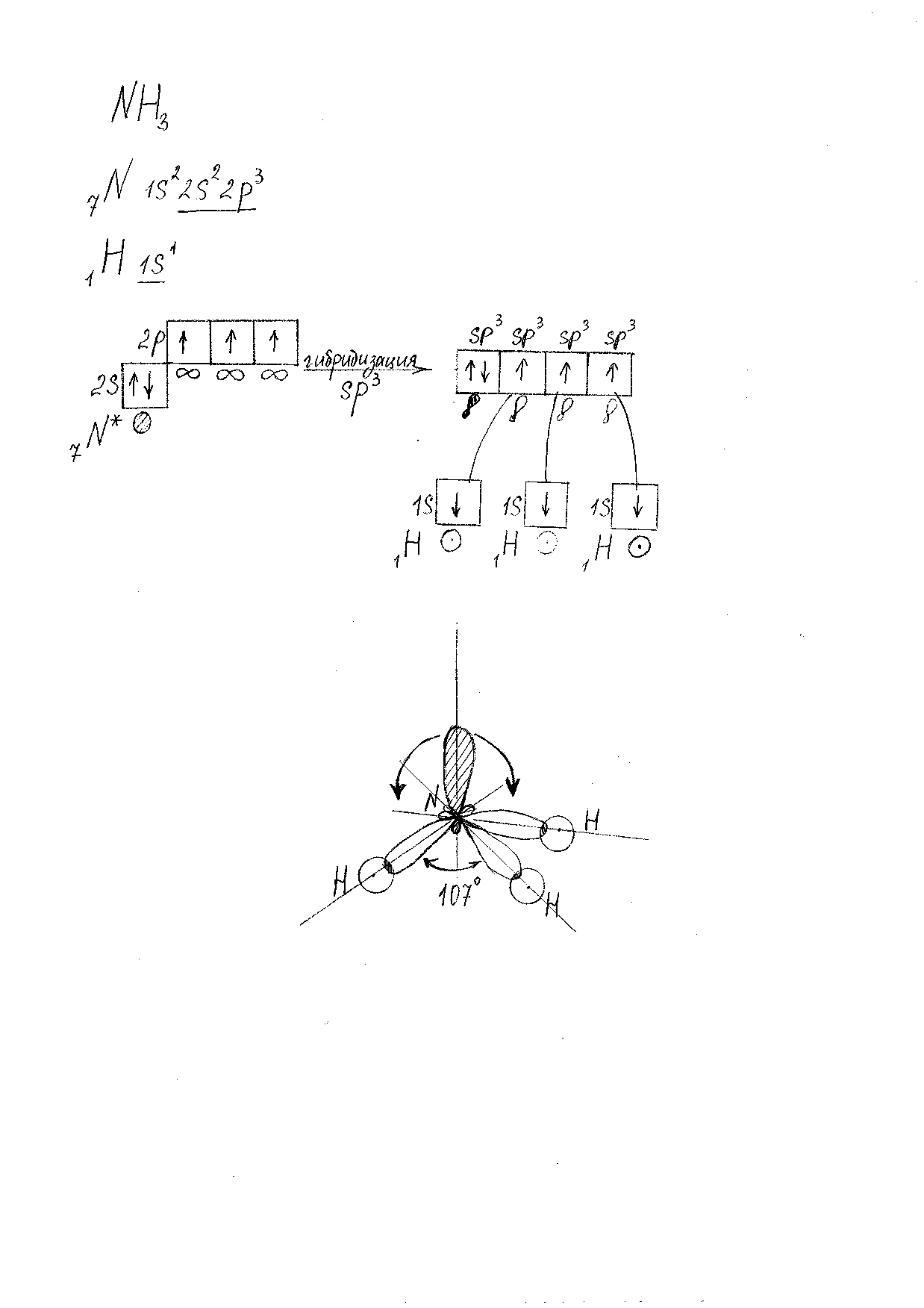
Рис. 4. Модель молекулы NH3.
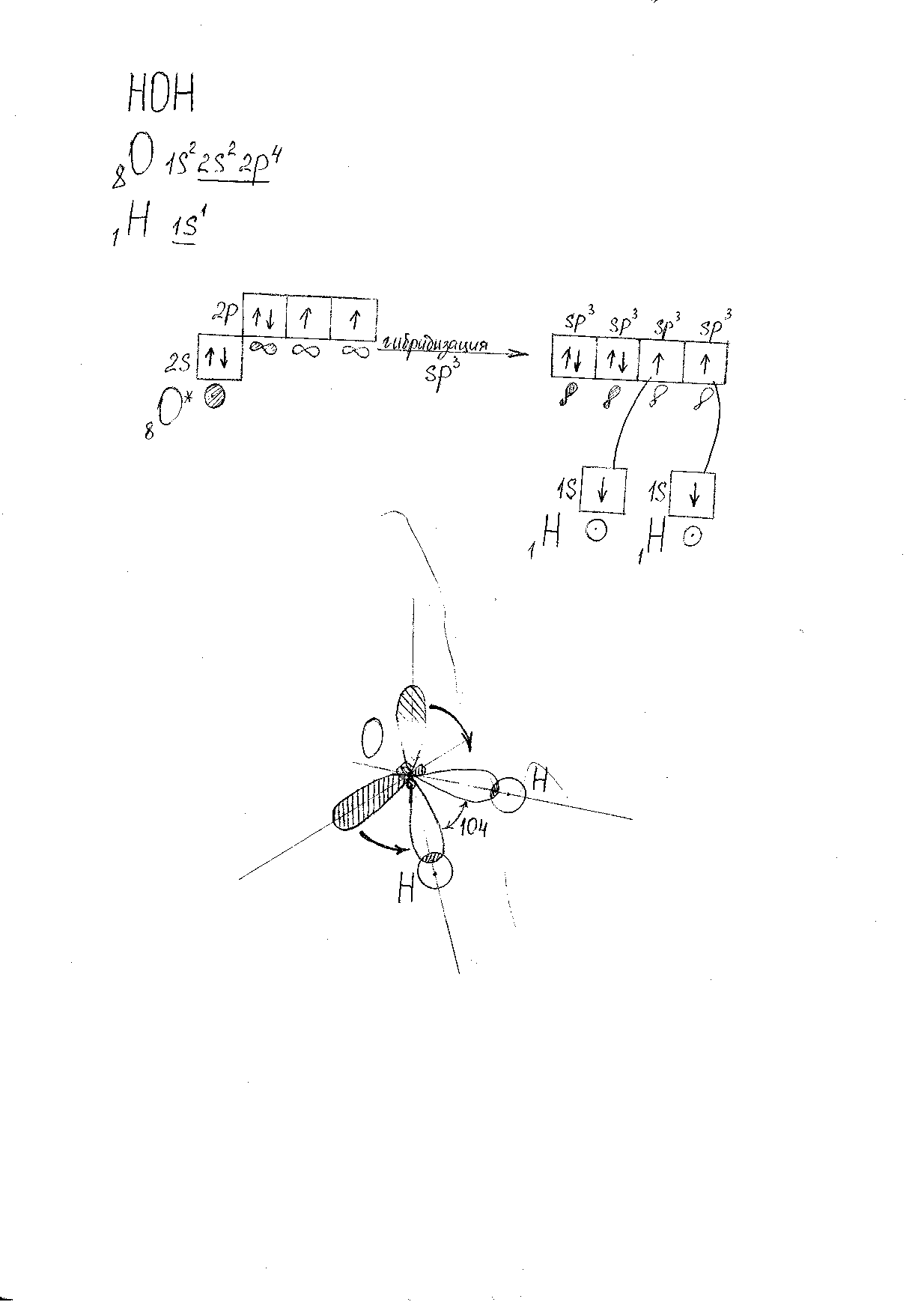
Рис. 5. Модель молекулы H2O.
Задание 2.2. Для двух приведенных комплексных соединений (табл. II. 3): определить степени окисления всех составляющих и указать комплексообразователь, лиганды, ионы внешней и внутренней сферы и координационное число.
Записать уравнение диссоциации комплексного соединения.
Пример решения 2.2
Решение данного задания рассмотрим на примере 2-х комплексных соединений: Na[Co(SCN)4(H2O)2] и [Fe(NH3)5(NO2)]Cl2.
Сначала проанализируем состав комплексного соединения. В комплексном соединении содержится сложный комплексный ион, который показан в квадратных скобках. Комплексный ион состоит из комплексообразователя и лигандов. Комплексообразователь записывается первым в квадратной скобке, а далее следуют лиганды. Лигандами могут быть как заряженные частицы: I
Комплексообразователь и лиганды связаны прочной ковалентной связью донорно-акцепторного типа. Комплексный ион является ионом внутренней сферы. Снаружи располагаются ионы внешней сферы. Ионы внешней и внутренней сферы связаны ионной связью.
Если сложный комплексный ион заряжен отрицательно, т.е. является анионом, то ион внешней сферы записывается слева, и комплекс называется анионным. Если комплексный ион заряжен положительно, т.е. представляет из себя катионный комплекс, то ион внешней сферы записывается справа. В некоторых соединениях ионы внешней сферы отсутствуют, тогда внутренняя сфера имеет нулевой заряд, такие комплексы называются нейтральными.
Учитывая степень окисления комплексных ионов (в первом соединении – [Co(SCN)4(H2O)2]1-, а во втором – [Fe(NH3)5NO2]2+, определяем, что первое соединение содержит анионный, а второе – катионный комплекс. Вокруг комплексообразователя Со