Файл: 11 Общие сведения о комплексных соединениях 11 Состав комплексных соединений.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.01.2024
Просмотров: 127
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
11 Общие сведения о комплексных соединениях
11.1. Состав комплексных соединений
Многие «простые» соединения (оксиды, гидроксиды, соли и т. д.) могут «объединяться» с другими соединениями в более сложные вещества. Так, молекулы воды, аммиака и монооксида углерода, гидроксид-ионы и другие анионы могут взаимодействовать с катионами металлов или другими частицами, образуя комплексные (координационные) молекулы или ионы (их также часто называют просто комплексами). Термин «комплексные соединения» ввел немецкий химик Оствальд; в русскоязычной литературе его впервые употребил Кистяковский1, который после окончания Петербургского университета работал в лаборатории Оствальда.
Реакции получения комплексных соединений похожи на реакции образования «простых» соединений, например:
SO3 + K2O = K2SO4 (простая соль)
Zn(OH)2 + 2KOH = K2[Zn(OH)4] (комплексная соль)
Первым синтезом комплексного соединения принято считать получение в 1798 г. кристаллов хлорида гексаамминкобальта(III) [Co(NH3)6]Cl3. Химики в то время еще ничего не знали о строении полученного вещества и описали его состав привычной формулой CoCl3 ⋅ 6NH3.
Лишь спустя столетие швейцарский химик Вернер2 разработал координационную теорию строения комплексных соединений, которая используется до сих пор. В составе комплексов Вернер выделил две координационные сферы: внутреннюю и внешнюю. Во внутренней сфере находятся частицы, связанные между собой ковалентными связями. При записи химической формулы внутреннюю сферу комплекса заключают в квадратные скобки. Это может быть нейтральная частица, например [Cr(CO)6], анион, например K4[Fe(CN)6], или катион, например [Ni(NH3)6]Cl2. Ионы внешней сферы связаны с внутренней ионными связями. Соединение может также состоять из двух комплексных ионов (катиона и аниона), например [Cu(NH3)4][PtCl6]. В этом случае каждый из ионов считают внешнесферным по отношению к другому.
11.1. Состав комплексных соединений
Соединения, которые содержат комплексный ион, в водном растворе необратимо диссоциируют на внутри- и внешнесферные ионы, например:
[Pt(NH3)4]Cl2 = [Pt(NH3)4]2 + 2Cl–
Если в составе внешней сферы присутствуют катионы водорода или гидроксид-ионы, среда (раствор) становится кислой или щелочной:
[Zn(NH3)4](OH)2 = [Zn(NH3)4]2 + 2OH–
H[BF4] + H2O = [BF4]– + H3O
В каждом комплексе независимо от его заряда содержится частица (атом, ион или молекула), которая координирует (располагает) вокруг себя другие ионы или молекулы. Такую частицу называют комплексообразователем.
Часто комплексообразователем служит катион, например ион железа(II) в комплексе [Fe(CN)6]4–. Нередко комплексообразователь не имеет заряда, например атом хрома в [Cr(CO)6] или молекула иода в [I2(I3)2]2–. Комплексообразователями могут быть также анионы (в том числе анионы металлов), например [Mn(CO)5]–. Часто частицу-комплексообразователь (атом или одноатомный ион) называют центральным атомом.
Частицы, которые располагаются вокруг комплексообразователя, назвали лигандами (от лат. ligare — связывать) или аддендами (от лат. addendum — дополнение, приложение). Лигандами могут быть нейтральные молекулы (например, CO), катионы (часто H) или анионы (гидроксид-ион OH–, кислотные остатки неорганических и органических кислот). В качестве лигандов могут выступать и сложные органические молекулы.
В одном комплексе может быть несколько разных лигандов.
Число связей комплексообразователя с лигандами называют его координационным числом (КЧ). Известны комплексные соединения с числом связей от 2 до 12; чаще же КЧ = 6 или 4, другие координационные числа встречаются реже.
Координационное число комплексообразователя не всегда совпадает с числом лигандов, так как у одного лиганда может быть несколько связей с комплексообразователем. Например, в молекуле [Zn(NH2CH2COO)2] число лигандов 2, но координационное число цинка 4 (рис. 11.1). Количество связей, которое может образовать лиганд, называется его дентатностью (от лат. dente — зуб). Большинство лигандов может образовать с комплексообразователем только одну связь; такие лиганды называют монодентатными. Приведенный на рис. 11.1 глицинат-ион NH2CH2COO–
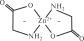
Рис. 11.1. Структурная формула комплекса [Zn(NH2CH2COO)2]
образует связи через атом кислорода и атом азота
; это бидентатный лиганд, поэтому в комплексе [Zn(NH2CH2COO)2] число лигандов вдвое меньше, чем координационное число комплексообразователя. Бывают и другие полидентатные лиганды: три-, тетра-, гексадентатные.
Когда полидентатный лиганд образует несколько связей с комплексообразователем, чаще всего формируются замкнутые циклы. Эти циклы называют хелатными, а комплексы, которые их содержат, — хелатами (от греч. хеле — клешня). Наибольшей устойчивостью обладают пятичленные хелатные циклы; чуть менее устойчивы шестичленные хелаты. Остальные циклы заметно уступают им по прочности.
Некоторые лиганды могут образовывать связи (координироваться) через разные атомы. Например, тиоцианат-ион NCS– в одних комплексах координируется через атом азота, а в других — через атом серы. Нитритион NO2− может связываться как через атом азота, так и через атом кислорода. Такие лиганды называют амбидентатными.
Полидентатный лиганд может образовать связи одновременно с разными комплексообразователями. При этом соединять атомы комплексообразователей могут и такие лиганды, которые не способны образовывать хелаты, например галогенид- или гидроксид-ионы. Лиганды, соединяющие несколько комплексообразователей, называют мостиковыми.
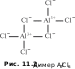
Комплекс, который содержит один центральный атом (одно «ядро»), называют одноядерным (моноядерным). Если во внутренней сфере комплексного соединения находится несколько комплексообразователей, окруженных лигандами, говорят, что комплекс — многоядерный (полиядерный). Например, димер хлорида алюминия Al2Cl6 можно считать биядерным комплексом, в котором два мостиковых атома хлора соединяют ковалентными связями два атома алюминия (рис. 11.2). Остальные атомы хлора, также образующие ковалентные связи с атомами алюминия, называются концевыми.
Полиядерные комплексы с несколькими комплексообразователями во внутренней сфере могут возникнуть также в результате связывания атомов комплексообразователя; связь между этими атомами может быть одинарной, как в [(CO)5Mn—Mn(CO)5], двойной, тройной и даже четверной. Соединения, содержащие связи металл—металл, назвали кластерами (от англ.cluster — кисть, гроздь).
11.2. Номенклатура комплексных соединений
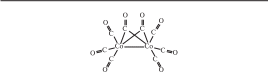
Рис. 11.3.
Структурная формула [Co2(CO)8] с мостиковыми лигандами CO
Встречаются также смешанные комплексы, содержащие одновременно и мостиковые лиганды, и связи металл—металл (рис. 11.3).
Вопросы
11.1. Какова формула соединения с комплексообразователем СоIII (КЧ = 6), при котором лиганды — хлорид-ионы и две молекулы аммиака, а во внешней сфере — катионы калия?
11.2. Назовите составные части комплексного соединения K3[Fe(CN)6]; укажите координационное число центрального атома, определите заряды комплексообразователя и комплексного иона в целом.
11.3. Определите внешнюю и внутреннюю сферу следующих комплексных соединений, их общий заряд и заряд их центрального атома: а) K2[PtCl6]; б) [Cu(NH3)4]SO4; в) K3[FeF6]; г) [Сr(H2O)6]Cl3.