Файл: 11 Общие сведения о комплексных соединениях 11 Состав комплексных соединений.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.01.2024
Просмотров: 130
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Вопросы
11.6. Проведите классификацию следующих комплексных соединений тремя способами: а) Na3[Cr(OH)6]; б) H[AuCl4]; в) [Cu(NH3)4](ОН)2. 11.7. Какие виды комплексных соединений термически наименее устойчивы?
11.3.2. Комплексы с органическими лигандами
Лиганды органической природы очень разнообразны, поэтому классификация комплексов с органическими лигандами весьма сложная.
В роли лигандов часто выступают соединения состава RnЭ, где R — углеводородный радикал, Э — атом элемента 15- или 16-й группы Периодической системы. Известны комплексы, например, с аминами, арсинами, фосфинами, стибинами, простыми эфирами, тиолами, селено- и теллуроуглеводородами.
Лиганды типа RnЭ Х (Э — элемент 14–16-й группы, R — углеводородный радикал, насыщенный или ароматический) — это альдегиды и кетоны, органические оксиды (Э = N, P, As, Sb; X = O; n = 3), сульфоксиды (Э = S; Х = О; n = 2) и их аналоги (Х = S, Se, Te). Можно отметить, что, несмотря на наличие двух атомов, способных быть донорами (связываться с комплексообразователем, предоставляя орбиталь с неподеленной парой

Рис. 11.4. Структурная формула комплекса никеля с диметилглиоксимом [Ni(dmg)2]. Диметилглиоксим часто обозначают gmg
электронов), фосфиноксиды монодентатны во всех комплексах, а сульфоксиды могут проявлять свойства бидентатных лигандов. Мочевина CO(NH2)2, тиомочевина CS(NH2)2 и их селенcодержащий аналог относятся к X-донорам. Однако известны комплексы, в которых эти лиганды образуют связи через атомы азота. Аналогичное поведение обнаружено и для других лигандов, содержащих двойная связь С Х: амидов, тиоамидов, семитиокарбазидов, селенокарбазидов и карбазонов.
В качестве органических лигандов совсем не редко встречаются и гетероциклические соединения, содержащие один или несколько гетероатомов. Донорными атомами в них обычно служат элементы 15- и 16-й групп Периодической системы.
Особый класс комплексных соединений с органическими лигандами — хелатные комплексы, в которых би- или полидентатные лиганды образуют с центральными ионом замкнутые циклы. Хелатные комплексы очень устойчивы. Один из примеров хелатного комплекса — розово-красный комплекс никеля с диметилглиоксимом C4N2H6(OH)2 (рис. 11.4). Этот комплекс используется при качественном и количественном анализе никеля в растворах. Впервые этот комплекс в аналитических целях применил русский ученый Чугаев
4. Он установил, что комплексные соединения, содержащие циклические группировки, отличаются бо[льшей прочностью, чем комплексы, не содержащие циклов; при этом наиболее устойчивы комплексы с пяти- и шестичленными циклами.
Среди хелатных комплексных соединений особое место занимают комплексы с полигетеромакроциклическими лигандами, такими как порфин (рис. 11.5) и его производные — порфирины. Порфириновые комплексы входят в состав небелковой части молекулы гемоглобина (рис. 11.6), в молекулы хлорофилла и ряда ферментов.
Швейцарский химик Шварценбах5 в 1945 г. ввел термин «комплексоны» для обозначения полидентатных органических лигандов группы полиами-

Рис. 11.5. Структурная формула порфина
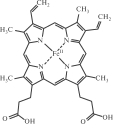
Рис. 11.6. Структурная формула гема (небелкового компонента гемоглобина)
нополикарбоновых кислот. Комплексные соединения этих лигандов называют комплексонатами. Самый известный комплексон — этилендиаминтетрауксусная кислота, сокращенно edtaH4 или ЭДТА (рис. 11.7):
(HOOCCH2)2N(C2H2)2N(CH2COOH)2
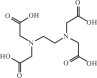
Рис. 11.7. Структурная формула этилендиаминтетрауксусной кислоты (ЭДТА)
Комплексонаты большинства металлов очень устойчивы, поскольку при образовании этих комплексов замыкаются два, три или более хелатных цикла (металлоцикла), как, например, в комплексе меди(II) с анионом этилендиаминтетраацетатом (рис. 11.8). Чаще всего ЭДТА используется в виде дигидрата динатриевой соли (комплексон III, трилон Б или ЭДТАNa2). ЭДТА позволяет определить более 60 элементов. В медицине ЭДТА используют для выведения из организма радиоактивных и токсичных металлов. Этот реактив нашел широкое применение в текстильной, кожевенной, бумажной и лакокрасочной промышленности, в металлургии, в цветной кинематографии, для смягчения воды и т. д.
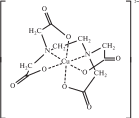
Рис. 11.8. Структурная формула комплекса меди(II) с анионом этилендиаминтетрауксусной кислоты
Ненасыщенные органические молекулы, например этилен, циклопентадиен, бензол и его производные, могут образовывать так называемые π-комплексы. В этих комплексах связь металла с органическим лигандом осуществляется при взаимодействии заполненных π-орбиталей лиганда с вакантными орбиталями металла (донорно-акцепторный механизм), при этом электроны с орбиталей металла попадают на низшие вакантные орбитали лиганда (дативный механизм). В π-комплексах металл может взаимодействовать со всеми атомами углерода π-электронной системы или только с некоторыми из них. Стехиометрия большинства π-комплексов подчиняется правилу Сиджвика. Химические свойства этих соединений зависят главным образом от природы лиганда и в меньшей степени от природы центрального атома металла, причем возможны реакции как с сохранением связи металл – лиганд (частичным или полным), так и с ее разрывом.
Самый известный π-комплекс — ферроцен [Fe(C5H5)2] (или, согласно правилам номенклатуры, бис(циклоп ентад иенил)железо). Циклопентадиен С5H6 содержит две двойные связи и проявляет слабые кислотные свойства. При взаимодействии циклопентадиена с металлическим натрием образуется ионное соединение циклопентадиенилнатрий:
2Na + 2С5H6 = 2Na(C5H5) + H2↑
При взаимодействии циклопентадиенилнатрия с катионами железа(II) в тетрагидрофуране выделяются оранжевые кристаллы бис(циклопент адиенил)железа:
FeCl2 + 2Na(C5H5) = [Fe(C5H5)2] + 2NaCl
Строение этого соединения напоминает сэндвич (бутерброд) (рис. 11.9). Комплекс диамагнитен, а комплексообразователь Fe(II) находится между циклическими анионами С Н5 5− на равном расстоянии от всех атомов углерода. В бис(циклопентадиенил)железе невозможно выделить отдельные ковалентные связи между комплексообразователем и атомами лиганда: центральный атом образует связь со всей π-электронной системой каждого из двух лигандов. В ферроцене функцию донора электронов выполняют два циклопентадиенил-иона — каждый предоставляет по три пары π-электронов. Акцепторами электронных пар служат sp3d2-гибридные орбитали железа(II). В этой сэндвичевой структуре шесть многоцентровых связей, которые дополнительно упрочняются по дативному механизму (посредством передачи лигандам электронных пар атома железа). Таким образом, для обозначения двухэлектронных связей валентные черточки теряют обычный смысл.

Рис. 11.9. Строение ферроцена
Вопросы
11.8. Для определения никеля Чугаев использовал аммиачный раствор диметилглиоксима (позже его назвали реактивом Чугаева). Какова здесь роль аммиака?
11.9. Какова дентатность лиганда ЭДТА?
11.4. Химическая связь в комплексных соединениях
11.4.1. Метод валентных связей
Попытки объяснить образование новых более сложных соединений — комплексных соединений — взаимодействием некоторых вполне устойчивых молекул с различными атомами и ионами, например молекулы аммиака с катионом кобальта, молекулы монооксида углерода с атомами железа, кобальта, никеля и т. п., имеют давнюю историю. Для этого было предложено много теорий. В настоящее время общепринята точка зрения, что в специальной теории координационной связи нет необходимости. Однако применение к комплексным соединениям общих представлений о механизмах образования химической связи имеет некоторую специфику. Теория валентных связей была первой квантовомеханической теорией, использованной для приближенного объяснения образования связей в комплексных соединениях. Практическое применение этой теории было воплощено в методе валентных связей (ВС). В основе метода ВС лежит идея о донорно-акцепторном механизме образования ковалентных (координационных) связей между лигандом (донором электронной пары) и комплексообразователем (акцептором электронной пары). При перекрывании орбиталей лигандов, занятых неподеленными электронными парами, и свободных орбиталей комплексообразователя в межъядерном пространстве создается область повышенной электронной плотности. Электронные пары комплексообразователя при этом взаимодействуют с вакантными атомными орбиталями лиганда, упрочняя связь по дативному механизму.
В отличие от соединений s- и р-элементов, где в гибридизации участвуют как связывающие, так и неподеленные электронные пары центрального атома, в комплексах d-элементов предполагается гибридизация только связывающих электронных пар, число которых соответствует координационному числу комплексообразователя.
Кроме того, в соединениях s- и р-элементов неспаренных электронов всегда не так уж много, а комплексы d-элементов нередко содержат значительное число неспаренных электронов. Часто (но далеко не всегда) происходит объединение неспаренных электронов комплексообразователя в пары, при этом некоторые атомные орбитали,
участвующие в гибридизации и образовании связей, остаются свободными.
Строение комплексов (как и более простых соединений) зависит от типа гибридизации s-, p- и d-орбиталей центрального атома, участвующих в образовании связей. Электронные пары, которые заселяют гибридные орбитали комплексообразователя, стремятся занять в пространстве такое положение, при котором минимально их взаимное отталкивание. Таким образом, структура комплексных молекул и ионов в значительной степени зависит от типа гибридизации орбиталей центрального атома.
При определении типа гибридизации орбиталей атома d-элемента нужно учитывать близость по энергии s-, p- и d-орбиталей одного слоя, а также d-оболочек предыдущего слоя:
E(n–1)d ≈ Ens ≈ Enp ≈ End
Таким образом, в гибридизации участвуют d-орбитали как последнего, так и предпоследнего слоев, поэтому геометрия (геометрическая конфигурация) комплексных частиц весьма разнообразна (табл. 11.1).
Таблица 11.1
Геометрическая конфигурация комплексов
| Тип гибридизации | КЧ комплексообразователя | Геометрия | Примеры |
| sp | 2 | Линейная молекула | [Ag(NH3)2] |
| sp2, d2s | 3 | Треугольник | [HgI3]– |
| sp3, d3s | 4 | Тетраэдр | [Zn(NH3)4]2 |
| dsp2 | 4 | Плоский квадрат | [Ni(CN)4]2– |
| sp3d, d3sp | 5 | Тригональная бипирамида | [Fe(CO)5] |
| dsp3, d2sp2, d4s | 5 | Квадратная пирамида | [Ni(CN)5]3– |
| d2sp3, dsp3d, sp3d2 | 6 | Октаэдр | [Cr(H2O)6]3 |
| d3pd3 | 7 | Пентагональная бипирамида | [ZrF7]3– |