Файл: Занятие (4часа) адсорбция на твердых сорбентах теоретическое пояснение.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 89
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
). Изотерма адсорции на жидкой поверхности зеркально обратна изотерме поверхностного натяжения, т.к. обе они характеризуют образование одного процесса − процесса образования мономолекулярного слоя адсорбированных молекул.
Поверхностное натяжение растворов определяют различными методами: капиллярного поднятия, сталагмометрический (метод счета капель), отрыва кольца от жидкости, определения наибольшого давления пузырьков (метод Ребиндера).
Из них прост и достаточно точен сталагмометрический метод. Он основан на том, что в момент отрыва под действием силы тяжести от конца капилляра капли жидкости, её вес практически равен силе поверхностного натяжения, приложенной к окружности капилляра. Для разбавленных растворов, плотность которых мало отличается от плотности воды, поверхностное натяжение можно вычислить по уравнению:
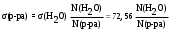 , мДж/м2.
, мДж/м2.
Поскольку адсорбция на поверхности жидкости подчиняется уравнению Ленгмюра, максимальную величину адсорбции (Гмах) можно определить расчетным или графическим методом (как котангенс угла наклона прямой на графике 1/Г = f(1/С), см. рис.4). По величине максимальной адсорбции можно рассчитать площадь поверхности, занятой одной молекулой в мономолекулярном слое, длину молекулы (она равна толщине монослоя).
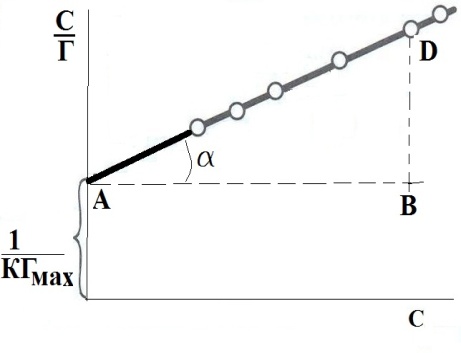
Рис.4. Определение констант в уравнении Лэнгмюра
Учитывая, что на поверхности площадью 1м2 в полностью заполненном мономолекулярном слое количество адсорбированного вещества равно Гмах , а число молекул на 1м2 равно NA. Гмакс, площадь, занимаемая одной молекулы равна:
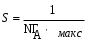 , м2.
, м2.
Для установления длины молекулы достаточно определить массу вещества, адсорбированного на 1м2 поверхности. Зная, что масса равна произведению обьема монослоя площадью 1м2 на плотность вещества (V.d), а обьем – произведению длины молекулы на площадь 1м2 (1l ) можно записать, что: m = l.d. Массу вещества в монослое площадью 1м2 можно определить как произведение максимальной величины адсорбции на молекулярную массу ПАВ, т.е. m = Г
макс.М(Х). Отсюда, приравнивая значения масс, можно установить длину молекулы ПАВ:
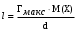 , м.
, м.
Оказывается площадь, занимаемая молекулами ПАВ гомологического ряда при плотном заполнении адсорбционного слоя, одинакова. Так, например, площадь, занимаемая молекулами жирных кислот равна 2,1.10−15 см2. Это связано тем, что, независимо от длины углеводородных радикалов, полярные группы молекул разных ПАВ одного гомологического ряда, имеют одинаковую ориентацию к поверхности. Длина же молекул ПАВ, оказалось разной. На одно звено –СН2− прирост толщины монослоя составляет 1,4.10−8 см.
Примеры решения задач
Пример 1.
Предельная адсорбция ПАВ некоторым адсорбентом составляет 0,005 моль/г. Вычислите массу адсорбированного ПАВ из раствора равновесной концентрацией 0,1 моль/л адсорбентом массой 2 г. Относительная молекулярная масса ПАВ равна 60, а константа равновесия 0,06 моль/л.
Решение:
Пример 2.
Определить адсорбцию масляной кислоты при 290 K, если для её растворов при концентрации 0,0103 кмоль/м3 значение поверхностного натяжения равно 65,45.10−3 Дж/м2, а при 0,0206 кмоль/м3 – 59,78.10−3 Дж/м2.
R =8,314.103Дж/(кмоль.К).
Решение:
Пример 3.
Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 2,6 и 0,6 мл. Вычислите величину адсорбции.
Решение:
Пример 4.
Величина предельной адсорбции бутанола составляет 7,69.10−6 моль/м2. Вычислите площадь, занимаемой одной молекулой и длину молекулы бутанола. Плотность бутанола равна 0,809 г/мл, молярная масса 74 г/моль.
Решение:
Вопросы и задачи для самоподготовки
ности раствора, если площадь поперечного сечения её молекул составляет 2,22.10-15 см2. Ответ: 7,48.10−10 моль/см2.
С, моль/л 0,0078 0,0156 0,03120 0,06250 0,1250 0,2500 0,5000
s, мДж/м2 69,6 68,0 65,1 61,5 56,2 49,7 41,5
Построить изотерму адсорбции Гиббса. s(Н2О) = 72,56 мДж/м2.
С, ммоль/л 2,16 3,96 6,6 8,3 9,3 9,8 10,2 11,2
s, мДж/м2 62 54 47 43 42 41 41 41
Построить изотерму адсорбции Гиббса. s(Н2О) = 72,56 мДж/м2.
если в медико-биологических исследованиях была установлена равновесная концентрация, равная 0,22 моль/л, а константы в уравнении Фрейндлиха: K = 0,1585; n = 0,5. Ответ: 7,67.10−3 моль/г.
Поверхностное натяжение растворов определяют различными методами: капиллярного поднятия, сталагмометрический (метод счета капель), отрыва кольца от жидкости, определения наибольшого давления пузырьков (метод Ребиндера).
Из них прост и достаточно точен сталагмометрический метод. Он основан на том, что в момент отрыва под действием силы тяжести от конца капилляра капли жидкости, её вес практически равен силе поверхностного натяжения, приложенной к окружности капилляра. Для разбавленных растворов, плотность которых мало отличается от плотности воды, поверхностное натяжение можно вычислить по уравнению:
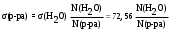 , мДж/м2.
, мДж/м2.Поскольку адсорбция на поверхности жидкости подчиняется уравнению Ленгмюра, максимальную величину адсорбции (Гмах) можно определить расчетным или графическим методом (как котангенс угла наклона прямой на графике 1/Г = f(1/С), см. рис.4). По величине максимальной адсорбции можно рассчитать площадь поверхности, занятой одной молекулой в мономолекулярном слое, длину молекулы (она равна толщине монослоя).

Рис.4. Определение констант в уравнении Лэнгмюра
Учитывая, что на поверхности площадью 1м2 в полностью заполненном мономолекулярном слое количество адсорбированного вещества равно Гмах , а число молекул на 1м2 равно NA. Гмакс, площадь, занимаемая одной молекулы равна:
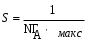 , м2.
, м2.Для установления длины молекулы достаточно определить массу вещества, адсорбированного на 1м2 поверхности. Зная, что масса равна произведению обьема монослоя площадью 1м2 на плотность вещества (V.d), а обьем – произведению длины молекулы на площадь 1м2 (1l ) можно записать, что: m = l.d. Массу вещества в монослое площадью 1м2 можно определить как произведение максимальной величины адсорбции на молекулярную массу ПАВ, т.е. m = Г
макс.М(Х). Отсюда, приравнивая значения масс, можно установить длину молекулы ПАВ:
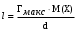 , м.
, м.Оказывается площадь, занимаемая молекулами ПАВ гомологического ряда при плотном заполнении адсорбционного слоя, одинакова. Так, например, площадь, занимаемая молекулами жирных кислот равна 2,1.10−15 см2. Это связано тем, что, независимо от длины углеводородных радикалов, полярные группы молекул разных ПАВ одного гомологического ряда, имеют одинаковую ориентацию к поверхности. Длина же молекул ПАВ, оказалось разной. На одно звено –СН2− прирост толщины монослоя составляет 1,4.10−8 см.
Примеры решения задач
Пример 1.
Предельная адсорбция ПАВ некоторым адсорбентом составляет 0,005 моль/г. Вычислите массу адсорбированного ПАВ из раствора равновесной концентрацией 0,1 моль/л адсорбентом массой 2 г. Относительная молекулярная масса ПАВ равна 60, а константа равновесия 0,06 моль/л.
Решение:
| Дано: Гмакс = 0,005 моль/г С = 0,1 моль/л K = 0,06 моль/л m(адсорбента) = 2 г m(ПАВ) − ? |
2) количество ПАВ, адсорбированное двумя граммами адсорбента будет 2 раза больше: v(ПАВ) = 2Г = 0,0062 моль 3) вычисляем массу ПАВ: m(ПАВ) =v(ПАВ).М = 0,0062.60 = 0,37 г. Ответ: 0,37 г. |
Пример 2.
Определить адсорбцию масляной кислоты при 290 K, если для её растворов при концентрации 0,0103 кмоль/м3 значение поверхностного натяжения равно 65,45.10−3 Дж/м2, а при 0,0206 кмоль/м3 – 59,78.10−3 Дж/м2.
R =8,314.103Дж/(кмоль.К).
Решение:
| Дано: T = 290 K C1 = 0,0103 кмоль/м3 s1 = 65,45.10−3 Дж/м2 C2 = 0,0206 кмоль/м3 s1 =59,78.10−3 кмоль/м3 R = 8,314.103Дж/(кмоль.К) Г − ? | адсорбция жидкости на жидкой поверхности вычисляется по уравнению Гиббса: 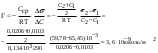 Ответ: 3,6.10−9 кмоль/м2 |
Пример 3.
Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 2,6 и 0,6 мл. Вычислите величину адсорбции.
Решение:
| Дано: m(адсорбента) = 2 г V1(CH3COOH) = 50 мл V2(CH3COOH) = 20 мл C(NaOH) = 0,1 моль/л V1(NaOH) = 2,6 мл V2(NaOH) = 0,6 мл Г − ? | адсорбция жидкости на твердой поверхности вычисляется по уравнению: 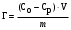 1) вычисляем концентрации кислоты до и после адсорбции по закону эквивалентов: 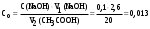 моль/л моль/л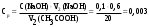 2) вычисляем адсорбцию: 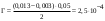 моль/г моль/гОтвет: 0,25 ммоль/г. |
Пример 4.
Величина предельной адсорбции бутанола составляет 7,69.10−6 моль/м2. Вычислите площадь, занимаемой одной молекулой и длину молекулы бутанола. Плотность бутанола равна 0,809 г/мл, молярная масса 74 г/моль.
Решение:
| Дано: Гмакс = 7,69.10−6 моль/м2 d = 0,809 г/мл M(C4H9OH) = 74 г/моль NA = 6,02.1023 S −? l − ? | 1) площадь, занимаемой одной молекулой в плотном мономолекулярном слое вычисляем по формуле: 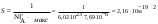 2) длину молекулы рассчитываем по формуле: 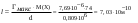 Ответ: S = 2,16.10−19 м2; l = 7,03.10−10 м. |
Вопросы и задачи для самоподготовки
-
Что такое абсорбция, адсорбция, адсорбент, адсорбтив? Какие силы могут действовать между молекулами или ионами адсорбента и адсорбтива? Основные виды адсорбции. -
Объясните физический смысл динамического адсорбционного равновесия. Какие воздействия могут изменять это равновесие? -
В чём заключается и чем объясняется избирательность адсорбции на твердой поверхности? Правило Панета Фаянса для эквивалентной адсорбции. -
Смысл теории мономолекулярной адсорбции Лэнгмюра? Уравнение и изотерма адсорбции Лэнгмюра. Их физический смысл. -
Уравнение и кривая адсорбции Фрейндлиха. Как определяют константы, входящие в уравнение? Для каких случаев адсорбции оно применимо? -
В чём смысл теории полимолекулярной адсорбции Поляни? Изотерма адсорбции БЭТ для полимолекулярной адсорбции (объясните ход кривой). -
Эквивалентная адсорбция. Правило Панета-Фаянса. -
Ионообменная адсорбция. Что такое ионообменники, какова их структура, как они различаются по основности. Применение ионообменников. -
Будет ли происходить адсорбция ионов на частицах сульфата бария в растворе хлористого натрия? Обосновать ответ. -
Будет ли происходить адсорбция ионов на частицах хлорида серебра в растворе хлористого калия? Ответ обосновать. -
Будут ли обмениваться гидрокарбонат ионы на ионообменике с кар-боксильными функциональными группами? Обосновать ответ. -
Будут ли обмениваться ионы натрия на ионообменнике с карбоксильными функциональными группами. Обосновать ответ. -
Будут ли обмениваться ацетат ионы на ионообменнике, функциональными группами которого являются аминогруппы? Ответ обосновать. -
Будут ли обмениваться ионы аммония на ионообменнике, функцио-нальными группами которого являются аминогруппы? Ответ обосновать. -
Привести примеры адсорбции на твердой поверхности в организме. Объясните физиологическое значение адсорбции в каждом случае. -
Как используется адсорбция при лечении больных? Что такое адсорбционная терапия и гемосорбция? -
Привести уравнения, определяющие величину адсорбции на поверхности жидкости. Указать границы их применимости. -
Какие общие черты характерны для структуры молекул ПАВ (объяснить, привести примеры)? Что такое гидрофильно-липофильный баланс (ГЛБ)? -
Как зависит поверхностная активность ПАВ от структуры их молекул? В чем состоит правило Дюкло-Траубе? Объяснить, привести примеры. -
Какие существуют виды ПАВ, чем они отличаются (привести примеры)? -
Как располагаются молекулы ПАВ на поверхности жидкости? Какова структура образуемого ими адсорбционного слоя? -
Назовите наиболее важные естественные ПАВ, действующие в организме, объясните их функции. -
Использование ПАВ в быту, технике, в клинической практике и в фармации. -
Как и во сколько раз изменится поверхностная активность растворённого вещества, если вместо раствора масляной кислоты С3Н7СООН взять раствор уксусной кислоты СН3СООН той же концентрации? Ответ обосновать. -
Вычислите величину и определите тип адсорбции масляной кислоты на границе её 0,04 М раствора с воздухом при 293 K, если поверхностное натяжене этого раствора 65,56 мДж/м2. Поверхностное натяжение воды в тех же условиях 74,01 мДж/м2. Универсальная газовая постоянная равна 8,31 кДж/моль.град. Ответ: 217,3.10−4 моль/л. -
При уменьшении концентрации новокаина в растворе с 0,2 М до 0,15М поверхностное натяжение возросло с 6,9.10-2 Дж/м2 до 7,1.10-2Дж/м2, а в случае растворов кокаина с 6,5.10-2 Дж/м2 до 7.10-2 Дж/м2. Сравните величины адсорбции при 293 K двух веществ в данном интервале концентраций. Ответ: адсорбция кокаина 2,5 раза больше. -
Емкость адсорбента АДБ по холестерину (предельная адсорбция) составляет 0,7 мкмоль/г. Вычислите величину адсорбции холестерина из плазмы крови, содержащей 4,8 мкмоль/мл холестерина, если константа равновесия составляет 2 мкмоль/мл. Ответ: 0,494 мкмоль/г. -
Концентрация холестерина в плазме крови после проведения гемосорбции снизилась с 4,8 до 4,0 мкмоль/мл. Чему равна емкость данного адсорбента (адсорбция) по холестерину (в мкмоль/г), если объем плазмы равен 1 л, а масса сорбента равна 10 г? Ответ: 80 мкмоль/г. -
Концентрация кетоновых тел, накапливаемых в крови больных сахарным диабетом в течение суток (равновесная концентрация), достигает 0,2 моль/л. -
Какое количество кетоновых тел адсорбируется из крови при гемосорбции, если емкость адсорбента (предельная адсорбция) равна 3.10-3 моль/г, а константа равновесия 6.10-2 моль/л? Ответ: 2,3.10−3 моль/г. -
Экспериментально установлено, что величина максимальной адсорбции пропионовой кислоты на угле составляет 3 ммоль/г, а K = 6.10-2 моль/л. Пользуясь уравнением Ленгмюра установите, какая масса кислоты (ММ = 74 г/моль) адсорбировалась на 1 г адсорбента из раствора, в котором установилась равновесная концентрация 0,1 моль/л? Ответ: 138 мг. -
Рассчитайте площадь, занимаемую одной молекулой бутанола в мо-номолекулярном адсорбционном слое на поверхности раствора, если предельная величина адсорбции Гмах= 1.10-9 моль/см2. Ответ: 1,66.10−15 см2. -
Определите предельную величину адсорбции бутанола на поверхности раствора, если площадь поперечного сечения его молекулы составляет 1,66.10-15 см2. Ответ: 1.10−9 моль/см2. -
Найдите площадь, приходящуюся на одну молекулу олеиновой кислоты в насыщенном адсорбционном слое, если предельная величина адсорбции составляет 7,42.10-9 моль/см2. Ответ: 2,24.10−16 см2. -
Определите предельную величину адсорбции масляной кислоты на поверх-
ности раствора, если площадь поперечного сечения её молекул составляет 2,22.10-15 см2. Ответ: 7,48.10−10 моль/см2.
-
Определите предельную величину адсорбции изопенталола на поверхности раствора, если площадь приходящаяся на одну молекулу в насыщенном адсорбционном слое составляет 2,2.10-15 см2. Ответ: 7,55.10−10 моль/см2. -
Рассчитайте площадь, приходящуюся на одну молекулу анилина и толщину мономолекулярного слоя, если предельная величина адсорбции Гмах= 6.10-9 моль/см2, d = 1,022 г/см3, ММ = 93 г/моль. Ответ: 2,77.10−16 см2; 5,46.10−7 см. -
Вычислите длину молекулы масляной кислоты, если площадь, занимаемая одной молекулой в поверхностном слое раствора составляет 2,22.10-15 см2, плотность масляной кислоты 0,96 г/см3, молярная масса 88 г/моль. Ответ: 6,86.10−8 см. -
Вычислите длину молекулы масляной кислоты, если предельная величина адсорбции её составляет 7,48.10-10 моль/см2, молярная масса кислоты 88 г/моль, плотность 0,96 г/см3. Ответ: 6,86.10−8 см. -
Рассчитайте длину молекулы бутанола, если предельная величина адсорбции его на поверхности раствора составляет 1.10-9 моль/см2. Молярная масса бутанола 74 г/моль, плотность 0,81 г/см3. Ответ: 9,136.10−7 см. -
Определите поверхностную активность этилацетата по следующим данным, полученным при 298К:
С, моль/л 0,0078 0,0156 0,03120 0,06250 0,1250 0,2500 0,5000
s, мДж/м2 69,6 68,0 65,1 61,5 56,2 49,7 41,5
Построить изотерму адсорбции Гиббса. s(Н2О) = 72,56 мДж/м2.
-
Определите поверхностную активность додецилсульфата натрия по следующим данным, полученным при 20оС:
С, ммоль/л 2,16 3,96 6,6 8,3 9,3 9,8 10,2 11,2
s, мДж/м2 62 54 47 43 42 41 41 41
Построить изотерму адсорбции Гиббса. s(Н2О) = 72,56 мДж/м2.
-
Пользуясь уравнением Фрейндлиха вычислите равновесную концентрацию раствора уксусной кислоты, если 1 г угля адсорбировал 3,76 ммоль её. К= 0,12; n = 0,5. Ответ: 5,6 ммоль/л. -
По уравнению Фрейндлиха вычислите равновесную концентрацию ацетона, если 1 г угля адсорбировал 1,772 ммоль его. K = 0,1585; n = 0,5. Ответ: 3,34 ммоль/л. -
Рассчитайте величину адсорбции уксусной кислоты на твердом адсорбенте,
если в медико-биологических исследованиях была установлена равновесная концентрация, равная 0,22 моль/л, а константы в уравнении Фрейндлиха: K = 0,1585; n = 0,5. Ответ: 7,67.10−3 моль/г.
-
Какова масса уксусной кислоты, адсорбированной 1,5 г угля, если концентрация её в растворе до адсорбции составляла 0,1 моль/л, а после адсорбции из 50 мл раствора − 0,07 моль/л? Ответ: 0,09 г. -
Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 4,1 и 1,5 мл. Вычислите величину адсорбции. Ответ: 0,325 ммоль/г. -
Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 11,2 и 4,4 мл. Вычислите величину адсорбции. Ответ: 0,85 ммоль/г. -
В 50 мл раствора уксусной кислоты с концентрацией 0,1 моль/л поместили активированный уголь массой 2 г и взбалтывали смесь до достижения адсорбционного равновесия. После этого раствор отфильтровали. На титрование 10 мл фильтрата пошло 15 мл раствора титранта с концентрацией KOH, равной 0,05 моль/л. Вычислите величину адсорбции. Ответ: 0,625 ммоль/г. -
В 60 мл 0,44 М раствора некоторого вещества поместили активированный уголь массой 3 г. Раствор с адсорбентом взбалтывали до установления адсорбционного равновесия, в результате чего концентрация вещества снизилась до 0,35 моль/л. Вычислите величину адсорбции. Ответ: 1,8 ммоль/г.
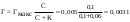 (моль/г)
(моль/г)