Файл: Урока Алюминий, его физические и химические свойства, применение.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 02.02.2024
Просмотров: 70
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
изготовляют посуду?
Оборудование: алюминиевая фольга, алюминиевая проволока, спиртовка, держатель.
(§ 16 стр. 57 + приложение)
Основные факты
C чем ассоциируется у нас слово «алюминий»? С походной кружкой, банкой для газированных напитков, песней про «алюминиевые огурцы». А может быть, с серебристым самолетом, взмывающим в небесную синь? О чем бы мы ни подумали, трудно охватить воображением ту огромную роль, которую алюминий играет в современном мире.
Чтобы осознать ее, попробуем представить себе мир без алюминия. В этом мире путь из Европы в Америку занимает многие дни, потому что приходится плыть на тяжелом неповоротливом корабле. Да и железнодорожные перевозки нельзя сделать максимально быстрыми: нет материала для производства легких вагонов. Зеркала довольно быстро мутнеют и портятся. Нет альтернативы увесистым стеклянным и плохо утилизируемым пластиковым бутылкам. Высоковольтные линии электропередач делают из тяжелой и дорогой меди… И это лишь малая доля неудобств, которыми изобиловал бы такой мир. Нет сомнений: материал, занимающий настолько важное место в нашей жизни, стоит более близкого знакомства.
| Алюминий — это легкий и пластичный белый металл, матово-серебристый благодаря тонкой оксидной пленке, которая сразу же покрывает его на воздухе. Он относится к III группе периодической системы, обозначается символом Al, имеет атомный номер 13 и атомную массу 26,98154. Температура его плавления составляет 660°. Алюминий чрезвычайно распространен в природе: по этому параметру он занимает четвертое место среди всех элементов и первое — среди металлов (8,8% от массы земной коры), но не встречается в чистом виде. Его в основном добывают из бокситов, хотя известно несколько сот минералов алюминия (алюмосиликаты, алуниты и т. п.), абсолютное большинство которых не подходит для получения металла. |
Применение алюминия и его физические свойства, на которых оно основано
Алюминий называют «крылатым металлом». Такое название этот металл получил за свою легкость и широкое применение, в первую очередь, в самолетостроении. Алюминий прочно вошел в нашу жизнь: каждому с детства знакомы алюминиевая фольга, посуда, проволока. А ведь когда-то изделия из алюминия считались роскошью. Например, в 1852 году стоимость 1 кг алюминия была 1200 долларов, т.е. дороже золота. Почему же со временем цена на алюминий так упала?
Дело в том, что алюминий широко распространен в земной коре (8%), самый распространенный металл. Но для восстановления алюминия из руд необходимо затратить большое количество энергии. К концу 19 века разработали новый способ получения алюминия с помощью электролиза, ежегодное получение металла возросло в тысячи раз, и цена на него упала.
Алюминий очень устойчив по отношению к кислороду и воде. Эта устойчивость обусловлена образованием на его поверхности тонкой, но плотной и прочной оксидной пленки – Al2O3. Благодаря этому свойству алюминий и его сплавы нашли широкое применение в быту и промышленности. Вам хорошо известно о применении алюминия для изготовления кухонной посуды.
Алюминий применяется для изготовления кухонной посуды
Высокая электропроводность алюминия (по этому качеству он уступает лишь серебру и меди) позволяет широко его применять в электротехнике. Кроме того, алюминий дешевле и легче, чем медь и серебро.
Но мы перечислили пока не все достоинства этого удивительно практичного металла. При 100-150°С алюминий настолько пластичен, что из него можно получить тонкую фольгу, толщиной менее 0,01 мм. Алюминиевая фольга применяется для изготовления электрических конденсаторов и изделий, защищающих от тепловой радиации.
Алюминий также используют для алитирования, т.е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии. Порошок алюминия используют для изготовления серебряной краски, устойчивой к атмосферным воздействиям.
Сплавы алюминия
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дуралюмины, содержащие медь и магний, и силумины – сплавы алюминия с кремнием. Основные преимущества этих сплавов – легкость, высокая прочность и коррозионная стойкость.
Сплавы алюминия широко используют в качестве конструкционного материала в авиастроении, а также в авто -, судо- и приборостроении, в ракетной технике и строительстве.
Дюралюмины широко применяются в авиастроении.
«Применение алюминия»
В чистом виде алюминий используется в электротехнике.
-
Изготовление проводов (лёгкость, электропроводность).
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, но он приблизительно в 3 раза легче, поэтому провода из алюминия с электросопротивлением, как у медных, имеют массу в 2 раза меньшую, при этом алюминий приблизительно в 2 раза дешевле. Правда, у алюминия как электротехнического материала есть неприятное свойство — из-за прочной оксидной плёнки его тяжело паять;
-
Производство кухонной посуды, столов, стульев, алюминиевой фольги (нетоксичен, высокая теплопроводность);
если вы готовите пищу в такой посуде, то должны знать, что она делится на легкую с толщиной дна 1,5мм, среднюю -2мм, тяжелую – 2,5мм и изготавливается из чистого алюминия или дюралюминия. В такой посуде нельзя хранить кислую капусту, кислое молоко блюда из картофеля. Длительное воздействие кислот и щелочей разрушает оксидную пленку на алюминии, и металл проникает в пищу. Не стоит увлекаться блюдами, запеченными в фольге, не рекомендуется хранить в ней продукты.
Гораздо чаще используются сплавы алюминия, в которых сохраняются его легкость и пластичность, но значительно повышаются прочность и жаростойкость. Сплавы алюминия легко поддаются обработке, сварке, поэтому являются основными конструкционными материалами в авто -, судо -, и авиастроении, при сооружении промышленных и жилых зданий. При изготовлении различной аппаратуры и посуды.
-
Конструкционный материал (лёгкость, податливость штамповке, коррозионная стойкость); -
Цистерны для перевозки азотной кислоты. -
Изготовления зеркал (высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления); -
Ювелирные изделия (когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Мода на них сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии; -
Алюминий зарегистрирован в качестве пищевой добавки Е173 (группа красителей), используется для подкрашивания тортов и различных видов драже, придают кондитерским изделиям серебристый цвет. Он не безопасен, разрешен в странах ЕС. Вещество хорошо сохраняет продукты от порчи и плесени; -
Высокоэффективное ракетное горючее; -
В составе бенгальских огней (современный искристый бенгальский огонь содержит азотнокислый барий в качестве окислителя, порошок алюминия или магния как горючее, декстрин или крахмал в качестве клея, а также оксидированные железные или стальные опилки для образования искр). -
Краска «серебрянка» (блеск в порошке); -
Восстанавливает металлы (хром, никель, кобальт, ванадий, титан, марганец) из их оксидов (алюминотермия); -
Оксид алюминия (корунд) используется как абразивный материал для шлифовки и полировки металлов, искусственно выращенные монокристаллы рубина используются в лазерах, часовой и ювелирной промышленности. Из крупнокристаллического Аl2О3 делают опоры и подшипники в точных приборах; -
Хлорид алюминия AlCl3 применяют в качестве катализатора (?) в производстве очень многих органических веществ. -
Сульфат алюминия Al2(SO4)3 применяется для очистки воды, производства бумаги, а его кристаллогидрат Al2(SO4)3• 18 Н2О используется при протравном крашении хлопчатобумажным тканей.
Алюмокалиевые квасцы КAl(SO4)2• 12 Н2О применяются
Приложение 6.1
Учащийся группы 2. (Делает записи на доске)
Алюминий серебристо-белый, лёгкий, пластичный металл. Имеет металлический блеск. Является легкоплавким металлом. Хотя плавится он при 6600. С, но можно долго кипятить воду в алюминиевой кастрюле, так как алюминий покрыт тугоплавкой оксидной плёнкой. Также алюминий обладает очень высокой электрической проводимостью и теплопроводностью.
Приложение 7
Группа 3. Изучите химические свойства алюминия и составьте схему, отражающую общие химические свойства алюминия как металла. Объясните, почему алюминий в электрохимическом ряду напряжения металлов стоит сразу же после активных щелочных и щелочноземельных металлов?
Оборудование: инструкция к выполнению лабораторного опыта (приложение 4) гранулы алюминия, растворы соляной кислоты и хлорида меди (II), штатив с пробирками. (§16 стр.58-59).
Инструкция по выполнению лабораторного опыта
«Химические свойства алюминия»
ВНИМАНИЕ!
Вспомните, как безопасно обращаться с растворами кислот.
Какие меры надо предпринять при попадании капель кислоты на кожу и одежду?
ОПЫТ 1: ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ С СОЛЯНОЙ КИСЛОТОЙ.
Гранулу алюминия опустить в пробирку с разбавленной соляной кислотой(=5 мл).
Что происходит? Написать уравнение происходящей реакции по схеме:
Al + HCl →
Собрать выделяющийся газ, доказать, что это водород. Сделать вывод.
ВЫВОД:
Алюминий реагирует с HCl, проявляя при этом … … … химические свойства.
Приложение 7.1
Учащийся группы 3. Делает записи на доске, схема
Аl + О2 →
Аl + Н2О →
Аl + растворы кислот →
Аl + растворы солей →
Аl + оксиды менее активных металлов
Для того чтобы алюминий начал реагировать, с его поверхности нужно удалить оксидную плёнку. И тогда алюминий становится химически активным элементом. И, как металл, он довольно-таки легко реагирует с кислородом, неметаллами, водой, растворами кислот и солей. Но в концентрированных азотной и серной кислотах пассивирует, поэтому эти кислоты перевозят в алюминиевых ёмкостях. Также его широко используют в металлургии для получения металлов – хрома,
марганца, ванадия, титана, циркония из их оксидов. Этот способ носит название алюминотермия.
Приложение 8
Группа 4. Почему в алюминиевой посуде нельзя хранить не только кислые, но и щелочные растворы? Докажите опытным путём, что алюминий является переходным элементом.
Оборудование: инструкция к выполнению лабораторного опыта алюминиевая проволока, раствор гидроксида натрия, штатив с пробиркам, спиртовка, держатель.
Инструкция по выполнению лабораторного опыта
«Химические свойства алюминия»
ВНИМАНИЕ!
Вспомните, как безопасно обращаться с растворами кислот.
Какие меры надо предпринять при попадании капель кислоты на кожу и одежду?
ОПЫТ 2: ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ СО ЩЁЛОЧЬЮ.
Алюминиевую проволоку опустить в раствор щёлочи объёмом = 5 мл. Для ускорения реакции раствор
необходимо, … … … Что происходит? Написать уравнение происходящей реакции по схеме, расставить
коэффициенты методом электронного баланса:
Аl0 + KOH+1 + H2+1 O → K[Al+3(OH)4] + H20
Доказать наличие водорода. Сделать вывод из 1-2 опытов:
ВЫВОД:
Алюминий реагирует с HCl, проявляя при этом … … … химические свойства. Но алюминий реагирует
и с KOH, проявляя … … …химические свойства. Следовательно, алюминий проявляет … …
…химические свойства.
Приложение 8.1
Учащийся группы 4. (Делает записи на доске).
Специфическим свойством для алюминия является реакция с растворами щелочей, в которой он проявляет переходные свойства. При этом образуются соли.
1) Взаимодействие со щелочами без нагревания
2AI + 2NaOH + 6Н2О = 2NaAI(OH)4 + 3Н2
2) Взаимодействие со щелочами при сплавлении
2AI +2NaOH + 2Н2О =2NaAIО2 + 3Н2
(Демонстрация опыта обучающимся).
Приложение 9
Изучите способ получения алюминия в промышленности и объясните, почему алюминий, занимающий третье место по распространённости на земле, в XIX веке стоил так дорого? (§16 + Приложение 9)
«Получение алюминия»
Немецкий химик Ф. Велер в 1827г. получил алюминий при нагревании хлорида алюминия со щелочными металлами калием или натрием без доступа воздуха:
AlCl3 + 3K →3 KCl + Al
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов.
2
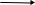 Al2O3 Na3AlF6, ток 4Al + 3O2
Al2O3 Na3AlF6, ток 4Al + 3O2Приложение 9.1
Учащийся группы 5. Алюминий можно получить разложением расплава его оксида на составные части.