ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.02.2024
Просмотров: 189
Скачиваний: 1
СОДЕРЖАНИЕ
Глава 8. КАТИОНЫ ПЕРВОЙ АНАЛИТИЧЕСКОЙ ГРУППЫ ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИКАЦИИ §8.1-8. 3
Глава 9. КАТИОНЫ ВТОРОЙ АНАЛИТИЧЕСКОЙ ГРУППЫ ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИКАЦИИ §9.1-9. 3
Самостоятельная (внеаудиторная) работа№4
Лабораторно-практическое занятие №2
3. Глава 11. КАТИОНЫ ЧЕТВЁРТОЙ АНАЛИТИЧЕСКОЙ ГРУППЫ ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИКАЦИИ § 11.1-11.3
Лабораторно-практическое занятие №3
2. Глава 12. КАТИОНЫ ПЯТОЙ АНАЛИТИЧЕСКОЙ ГРУППЫ ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИКАЦИИ § 12.1-12.3
3. Глава 13. КАТИОНЫ ШЕСТОЙ АНАЛИТИЧЕСКОЙ ГРУППЫ ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИКАЦИИ § 13.1-13.3
2. Глава 14. КАЧЕСТВЕННЫЙ АНАЛИЗ АНИОНОВ. АНИОНЫ ПЕРВОЙ АНАЛИТИЧЕСКОЙ ГРУППЫ § 14.1-14.3
3. Глава 15. АНИОНЫ ВТОРОЙ И ТРЕТЬЕЙ АНАЛИТИЧЕСКИХ ГРУПП § 15.1-15.3
Лабораторно-практическое занятие №6
2. Раздел III. КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ
Глава 17. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ § 17.1-17.3
3. Глава 19. ХИМИЧЕСКИЕ ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА § 19.1-19.7
Лабораторно-практическое занятие №7
2. Решите упражнения и ситуационные задачи самостоятельно
1. Глава 20. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ §20.1-20.6
2. Оформление лабораторной работы .
Таблица растворимости кислот, солей, оснований
Критерии выставления оценок за лабораторно-практические занятия
Приложение 3
КАТИОНЫ
| Катионы | Реактив, уравнение реакции, признаки присутствия данного катиона, открываемый минимум (чувствительность реакции) |
| Калий К+ | В нейтральной или уксуснокислой среде: Na3[Co(NO2)6] 2K+ + Na+ + [Co(NO2)6]3- → K2Na[Co(NO2)6] Микрокристаллоскопическая реакция с Na2Pb[Cu(NO2)6] – образуются черные кристаллы кубической формы (открываемый минимум - 0,15 мг К+; предельное разбавление 1:7,5.104).
|
| Натрий Na+ |
Na++Zn(UO2)3(C2H3O2)8+ CH3COO- + 9H2O → NaZn(UO2)3(C2H3O2)8. 9H2O
|
| АммонийNH4+ |
Чувствительность реакции – 0,05 мг ; предельное разбавление 1:106. NH4Cl + NaOH → NaCl + NH3 + H2O (NH4+ + OH -→ NH3 + H2O)
аммония; предельное разбавление 1:2.107 |
| Магний Mg2+ |
Mg2+ + CO32-→ MgCO3 |
| Кальций Са2+ |
CaCl2 + (NH4)2C2O4 → 2NH4Cl + CaC2O4 (Сa2+ +C2O42- → CaC2O4)
характерная форма кристаллов в виде длинных игл или пластинок (чувствительность - 0,1 мг Са 2+) |
| Барий Ва2+ |
К2Cr2O7 + CH3COONa дают ярко-желтый осадок хромата бария.
Ba2+ + SO42-→ BaSO4 (Открываемый минимум - 0,4 мг; предельное разбавление 1:1,25.105). Гипсовая вода (насыщенный раствор СаSO4) с Ва2+ на холоде вызывает медленное образование осадка (тогда как для ее взаимодействия с ионами Sr2+ требуется нагревание). 3) Окрашивает пламя в желто-зеленый цвет. |
| Алюминий Al3+ |
Al3+ + 3OH-→ Al(OH)3 Al(OH)3 + OH- → [Al(OH)4]- ( Гидроксид алюминия проявляет амфотерные свойства) В отличие от гидроксида цинка, Al(OH)3 не растворяется в NH4OH.
|
| Хром Cr 3+ |
Сr(OH)3, проявляющий амфотерные свойства - растворяется в растворах кислот и в избытке щелочей и NH4OH. |
| Железо Fe 3+ |
реакции 0,05 мг Fe3+, предельное разбавление 1:106 : 4K4[Fe(CN)6] + 4Fe3+ → 12К+ + 4КFeIII[FeII(CN)6] (а)
Fe3+ + 3OH- → Fe(OH)3
FeCl3 + 3NH4SCN → 3NH4Cl + Fe(SCN)3 Открываемый минимум - 0,25 мг, предельное разбавление – 1 : 2.105 |
| Железо Fe2+ | 1) Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) образует темно-синий осадок турнбулевой сини; чувствительность реакции 0,1 мг железа, предельное разбавление 1 : 5.107 3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6] + 6K+ (б) Недавно было установлено, что берлинская лазурь и турнбулева синь – это одно и то же вещество, т.к. комплексы, образующиеся в реакциях (а) и (б) находятся между собой в равновесии: KFeIII[FeII(CN)6] → KFeII[FeIII(CN)6] (В разделе “Железо и его соединения” упомянутые выше реакции (а) и (б) приведены в традиционной старой записи). |
| Цинк Zn2+ |
Zn2+ + 2OH- → Zn(OH)2 Zn(OH)2 + 4NH3 →[Zn(NH3)4](OH)2 При прокаливании гидроксида цинка с соединениями кобальта образуется окрашенная в зеленый цвет масса , представляющая собой цинкат кобальта СоZnO2.
|
| Никель Ni2+ | 1) Гидроксид натрия образует бледно - зеленый студенистый осадок Ni(OH)2; открываемый минимум - 300 мг никеля, предельное разбавление 1:3.105. Осадок растворим в кислотах и в NH4OH и нерастворим в избытке щелочи.
осадок; открываемый минимум - 0,5 мг никеля, предельное разбавление 1:1.106. |
| Серебро Ag+ |
Ag+ + Cl- → AgCl AgCl + 2NH4OH → [Ag(NH3)2]+ + Cl- + 2H2O [Ag(NH3)2]+ + Cl- + 2H+ → AgCl + 2NH4+
|
| Медь Cu2+ |
Cu2+ + 2OH-→ Cu(OH)2 Cu(OH)2 → CuO +H2O Открываемый минимум - 80 мг меди, предельное разбавление 1:5.104. Гидроксид меди растворяется в концентрированных растворах аммиака, образуя аммиакат меди интенсивно синего цвета (реактив Швейцера; растворяет целлюлозу) |
АНИОНЫ
| Анион | Реактив, уравнение реакции, признаки присутствия данного аниона, открываемый минимум (чувствительность реакции) |
| F- |
|
| Cl- | 1) В азотнокислой среде AgNO3 дает белый осадок, растворимый в NH4OH. Открываемый минимум - 1 мг Cl-, предельное разбавление 1:105. |
| Br- |
|
| I- |
2 I- + Cl2 → I2 + 2Cl-
Другие окислители (перманганат калия, дихромат калия и др.) в кислом растворе также окисляют йодид-анион до йода: Cr2O7 2- + 2I- + 14H+ → 2Cr3+ + 3I2 + 7H2O 2MnO4- + 10I- + 16H+ → 2Mn2+ + 5I2 + 8H2O |
| S2- |
S2- + 2H+ → H2S
|
| SO32- |
|
| SO42- | 1) Хлорид бария дает белый осадок, нерастворимый в HNO3 Ba2+ + SO42-→ BaSO4 |
| CO32- | 1) Минеральные кислоты разлагают карбонаты (и гидрокарбонаты) с образованием углекислого газа СO2, который с известковой водой образует белый осадок: CO32-+2H+ → H2O+ CO2 Ca(OH)2 + CO2 →CaCO3 |
| SiO32- | 1) Минеральные кислоты выделяют гель кремниевой кислоты |
| СН3СОО- | 1) При растирании в ступке уксуснокислой соли с гидросульфатом калия появляется характерный запах уксусной кислоты ( сильная кислота вытесняет из соли слабую): CH3COOK + KHSO4 → CH3COOH + K2SO4
|
Приложение 5
Мерная посуда
 | Стакан с носиком служит для хранения жидких и твердых веществ, а также для проведения простейших химических операций (растворение, нагревание) |
 | Колба коническая используется для проведения различных химических операций, например титрования |
 | Колба круглодонная служит для проведения разнообразных химических операций при нагревании. |
| | Цилиндр используют для измерения объема жидкостей. |
 | Воронка конусообразная служит для переливания жидкостей и фильтрования. |
 | Стеклянная палочка предназначена для размешивания веществ в химической посуде. Для предохранения посуды от случайного растрескивания при размешивании веществ на конец стеклянной палочки надевают кусочек резиновой трубки. |
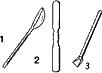 | Ложка фарфоровая (1), шпатель (2) служат для взятия твердых и сыпучих веществ. Ложка-дозатор (3) предназначена для взятия определенной порции вещества. |
 | Чашка фарфоровая применяется для выпаривания жидкостей. |
| | Ступка с пестиком служат для размельчения и растирания твердых веществ. |
 | Штатив для пробирок, служит для размещения в нем пробирок. |
| | Зажим пробирочный служит для закрепления пробирки, если вещество в пробирке требуется нагреть в пламени. |
| | Склянка с пипеткой служит для хранения растворов реактивов при работе с малыми количествами веществ. |
 | Мерная колба, предназначена для приготовления растворов точной концентрации, а также растворов разбавления. |
| | Пипетки с делениями на слив от любой отметки до сливного кончика. Применяются для точного отмеривания определенных объемов жидкости. |
| | Спиртовка предназначена для нагревания жидкостей |
Критерии выставления оценок за лабораторно-практические занятия
| Оценка | Критерии |
| «5» |
|
| «4» | если студент выполнил все критерии к оценке «5», но при этом:
|
| «3» |
|
| «2» |
|