Файл: Алгыев Куан Сяхетгулыевич Химияны аылшын тілінде оытуды ерекшелігі Дстрлі жне жаа технология сабатастыы.docx
Добавлен: 04.02.2024
Просмотров: 321
Скачиваний: 7
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Қорыта келгенде химия пәнін ағылшын тілінде оқыту оқушылардың сөздік қорын кеңейте отырып, жаңалық ашуға, әртүрлі бақылаулар, тәжірибелер жүргізуге құлшындырады.сондықтан біз химия пәнін ағылшын тілінде оқыту арқылы сабақ барысында қосымша берілетін химиялық терминдер сөздігімен оқушының ағылшын тілін меңгерудегі сөздік қорын қалыптастыруға және бәсекеге қабілетті болардай білімін толықтыруға өз көмегімізді тигізе аламыз.
3.3 Сабақ барысында глоссаримен жұмыс жүргізу
САБАҚ ЖОСПАРЫ
| Сабақтың тақырыбы: Электртерістік. Коваленттік байланыс | Мектеп: Түркістан мамандандырылған Н.Оңдасынов атындағы мектеп интернаты | |||||
| Күні: | Мұғалімнің аты-жөні: Байсалова Асылнұр | |||||
| СЫНЫП: 8 | Қатысқандар саны: | Қатыспағандар саны: | ||||
| Сабақ негізделген оқу мақсаты (мақсаттары) |
| |||||
| Сабақ мақсаттары |
келген элемеенттің метал немесе бейметалл екенін анықтауға болатынын түсіндіру;
| | ||||
| | | |||||
| | | |||||
| | | |||||
| | ||||||
| | | |||||
| Тілдік мақсат | Оқушылар:
| |||||
| ||||||
| Жоспар | ||||||
| Жоспарланған уақыт | Жоспарланған жаттығулар (төменде жоспарланған жаттығулармен қатар, ескертпелерді жазыңыз) | Ресурстар | ||||
| Басталуы 15 мин | Сәлемдесу; ( Ағылшын тілінде) Сыныпта жағымды атмосфера қалыптастыру; Түрлі түсті қағаздан жасалған қима арқылы топқа бөлу; Топбасшыларын сайлату; Бағалау парақшасын тарату; «Сандар сөйлейді» әдісі арқылы жаңа тақырыпқа байланысы бар өткен сабақтағы ұғымдар мен анықтамаларды еске түсіру; «Ойқозғау» . What is the first element on the periodic table? 2. What is the centre of an atom called? 3. What is the main gas found in the air we breathe? 4. K is the chemical symbol for which element? 5. What is the chemical symbol for a gold ? 6. At room temperature, what is the only metal that is in liquid form? ХимиялықбайланыстыөзтілдеріңдетүсіндірпкөріңдерІ «Болжау» әдісі
«Болжау» әдісі тапсырмаларына жауап беріп,өз ойларымен бөлісе отырып, жаңа сабақтың тақырыбын ашады. Сабақтың мақсатымен таныстыру Бүгінгі сабақтың мақсаты:
| | ||||
| Ортасы Түсіндіру | 35-36 тақырыптарды ашып талқылау, топқа тапсырма беру; Жаңа сөздерді таныстырып, оқылуын, жазылуын қадағалау Электртерістілік - элементтің сыртқы электрон қабатын толықтыруға ұмтылысын сипаттайтын шаманы айтады. Заттардың формулаларын жазғанда электртерістілігі төмен элемент алдымен, ал электртерістілігі жоғары элемент соңынан жазылады. Химиялық байланыстың түзілуі мен оның қасиеттері әрекеттесуші элементтердің атомдарының құрылысына тәуелді болады. Электртерістілік период бойынша солдан оңға қарай, ал топ бойынша төменнен жоғары қарай артады.
electronegativity - pertaining to an atom or group of atoms that have a relatively great tendency to attract electrons to itself  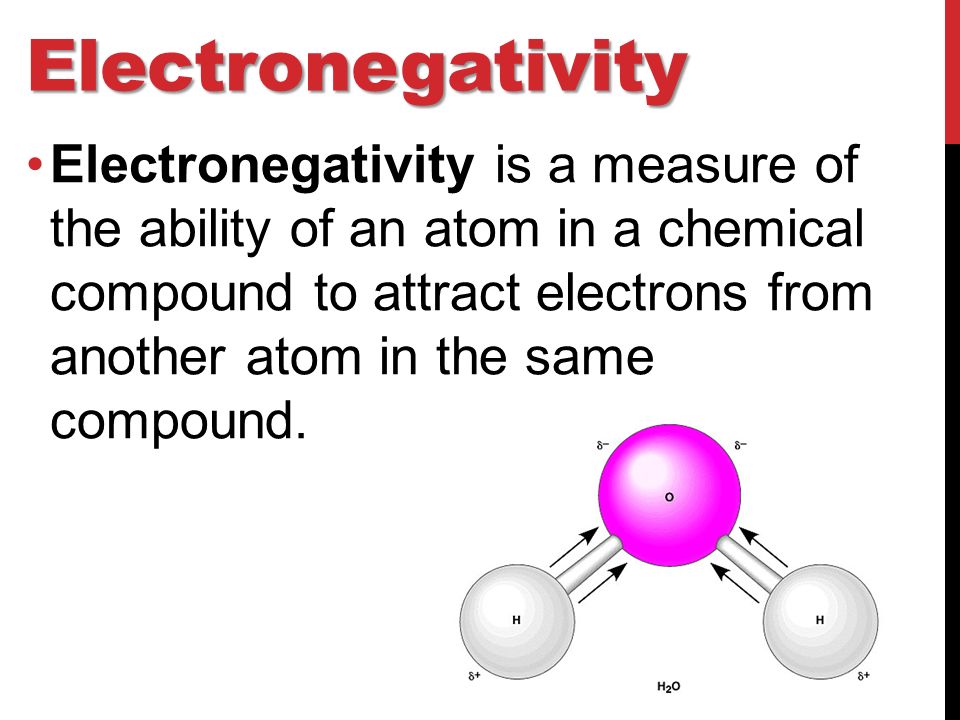  Химиялық байланыс Химиялық байланыс түзілуіне қарай төртке бөлінеді:
Ковалентті байланыс ортақ электрон жұбы түзілу арқылы іске асады. Химиялық байланыстың түзілуін электртерістілік ұғымын қолданып түсіндіруге болады. Электртерістіліктері бірдей элемент атомдарының арасында (Н2, О2, N2, С12) байланыста болатын сутек молекуласының түзілу мысалында қарастырайык. Сутек атомының электрондық формуласы 1s1. Сутектің электротерістілігі 2,1. S-электрондарының электрон бұлттары сфера (шар) тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:  Cонда s электрондарының бұлттары өзара қабысып, екі электрон екі ядроға да ортақ, олардан бірдей қашықтықта орналасады. Бірдей атомдардың арасындағы байланыс полюссіз ковалентті байланыс деп аталады. Электрон бұлттары қабысуы нәтижесінде энергия бөлініп, молекула түзіледі. Бұл энергия шамасы молекуладағы байланыс беріктілігін сипаттайды, олай болса молекула жеке атомдарға қарағанда тұрақты жүйе болғаны Полюссіз ковалентті байланыста байланыстырушы электрон жұбының бұлты ядролардан бірдей қашықтықта орналасады. Енді оттегі молекуласындағы байланыстың түзілуін қарастырайық. Оттек атомының электрондық формуласы 1s22s22p4, валенттілік электрондары 2s22p4, электртерістілігі 3,5. 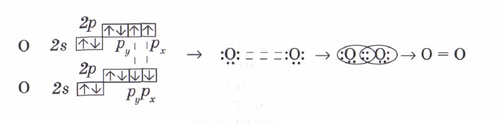 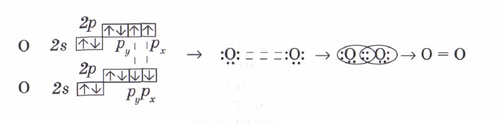 Forming Chemical Bonds The force that holds two atoms together is called a chemical bond .The valence electrons are the electrons involved in forming chemical bonds.Elements tend to react to acquire eight electrons. This is call a stable octet.Noble gases (group VIIIA/18) have this structure (octet) and are inert (does not form bonds).Atoms can gain, lose, or share electrons to reach an octet. Forming IonsPositive ions (cations) are formed when atoms lose one or more valence electrons. [Usually these atoms are metals.]Reactivity of metals (cations) are based on how easily they lose electrons. [ Ionization energy]Negative ions (anions) are formed when atoms gain one or more valence electrons. [These atoms tend to be non-metals.]Electronegativity is the ability to attract or gain electrons. Forming Covalent Bonds Covalent bonds: Sharing of electrons between atoms (difference of electronegativity of less than 1.6).Occurs usually between elements close to each other on the periodic table (mostly non-metals).The resulting compound is called a molecule. Properties of Covalent Compounds Have definite and predictable shapes.Low melting and boiling points.Relatively soft solids.Can exist as solids, liquids or gases. Глоссари Электртерістілік- атомдардыңэлектрондыөзінетартыпалуқабілеті. Химиялықбайланыс – химиялықэлементтердіңһзарабайланыстүзіпқосылуы. Катион – оңзарядталғанбөлшек. Анион-терісзарядталғанбөлшек. Ион – зарядталған атом немесе атомдар тобы. Ковалентті байланыс-атомдар арасында соңғы қабат элетрондарының жұптасуы арқылы түзілген байланыс түрі. Полюссіз байланыс – электртерістілігі бірдей химиялық элементтер арасында түзілетін байланыс. Полюсті байланыс – әр түрлі бейметалдар атомдарының арасында түзілетін байланыс түрі. Конверттегі сұрақтар» Сабақты бекіту мақсатында дарынды бала мен үлгерімі төмен оқушымен жұмыс жүргізу үшін табандылықты дамытуға арналған кеңейтілген тапсырмалар ұсынылады.Тапсырмалар блум таксономиясы арқылы жасалынған. Деңгейлік тапсырмаларды орындау барысында оқушыларды табандылыққа дағдыландыру үшін «Бағдаршам» әдісі қолданылады. Тапсырмалар: 1.Химиялық қосылыстар түзу қасиеті олардың атом құрлысына байланысты болады ма? 2.Атомның сыртқы қабатындағы электрондары қалай аталады? 3.Элементтердің жіктелуі бойынша металл мен бейметалды салыстыр.Қалыптастырушы бағалау:Мадақтау Әр топқатапсырмалар: 1.Электртерістілік кестесін пайдаланып электртерістігі ең жоғары және ең төмен элементті анықта? 2. Ковалентті полюсті және полюссіз байланыстын анықтамасын берініздер және Венн даграмасы бойынша салыстырыңдар. 3. Периодта және топта элементтердің электртерістігі қалай өзгереді?Қалыптастырушы бағалау:Өзара бағалауДескриптор: Электртерістігі мәнін пайдаланып ең жоғары және ең төмен элементтерді ажырата алады Ковалентті байланысты түсініп, электртерістік мәні бойынша қандай атомдар арасында түзілетіндігін біледі Элементтердің электртерістігі период және топ бойынша қалай өзгеретіндігін түсінеді Тапсырма 1. ( Жеке жұмыс)1. Ковалентті полюссіз байланысы бар қосылыстар қатарын көрсетіңіз:а)F2 O2 N2 \ б) N2 Na2S ; HF С) NaF ;CaF2 ;Na2SO4 2..Полюсті ковалентті байланысы бар қосылысты көрсетіңіза) Na2SO4 б) HСІ с) O2 3. Мына элементтерді электртерістіктерінің өсу ретімен орналастырыңдар: фосфор, магний,бор, цезий, оттек,кремний, калий, көміртек, сутек,литий,фтор,күкірт | презентация | ||||
| Аяқталуы | Оқушылардың тақырып бойынша білім деңгейін тексеру үшін «Екі жұлдыз, бір тілек» әдісі арқылы кері байланыс жүргізіледі. Бағалау кезінде топбасшылар бағалайды,оқушының өзін-өзі бағалауы іске асады, ең соныңда жиынтықтық бағалау шығады. Жалпы сабақ бойынша кері байланыс бағалау ағашы бойынша жүзеге асады. | презентация | ||||
| Үйге тапсырма: | Жаңа сөздерді жаттау; Глоссаримен жұмыс жасау; Оқылық соңындағы тапсырмалар | | ||||
САБАҚ ЖОСПАРЫ
| Сабақтың тақырыбы: Иондық байланыс. Кристалдық тор түрлері. | Мектеп: Түркістан мамандандырылған Н.Оңдасынов атындағы мектеп интернаты | |||||
| Күні: | Мұғалімнің аты-жөні: Байсалова Асылнұр | |||||
| СЫНЫП: 8 | Қатысқандар саны: | Қатыспағандар саны: | ||||
| Сабақ негізделген оқу мақсаты (мақсаттары) |
мағлұматтар беру.
| |||||
| Сабақ мақсаттары |
| | ||||
| | | |||||
| | | |||||
| | | |||||
| | ||||||
| | | |||||
| Тілдік мақсат | Оқушылар:
| |||||
| ||||||
| Жоспар | ||||||
| Жоспарланған уақыт | Жоспарланған жаттығулар (төменде жоспарланған жаттығулармен қатар, ескертпелерді жазыңыз) | Ресурстар | ||||
| Басталуы | Сәлемдесу; ( Ағылшын тілінде) Сыныпта жағымды атмосфера қалыптастыру; Түрлі түсті қағаздан жасалған қима арқылы топқа бөлу; Топбасшыларын сайлату; Бағалау парақшасын тарату; «Сандар сөйлейді» әдісі арқылы жаңа тақырыпқа байланысы бар өткен сабақтағы ұғымдар мен анықтамаларды еске түсіру; «Ойқозғау» 1. What is H20 more commonly known as? 2. What orbits the nucleus of an atom? 3. Atoms of the same chemical element that have different atomic mass are known as? 4. How many types of chemical reactions? 5. How is called this number 6.02*1023 ? 6. True or false? Endothermic reaction is a reaction which absorbs heat? 7. True or false? Exothermic reaction is a reaction that produces heat? 8. How many groups and periods on the periodic table of the elements? Өткенсабақтағыглоссаридіадасқансөздерменжинақтау; ХимиялықбайланыстыөзтілдеріңдетүсіндіріпкөріңдерІ «Болжау» әдісі
«Болжау» әдісі тапсырмаларына жауап беріп,өз ойларымен бөлісе отырып, жаңа сабақтың тақырыбын ашады. Сабақтың мақсатымен таныстыру Бүгінгі сабақтың мақсаты:
мағлұматтар беру.
химиялық сауаттылыққа баулу. | | ||||
| Ортасы Түсіндіру | ондық байланыс деп – иондар арасындағы байланысты айтады. Металл мен бейметалл арасында түзіледі. Ион – бұл электрон беру немесе алу нәтижесінде түзілетін зарядталған бөлшек. Мысалы: Ас тұзы NаСІ. Электрондарын беретін бөлшек оң ионға айналады (катион). Электрондарын беретін бөлшек теріс ионға (анион) айналады. 1916 жылы неміс ғалымы Коссель ұсынды. Өзінің сыртқы валенттік электрондарына сай электрон бұлтын берген атомдар оң зарядты катиондарға, ал осы электрондарға сай бұлтты қосып алған атомдар терісзарядтыанионындарға айналады. Жаңа сабақтың тақырыбына мақсат қояды. Оқушылар тақырыпты өздігінен меңгереді. 1-топ: иондық байланыс 2-топ: металдықбайланыс Иондық байланыстың түзілуі Сендер, таңбалары қарама-қарсы зарядтар бір-біріне тартылатының физикадан білесіндер. Иондарда заряд бар болғандықтан, қарама-қарсы зарядталғандары бір-біріне тартылады. Осылай иондық байланыс түзіледі. Мысалы жоғарыдағы хлор мен натрийдің иондары бірігіп, натрий хлорийдің, немесе кәдімгі ас тұзы түзіледі: Na+ + Cl- = NaCl  Жалпы электрондарды беру металдарға тән қасиет, ал электрондарды өздеріне қосып алу бейметалдарға тән қасиет. Ionic bonding is a type of chemical bonding that involves the electrostatic attraction between oppositely charged ions, and is the primary interaction occurring in ionic 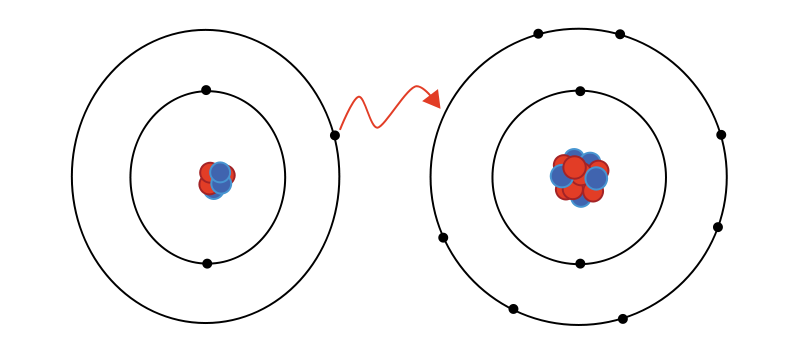 compounds. compounds.Representation of ionic bonding between lithium and fluorine to form lithium fluoride. Lithium has a low ionization energy and readily gives up its lone valence electron to a fluorine atom, which has a positive electron affinity and accepts the electron that was donated by the lithium atom. 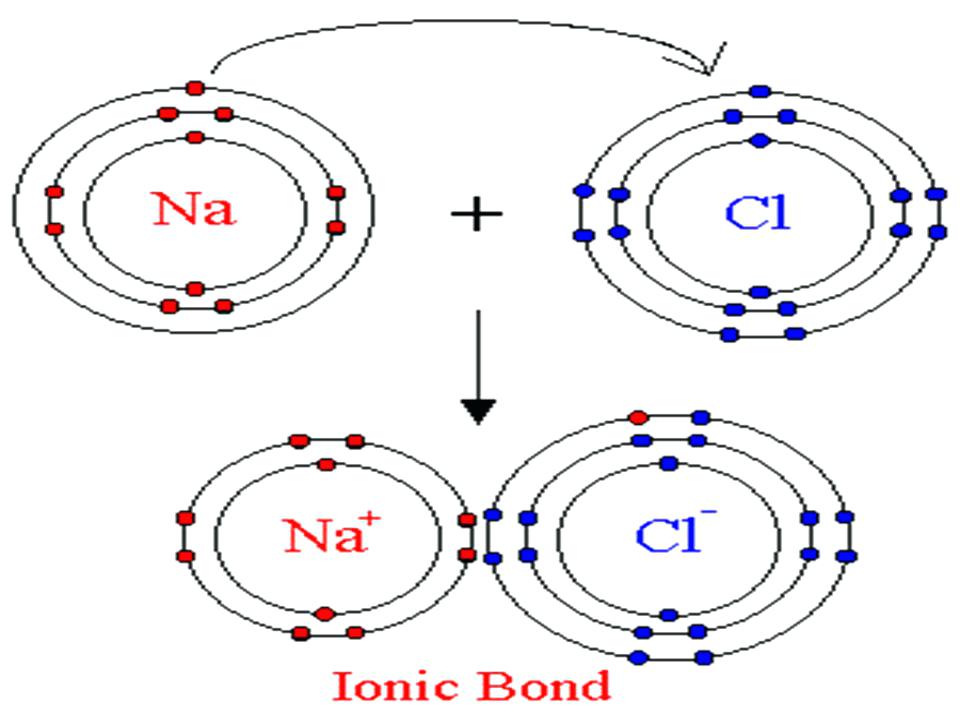 Пәндік лексика мен терминология: Кристалдық тор- crystal cell Иондық кристалдық тор-Ionic crystal cell Молекулалық кристалдық тор-Molecules crystal cell Атомдық кристалдық тор- Atomic crystal cell Металдық кристалдық тор- Metallic crystal cell Глоссари Кристалдық тор – кристалл заттардағы атомдардың, иондардың, молекулалардыңбелгілі бір ретпен орналасуы. Кристалдық тор бір-біріне тығыз орналасқан параллелепипедтерден немесе кубтардан тұрады.  Кристалдар – атомдары, иондары және молекулалары периодты түрде құрылым түзіп, реттілікпен орналасатын қатты денелер. Кристалдық тор – кристалдағы атомдар, молекула немесе иондардың кеңістікте периодты түрде реттілікпен орналасуы. Заттың кристалдық күйі бөлшектердің ретпен орналасуына байланысты сипатталады. Types of Crystals Although there is no unique way to classify all the crystalline solids found in nature, even then these are divided into four important types on the basis of chemical binding of the constituent atoms. 1. Ionic Crystals: These are formed by a combination of highly electropositive ions (cations) and highly electronegative ions (anions). Thus strong electrostatic force of attraction acts within the ionic crystals. Therefore, a large amount of energy is required to separate ions from one  another. The type of the crystal lattice depends upon (i). The size of the ion (ii). The necessity for the preservation of electrical neutrality. Therefore alternate cations and anions in equivalent amount are arranged in the ionic crystal e.g. NaCl, KF, CsCl, 2. Covalent Crystals: These are formed by sharing of valence electrons between two atoms resulting in the formation of a covalent bond. The covalent bonds extend in two or three dimensions forming a giant interlocking structure called network. Diamond, silicon, quartz and graphite are good examples of this type. 3. Molecular Crystals: In these crystals, molecules occupy the lattice points of the unit cells, except in solidified noble gases in which the units are atoms, where the binding is due to van der Waals’ forces and dipole-dipole forces. Since van der Waals’ forces are non-directional, hence structure of the crystal is determined by geometric consideration only. Solids like 4. Metallic Crystals: These are formed by a combination of atoms of electropositive elements. These atoms are bound by metallic bonds. It may be defined as: Types of Crystals Although there is no unique way to classify all the crystalline solids found in nature, even then these are divided into four important types on the basis of chemical binding of the constituent atoms. 1. Ionic Crystals: These are formed by a combination of highly electropositive ions (cations) and highly electronegative ions (anions). Thus strong electrostatic force of attraction acts within the ionic crystals. Therefore, a large amount of energy is required to separate ions from one  another. The type of the crystal lattice depends upon (i). The size of the ion (ii). The necessity for the preservation of electrical neutrality. Therefore alternate cations and anions in equivalent amount are arranged in the ionic crystal e.g. NaCl, KF, CsCl, 2. Covalent Crystals: These are formed by sharing of valence electrons between two atoms resulting in the formation of a covalent bond. The covalent bonds extend in two or three dimensions forming a giant interlocking structure called network. Diamond, silicon, quartz and graphite are good examples of this type. 3. Molecular Crystals: In these crystals, molecules occupy the lattice points of the unit cells, except in solidified noble gases in which the units are atoms, where the binding is due to van der Waals’ forces and dipole-dipole forces. Since van der Waals’ forces are non-directional, hence structure of the crystal is determined by geometric consideration only. Solids like 4. Metallic Crystals: These are formed by a combination of atoms of electropositive elements. These atoms are bound by metallic bonds. Конверттегісұрақтар» Сабақтыбекітумақсатындадарындыбаламенүлгерімітөменоқушыменжұмысжүргізуүшінтабандылықтыдамытуғаарналғанкеңейтілгентапсырмаларұсынылады. Деңгейліктапсырмалардыорындаубарысындаоқушылардытабандылыққадағдыландыруүшін«Бағдаршам» әдісіқолданылады. Тапсырмаларглоссаригенегізделіпжасалады. Әроқушыкез – келгеняғниөтілгентақырыптансұраққояалады. Өткендісаралау: . Топшама № 1 А) Ковалентті байланыс дегеніміз не? Ә) Химиялық байланыс түрлері мен бейорганикалық қосылыстардың кластарына ажыратыңдар: HF, H2, Br2O7, SiO2, F2, HNO3 Топшама № 2 А) Ковалентті полюссіз байланыс дегеніміз не? Ә) Химиялық байланыс түрлері мен бейорганикалық қосылыстардың кластарына ажыратыңдар: H2SO4, O2, CI2O7, SO2, B2O7, CI2 Химиялық пирамиданың шыңына шығу жолы – қосылыстардағы ионды химиялық байланыс. Осы заттардағы байланыстың түзілу сызбасын сызыңдар. 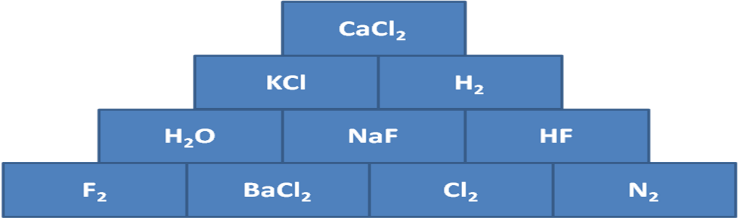 № 2 «Крестиктер-ноликтер» ойынын ойнаңдар. Барлығы ионды байланыспен түзілген заттардан тұратын тік, көлденең немесе қиғаш жолақты табыңдар. Осы заттардағы ионды байланыстың түзілу жолын сызыңдар. 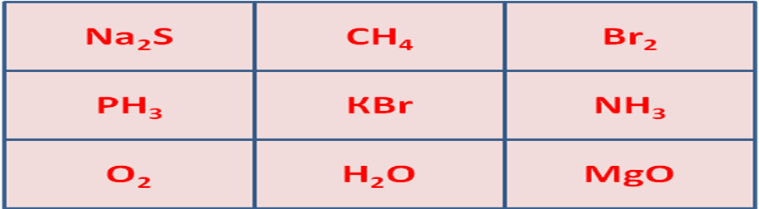 Өзіңді өзің тексер:
HCl, O2, H2S, SO2, OF2, Br2, H2, PCl3, CH4 Оқушыныңдербестігі,өз-өзінесеніміқалыптасады 5. Пайымдау Жекеоқушыларойынжинақтап, түйінтүюәрекетінжасайды. Білімдерінқорытындылаумақсатындабір-бірінесынисұрақтарқояды. ІІІТолғаныс Венндиаграммасы: Иондықжәнековаленттібайланыс Өзбілімінбағалауғадағдыланады, сыныппенарадағыынтымақтастықпайдаболады. 6. Бағалау Қойылғанпроблеманыңөзіүшінқұндылығыныңнедеекендігінекөзінжеткізу. оқушыларөздерінбағалайды. Жұптықжұмыс : Оқушыларжұптасыпқосымша3 орындайды. Бірбіріменалмасаотырып , тексереді. Қажет болған жағдайда мұғалім көмектеседі.
Жеке жұмыс: Оқушылар өз бетінше қосымша 4 тапсырмасын орындайды. Бір бірімен алмаса отырып , тексереді. Қажет болған жағдайда мұғалім көмектеседі. АВС заттарының кейбір физикалық қасиеттері берілген Әр заттардың кристалл торларын анықтаңыз, өз жауабыңызды түсіндіреді. Қажет болса мұғалім тексеріп кері байланыс жасайды. Сабақты қорытындылау . Мақсаттарға оралу Қорытындылау бойынша сұрақтар қою.
Алғанбілімінөмірдепайдалануғадағдыланады. | | ||||
| Үйге тапсырма: | Жаңа сөздерді жаттау; Глоссаримен жұмыс жасау; Оқылық соңындағы тапсырмалар 37-38тақырып қайталау. 1-3 тапсырма, 170 бет | | ||||
Оқушыларглоссарименжүргізілгенсабақбарысындатиянақтылыққажәнеойынқысқыәрінұсқажүргізугеүйренеді. Менпрактикабарысындаағылшынтіліндехимиянықалай, қандайәдістерменжетікмеңгертугеболатыныжөніндекөпойландым. Ойланакелеекітілдежүргізілгенглоссаридіңоқушыларғаағылшынтіліндехимиядананықтамажаттатудақолайлыәдісдепбілемін. Нәтижедеоңбағаберді, балаларғабастыпқыдаүйренесеалмағаныменкейінсабақтыңқызықтыөткенінуақыттытиімдіпайдаланудадатиімдіекенінбайқады.
Оқушылардан алынған сауалнама.
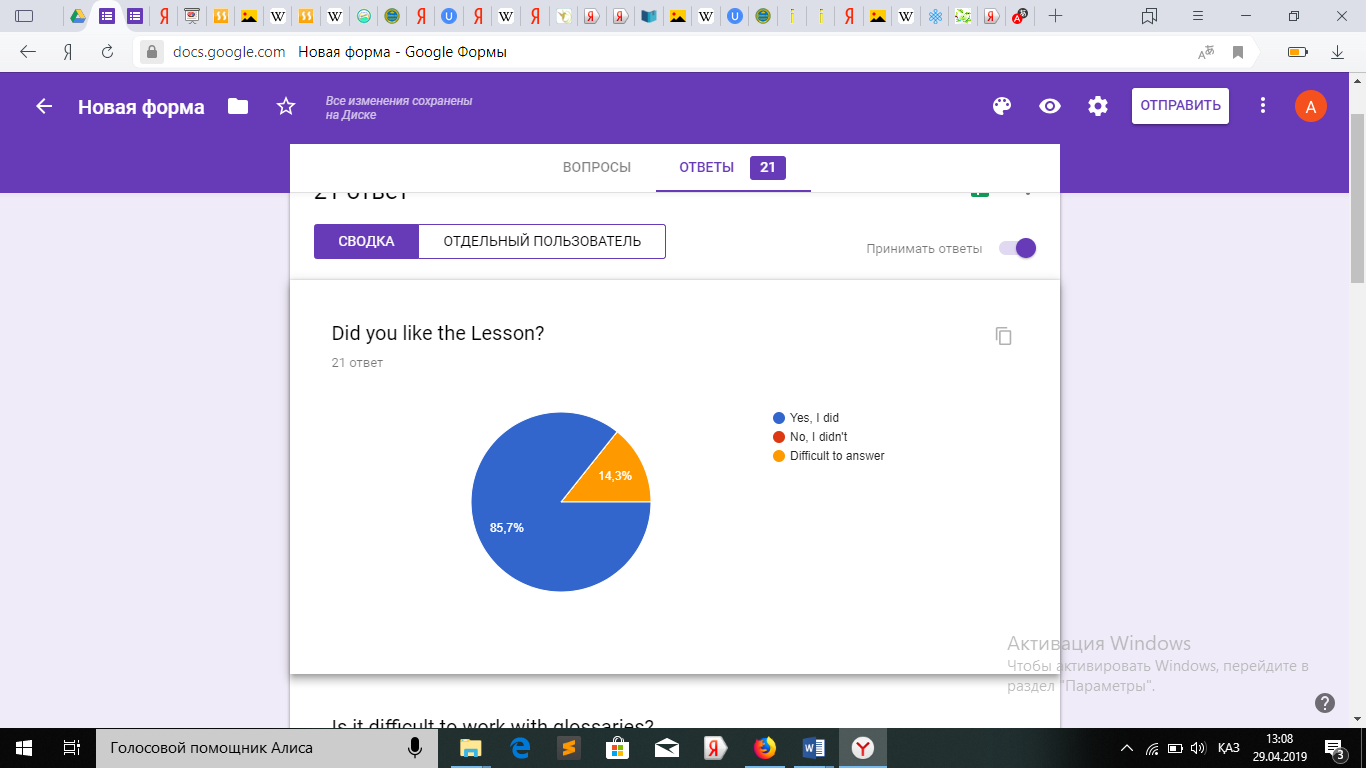
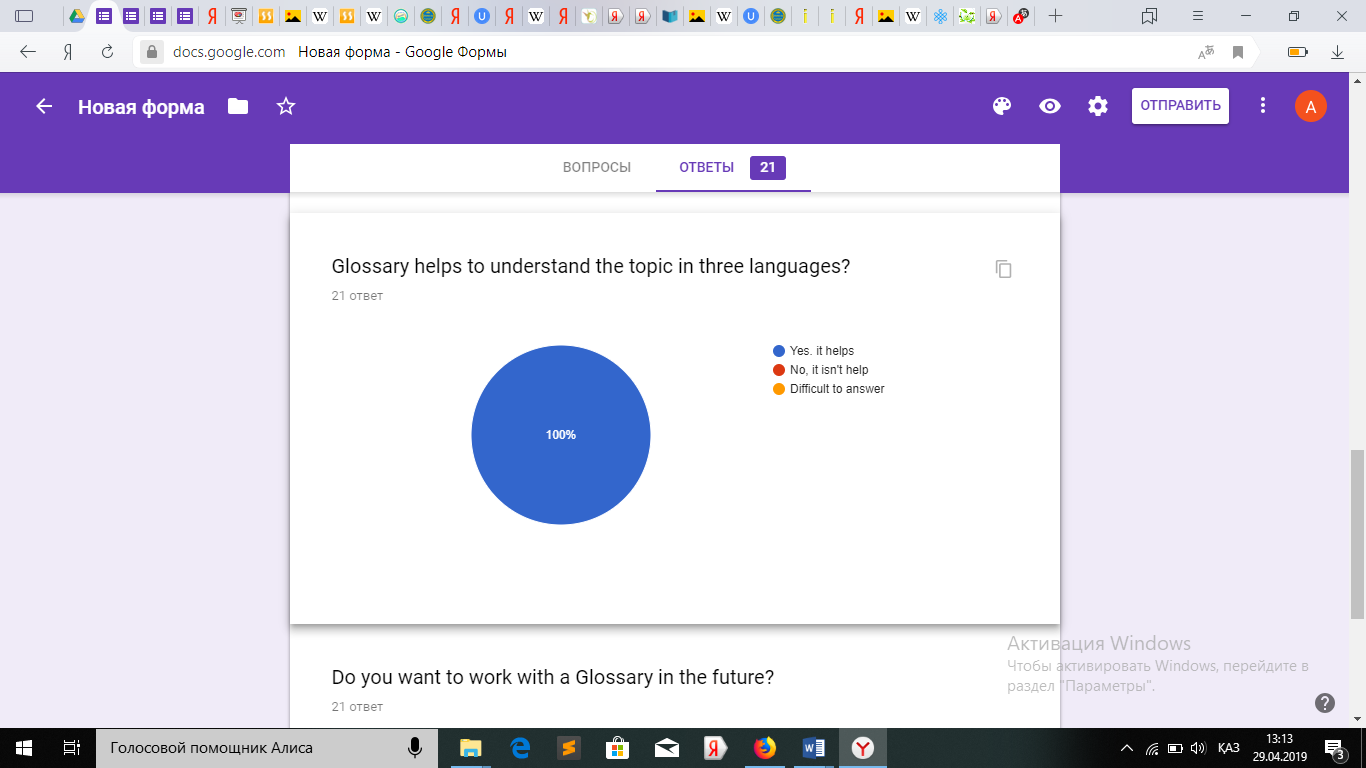
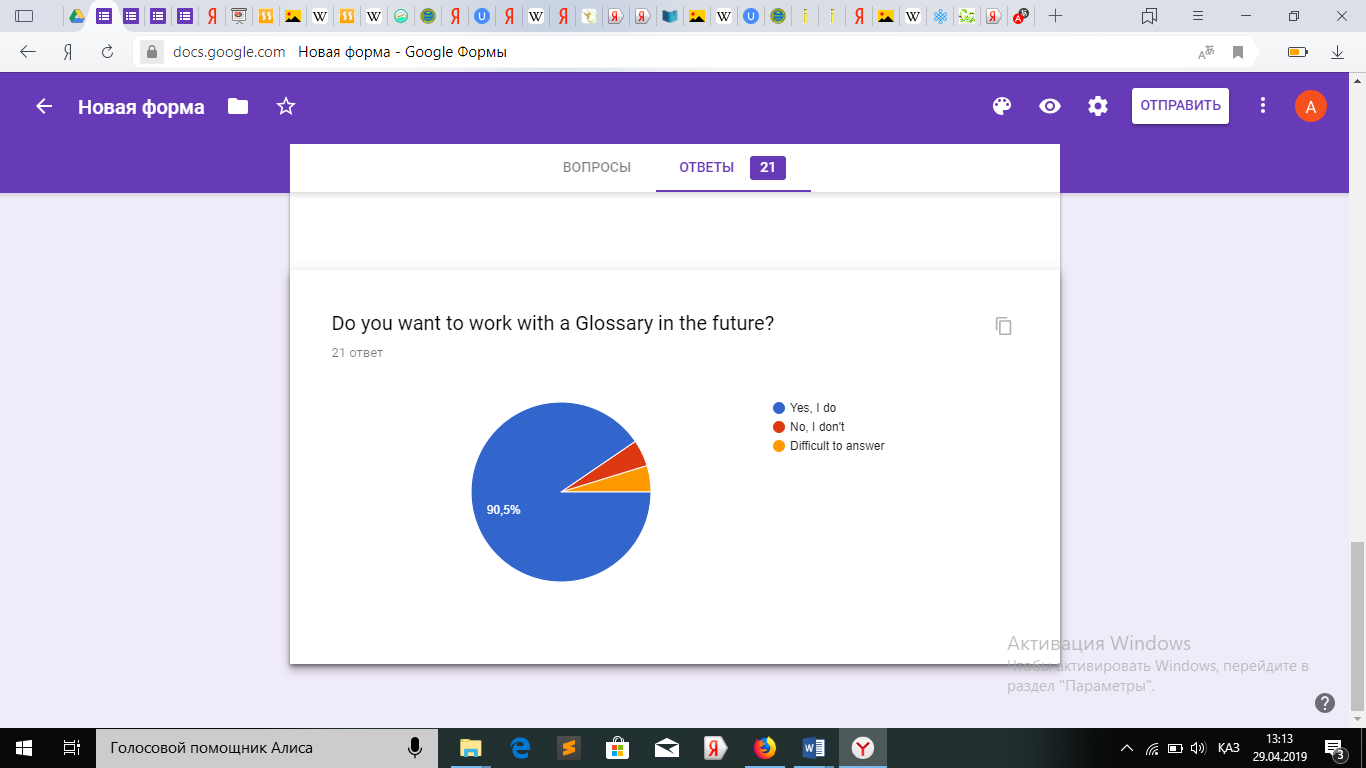
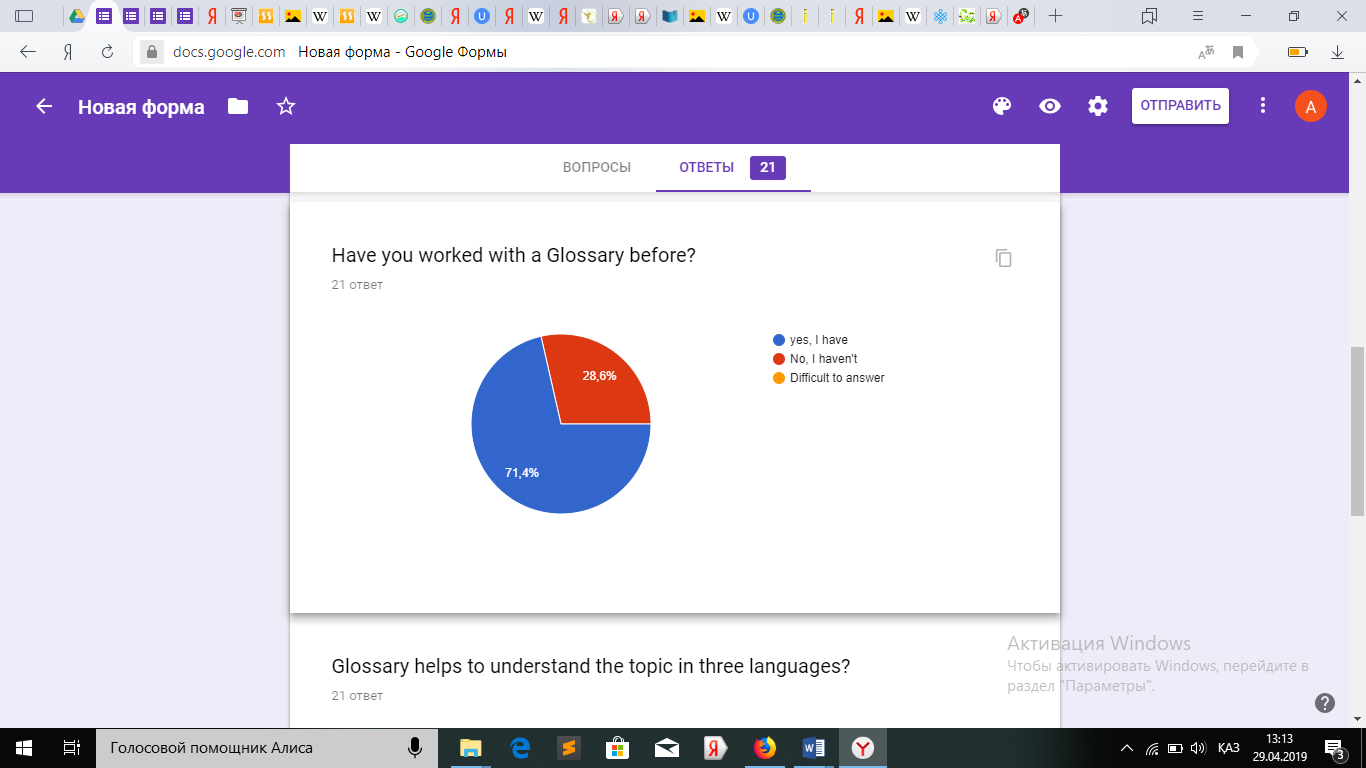
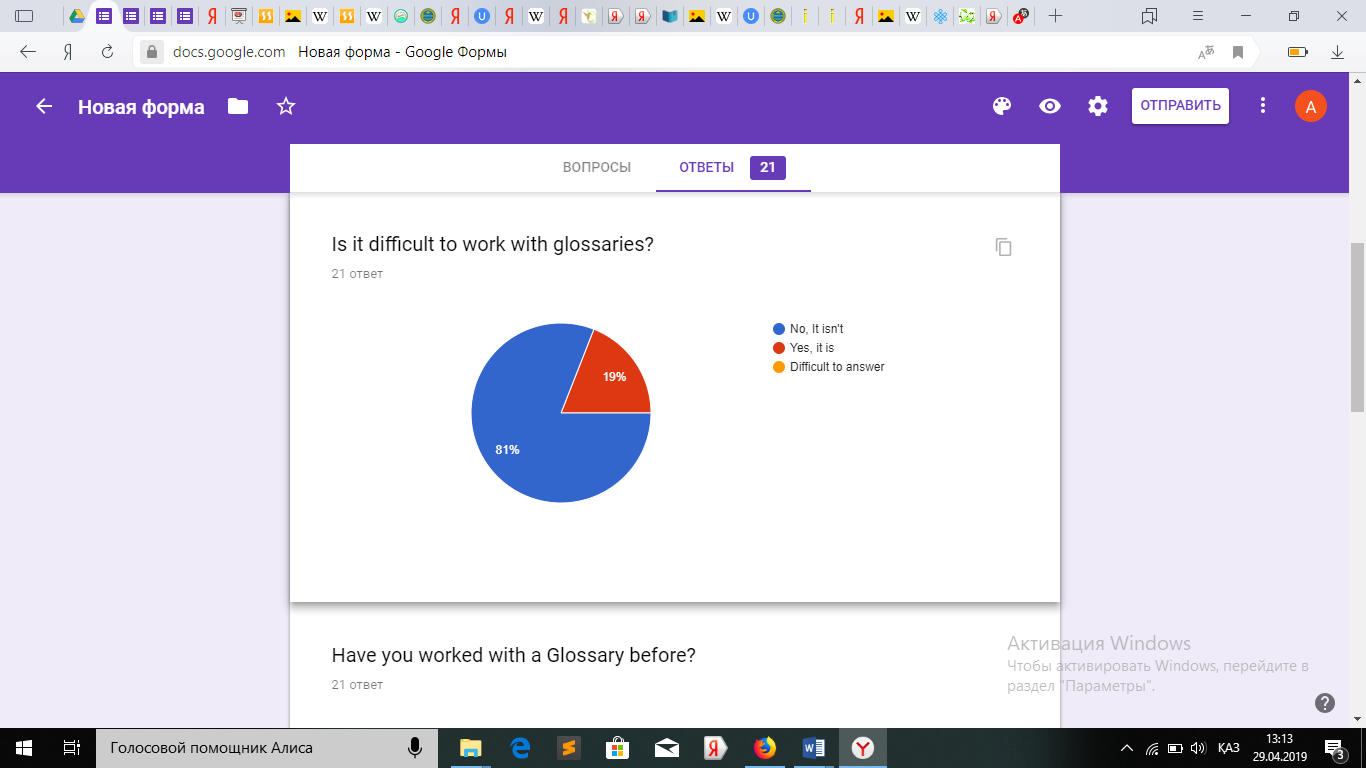 Қорытындыретіндесауалнамадансоңоқушылардыңглоссарименжұмысжасауғаынтасыныңбарекенінжәнеоқудажақсынәтижегеқолжеткізетінінбайқадам.
Қорытындыретіндесауалнамадансоңоқушылардыңглоссарименжұмысжасауғаынтасыныңбарекенінжәнеоқудажақсынәтижегеқолжеткізетінінбайқадам.3.4СабақбарысындаҮштілденегізделіпқұрастырылғанмәтінменжұмыс
| Сабақтың тақырыбы: Қышқылдар. Тұздар | Мектеп: Түркістан мамандандырылған Н.Оңдасынов атындағы мектеп интернаты | |||||||||||||||||||||||||||||||||||||||||||||||||
| Күні: | Мұғалімнің аты-жөні: Байсалова Асылнұр | |||||||||||||||||||||||||||||||||||||||||||||||||
| СЫНЫП: 8 | Қатысқандар саны: | Қатыспағандар саны: | ||||||||||||||||||||||||||||||||||||||||||||||||
| Сабақ негізделген оқу мақсаты (мақсаттары) |
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Тілдік мақсат | Оқушылар:
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Жоспар | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Жоспарланған уақыт | Жоспарланған жаттығулар (төменде жоспарланған жаттығулармен қатар, ескертпелерді жазыңыз) | Ресурстар | ||||||||||||||||||||||||||||||||||||||||||||||||
| Басталуы 5 мин | Сәлемдесу; ( Ағылшын тілінде) Сыныпта жағымды атмосфера қалыптастыру; Түрлі түсті қағаздан жасалған қима арқылы топқа бөлу; Топбасшыларын сайлату; Бағалау парақшасын тарату; «Сандар сөйлейді» әдісі арқылы жаңа тақырыпқа байланысы бар өткен сабақтағы ұғымдар мен анықтамаларды еске түсіру; «Ой қозғау»
| презентация | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ортасы Түсіндіру | Үш тілге негізделіп жасалған мәтінмен жұмыстар жүргізу. Қайталау сабағын тілдік дағды қалыптасу мақсатында жүргізіледі. «Қышқыл жаңбырлар және олардың қоршаған ортаға әсері» One of the environmental problems of our time is acid rain. Rainwater should be one of the cleanest waters, but not like that. Production wastes that are part of the atmosphere – sulfur dioxide and nitrogen oxide interact with moisture in it, form sulfuric and nitric acids. As a result of precipitation and snow oxidized, pH is usually called acid rain with precipitation less than 5.6. Acid rain increases the acidity of the water in the lakes. From year to year increases the acidity of lakes in southern Canada, Sweden, Finland. The oxidation of the lake and pollution by heavy metal ions pose a threat not only to the fertilization of fish, but also to the destruction of plankton, algae and other lives, as well as to human health. Leakage of the oxidized metal water pipes dissolve the metals and form them with toxic ions. In the area of new York was filled with acidic water in a lead dish and on one night the number of ions of the metals exceeded the corresponding amount. Sulfuric acid, dissolved in raindrops, forms a fog in the atmosphere, contributes to the disease of people with allergies and other diseases. Одна из экологических проблем нашего времени-кислотные дожди. Дождевая вода должна быть одной из самых чистых вод, но не такой. Отходы производства, входящие в состав атмосферы – диоксид серы и оксид азота, взаимодействуют с влагой в ней, образуют серную и азотную кислоты. В результате выпадения осадков и окисления снега рН обычно называют кислотным дождем с осадками менее 5,6. Кислотные дожди повышают кислотность воды в озерах. Из года в год повышается кислотность озер на юге Канады, Швеции, Финляндии. Окисление озера и загрязнение ионами тяжелых металлов представляют угрозу не только для оплодотворения рыб, но и для уничтожения планктона, водорослей и других живых существ, а также для здоровья человека. Утечка окисленных металлических водопроводных труб растворяет металлы и образует их с токсичными ионами. В районе Нью-Йорка была залита кислотная вода в свинцовой посуде и за одну ночь количество ионов металлов превысило соответствующее количество. Серная кислота, растворенная в каплях дождя, образует туман в атмосфере, способствует заболеванию людей аллергией и другими заболеваниями.
Bases are complex substances dissociated in solutions to form one or more hydroxide ions. If the element forms several hydroxides, the degree of oxidation is indicated by a Roman numeral. For example, cu (OH)2 – Copper (II) hydroxide, CuOH copper (I) hydroxide. Most bases do not dissolve in water or dissolve slightly. Water-soluble bases are called alkalis.The composition of the base includes a hydroxide word in the name of the slope of the metal. For example, NaOH is sodium hydroxide. This rule is suitable for monovalent metals. Основания-это сложные вещества диссоциируют в растворах с образованием одного или нескольких гидроксид-ионов. Если элемент образует несколько гидроксидов, то степень окисления указывается римской цифрой. Например, cu (OH)2 – гидроксид меди (II), cu OH гидроксид меди (I). Большинство оснований не растворяются в воде или растворяются незначительно. Водорастворимые основания называются щелочами. В состав основания входит гидроксидное слово в названии склона металла. Например, NaOH-гидроксид натрия. Это правило подходит для одновалентных металлов.
«Конверттегі сұрақтар» Бұл жерде оқушылар бір біріне өткен тақырыптан қазақша анықтама береді, оқушылар орыс, ағылшын тілінде жазу керек. Бірақ анықтама кемі үш – бес сөйлем көлемінде болу керек. | презентация | ||||||||||||||||||||||||||||||||||||||||||||||||
| Аяқталуы | Оқушылардың тақырып бойынша білім деңгейін тексеру үшін «Екі жұлдыз, бір тілек» әдісі арқылы кері байланыс жүргізіледі. Бағалау кезінде топбасшылар бағалайды,оқушының өзін-өзі бағалауы іске асады, ең соныңда жиынтықтық бағалау шығады. Жалпы сабақ бойынша кері байланыс бағалау ағашы бойынша жүзеге асады. | презентация | ||||||||||||||||||||||||||||||||||||||||||||||||
| Үйге тапсырма: | Жаңа сөздерді жаттау; Глоссаримен жұмыс жасау; Үш тілдегі тақырыппен қайталау жұмыстарын жүргізу. | | ||||||||||||||||||||||||||||||||||||||||||||||||
Үш тілге негізделген мәтінмен жұмыс жүргізу өте тиімді. Оқушылардың сабаққа деген қызығушылығы артады. Түсініп оқу, қорытынды жасау , сұраққа жауап іздеу және де жылдам ойлау қабілеті артады.
Сабақ соңында оқушылардан сауалнама алдым.

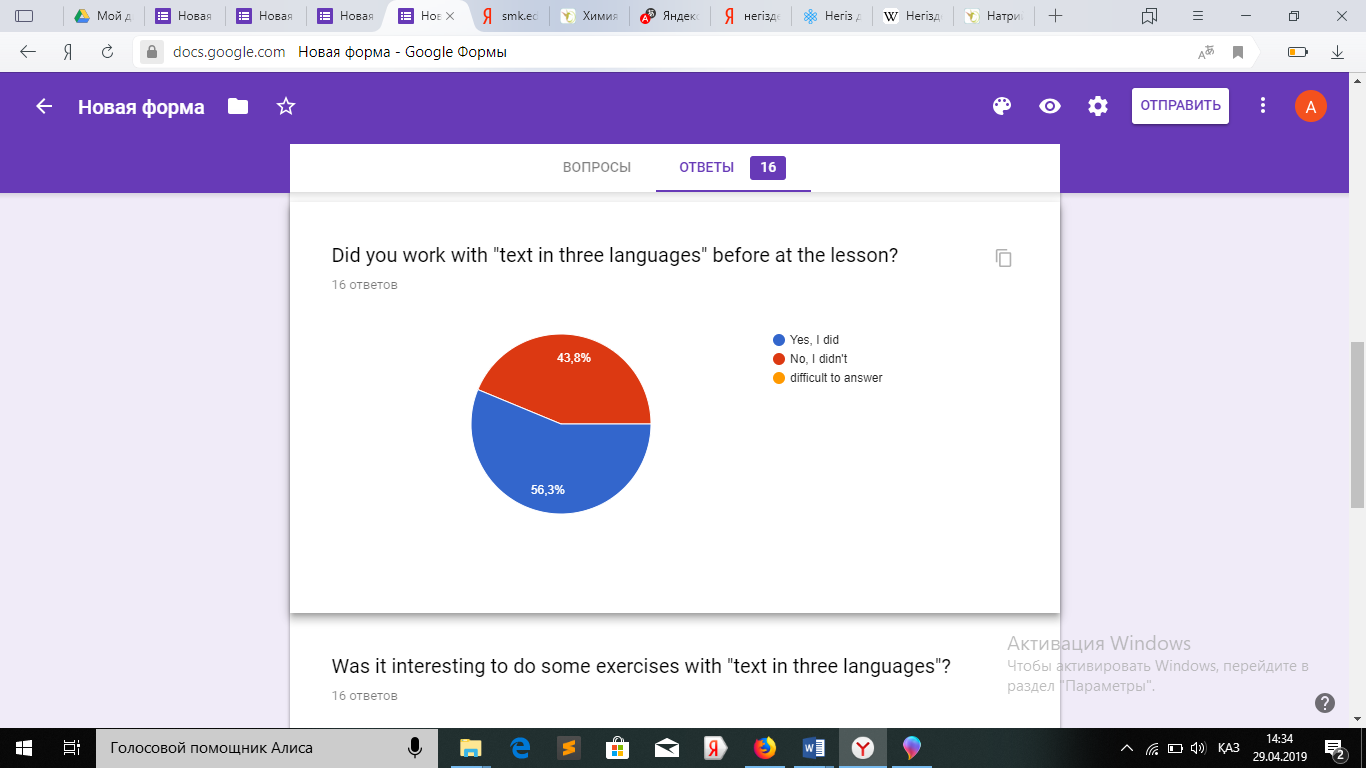

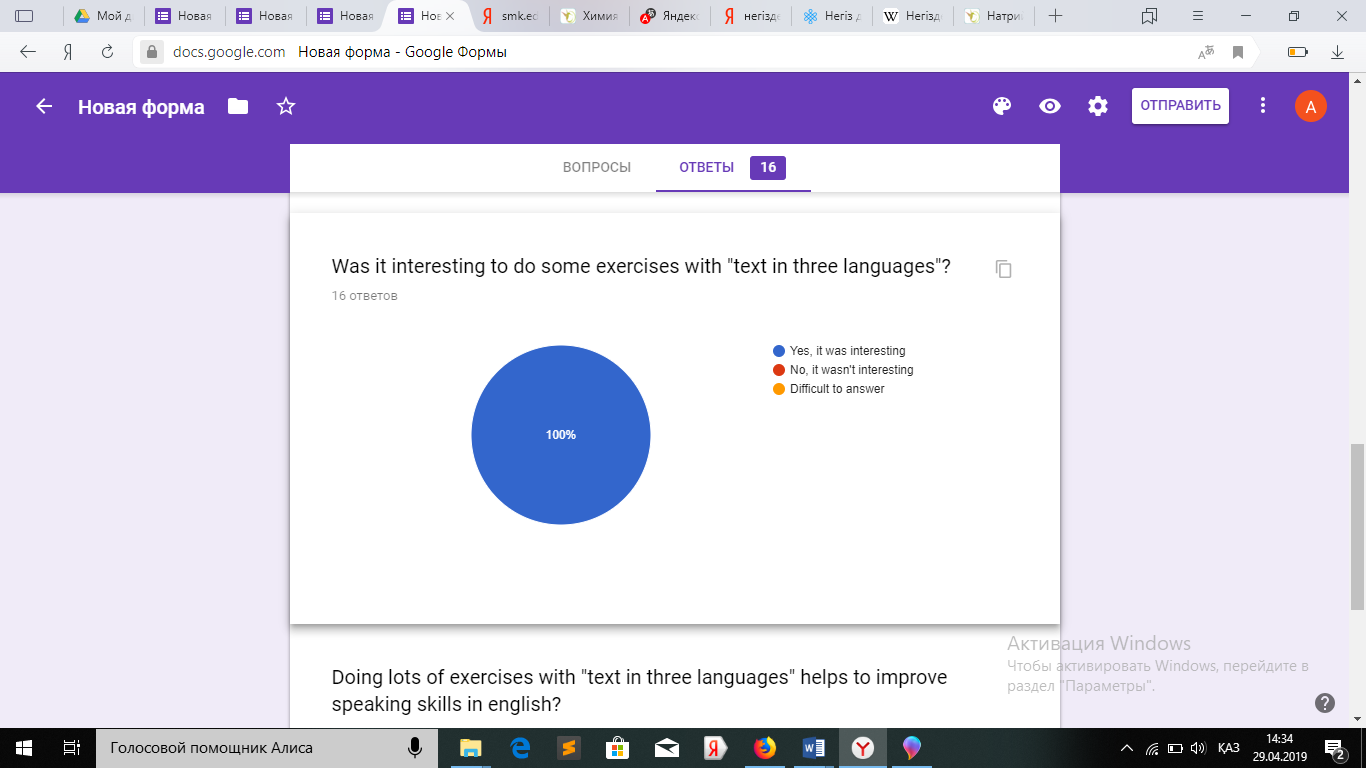

Сауалнама нәтижесі оқушылардың сабақты ұнатқанын, сабақ барысын түсінгенін көрсетеді.
Қорытындылац келе үш тілде енгізделіп жасалған жұмыспен жиі жұмыс жасау оқушылардың химияны ағылшын тілінде меңгеруіне толық мүмкіндік береді. Химиямен қатар сөздік қоры көбейетіндігі байқалады.
3.5 Есептеулерді үйретуде ағылшын тілін қолдану
Ағылшын тілінде сесптеулер жүргізу барысында оқушыларға алдымен қазақша есептер шығартып үйрету керек. Оқушы есептің мазмұнын түсіну керек, есептеу нәтижесінде қандай нәрсе табылып жатыр, осының барлығын бірінші ана тілінде болуы жөн.
Мен сабақ беру барысында бірінші жаңа тақырыпты өтіп кейін оқушылырға сол сабаққа қатысты жаңа сөздерді үш тілде жаздырып, оқытып тағы қосымша жоғарыда келтірілген үш тілге қатысты мысалдар келтіріп болған соң ғана есептеулерге көшетінмін. Бұл маған жаңа бағдарламамен оқып қайтқан ағаймның кеңесі.
Есептеу барысында алдымен өткен тақырыбымызға қатысты қазақ тілінде есептеулер жүргіземіз.
Ерітінді тақырыбына есептеулер.
Массасы 20 г зат 190 г ерітіндіде болса, осы ерітіндідегі еріген затттың масссалық үлесін табыңдар. (10,53)
Масссасы 300 г, 35% -дық ерітінді дайындау үшін қанша тұз, анша су керек ? (105г тұз, 195г су)
Массасы 45 г тұзды көлемі 2200 мл суда еріткенде түзілген ерітіндідегі еріген заттың масссалық үлесін есептеңдер. (2%)
Массалық үлесі 12% дық ерітінді дайындау үшін көлемі 250 мл суда қанша зат еріту қажет (34,09)
Массасы 274 г ерітіндіде 74 г ас тұзы ерісе оның массалық үлесі қанша?
Осы есептердің шығару жолын енді ағылышын тілінде жүргіземіз.
| Ерітінді | Раствор | Solution |
| Еріген зат | Растворенное вещество | Solute |
| Еріткіш | Растворитель | Solvent |
| Ерігіштік | Растворимость | Solubility |
| Аз ериді | Мало растворим | Slightly soluble |
| Ерімейді | Не растворим | Insoluble |
| Еру | Растворение | Dissolution |
| Қанықпаған | Ненасыщенный | Unsaturated |
| Қаныққан | Насыщенный | Saturated |
| Араластыру | Перемешивание | Stirring |
| Қалдыру | Оставаться | To remain |
Есептеубастамасбұрынағылшынтерминдерменжұмысжасаймыз.
Бұлесептеудекездесетінтерминология .Бұлсөздербізгеағылшыншаесептіңберілгенінтүсінуүшінкерек. Ендіесепшығарудакеректісөздердіңтерминіментанысболайық.
| Массалық үлес | Массовая доля | Mass percentage |
| Молярлық концентрация | Молярная концентрация | Molar concentration |
| Көбейту | Умножать | To multiply |
| Бөлу | Делить | Делить |
| Дистильденген су | Дистиллированная вода | Distilled water |
| Қатынас | Пропорция | Proportion |
| Байланысты болу | Зависеть | To depend |
| Берілгені | Задоно | Given |
| Табу керек | найти | To Find |
| Шығару жолы | Решение задач | Way to solve |
Есепті шығару барысында кейбір есепеулерді мысалдармен түсіндіру қажет.
Мысалы ерітінді тақырыбында есептеулер күнделікті көріп жүрген тұздар немесе қантқа байланысты есептеулермен жүргізсе болады.

-
20 g sodium reacts with HNO3 nitric acid. Find mass of sodium nitrate?
-
3,9 g Potassium reacts with oxygen, Find mass of potassium oxide. -
25 g salt dissolved in 75 g of water, mass percentage of salt? -
In 25% 50 g mass of solution find mass of solute? -
To 200 g solution added 25 g of salt. Mass percentage of salt. -
In solution 85 g solute and 45 g solvent calculate mass of solution
Химияданағылшыншаесептершығаруарқылыоқушыныңойлауқабілетінарттыруғамүмкіндікбереміз. Түрлітақырыпқаарналғанесептершығаруғаболады. Еңбастысыоқушыесепбарысынтүсінукерек.
ОсылайжеңілденқиынғакөшуарқылыболашақтахимияданхалықаралықолимпиадалардаҚазақелінтанытатынжастарымыздытәрбиелейміз.