ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 158
Скачиваний: 0
СОДЕРЖАНИЕ
Міністерство аграрної політики україни
Лабораторна робота № 1 макроаналіз металів і сплавів
Контрольні питання для самопідготовки
Лабораторна робота № 2 мікроаналіз металів і сплавів
Установка для термічного аналізу
Контрольні питання для самопідготовки
Лабораторна робота № 4 аналіз діаграм стану подвійних систем
Контрольні питання для самопідготовки
Лабораторна робота № 5 діаграма стану сплавів системи залізо - вуглець
Контрольні питання для самопідготовки
Лабораторна робота № 6 вивчення мікроструктур вуглецевих сталей у рівноважному стані
Контрольні питання для самопідготовки
Лабораторна робота № 8 термічна обробка сталей
Контрольні питання для самопідготовки
Лабораторна робота № 9 термічна обробка алюмінієвих сплавів
Вивчення будь-якої діаграми стану подвійної системи складається з двох етапів: 1) її загального опису; 2) аналізу процесу кристалізації типових сплавів. Доцільно поруч з діаграмою стану зображувати криві охолодження сплавів, які аналізуються.
Основні типи діаграм стану.
Діаграми стану системи, компоненти якої утворюють неперервний ряд рідких і твердих розчинів.
Така діаграма є однією з найпростіших. Вона містить у собі всього дві лінії (рис. 4.1). Верхня з них є лінією початку кристалізації будь-якого сплаву цієї системи і називається лінією ліквідусу. Нижня лінія є лінією кінця кристалізації усіх сплавів і є лінією солідусу. Вище від лінії ліквідусу розташована однофазна область рідкого розчину (Р). Нижче від лінії солідусу лежить також однофазна область - твердого розчину. Між цими лініями знаходиться двофазна область, де співіснують обидва розчини (Р+).
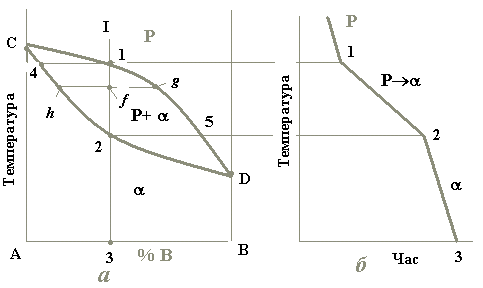
Рис.4.1. Діаграма стану системи, компоненти якої утворюють неперервний ряд рідких і твердих розчинів (а) та крива охолодження типового сплаву (б)
На діаграмі стану точки С і D є температурами кристалізації відповідно компонентів А і В. Сплав же будь-якої концентрації, наприклад, сплав I, кристалізуватиметься в інтервалі температур між точками 1 і 2 і після повного охолодження (точка 3) буде мати остаточну структуру з зерен -твердого розчину (рис. 4.2).
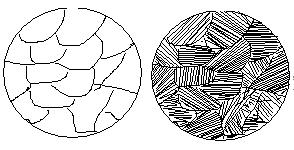
Рис. 4.2. Зображення мікроструктури твердого розчину (сплаву I)
Для більш детального аналізу процесу кристалізації цього сплаву потрібно скористатися правилом відрізків (правилом важеля):
Для визначення хімічного складу фаз, що перебувають у рівновазі одна з одною, через фігуративну точку сплаву проводять горизонтальну лінію до перетину з лініями діаграми, які обмежують дану область; проекції точок перетину на вісь концентрацій показують склади фаз. (Фігуративною точкою називається кожна точка в межах креслення діаграми стану. Вона зображує стан сплаву певного хімічного складу при певній температурі).
В нашому випадку фігуративною точкою є точка f , а точками перетину, про які йде мова, є точки h і g. Пряма hg, що з’єднує ці точки, називається конодою.
Правило відрізків (важеля) дозволяє визначити не лише хімічний склад фаз, але й їхню відносну й абсолютну кількість:
Для визначення кількості кожної фази через фігуративну точку проводять коноду; її відрізки обернено пропорційні кількості кожної з фаз.
Наприклад, у точці f у рівновазі знаходяться рідина складу точки g і -фаза концентрації точки h. При цьому:
![]() ,
,
![]()
Якщо скористатися цим правилом при аналізі процесу кристалізації сплаву I, то виявляється, що з рідини концентрації точки 1 виділяються кристали -фази концентрації точки 4, тобто зовсім іншого складу.
Твердий розчин відносно рідини завжди збагачений тим компонентом, який підвищує температуру кристалізації сплавів.
У нашому випадку таким компонентом є А, отже, при будь-якій температурі -фаза щодо рідкого розчину збагачена саме ним. При зниженні температури склад рідини змінюється вздовж лінії ліквідус від точки 1 до точки 5, а склад -фази – по лінії солідус від точки 4 до точки 2 (рис.4.1).
Діаграми стану систем з відсутністю взаємної розчинності компонентів у твердому стані
В діаграмах стану такого типу додавання як компонента В до компонента А, так і навпаки компонента А до компонента В, спричинює зниження температур кристалізації сплавів. З цієї причини лінія ліквідусу такої системи (рис. 4.3) опускається донизу з точок С і D. Обидві гілки лінії ліквідусу (СЕ і DE) перетинаються в точці Е. Кожна з цих гілок є як лінією початку кристалізації того або іншого компонента (СЕ – компонента А, DE – компонента В), так і лінією граничного насичення рідкого розчину відповідними компонентом: на лінії СЕ рідина гранично насичена компонентом А і при подальшому зниженні температури відбувається його кристалізація; на лінії ED – компонентом В, який теж буде кристалізуватися при подальшому охолодженні. Точка Е є спільною для обох кривих, отже, рідина такого складу гранично насичена обома компонентами, вони й будуть кристалізуватися одночасно і разом: РЕ (А+В) (читається: рідина складу точки Е перетворюється в суміш двох фаз, тобто компонентів А і В).
Суміш двох твердих фаз, які кристалізуються одночасно і разом з рідини певного складу, називається евтектикою.
У кристалізації евтектики беруть участь три фази і згідно з правилом фаз система є нонваріантною, тобто кристалізація евтектики йде при постійній температурі, що й видно на кривих охолодження.
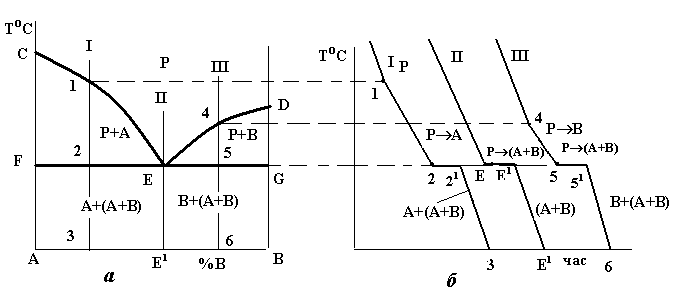
Рис.4.3. Діаграма стану (а) і криві охолодження (б) системи з відсутністю взаємної розчинності компонентів у твердому стані
При кристалізації будь-якого сплаву цієї системи склад рідини буде змінюватися вздовж лінії ліквідусу до евтектичної точки Е, тобто кристалізація усіх сплавів закінчується утворенням евтектики. Оскільки це відбувається при постійній і однаковій для всіх сплавів температурі, то лінія солідусу даної системи є горизонтальною прямою FEG, яка називається лінією евтектичного перетворення.
Евтектична точка Е ділить усі сплави на доевтектичні (ліворуч від точки Е) та заевтектичні (справа від точки Е). В окрему групу виділяється евтектичний сплав (на рис.4.3, а) сплав II).
Розглянемо процеси кристалізації типових сплавів цієї системи. Доевтектичний сплав I кристалізується у два етапи. На першому в інтервалі температур 1-2 з рідини кристалізуються первинні кристали компонента (фази) А; потім в точці 2 рідина, що залишилася, закристалізується у вигляді евтектики. Отже, нижче точки 2 до точки 3, тобто до повного охолодження, сплав I буде мати структуру з двох складових: первинних кристалів компонента А та евтектики (суміші двох компонентів А і В) (рис. 4.4, а). Кількісний склад цих складових може бути визначено за правилом важеля . Так, кількість евтектики дорівнює відношенню довжини відрізка А-3 до довжини коноди А-Е1 , а кількість фази А (компонента А) - відношенню довжини відрізка 3-Е1 до довжини А-Е1, тобто:
![]()
![]()
Евтектичний сплав II має всього один етап кристалізації – утворення евтектики, і, таким чином, одну структурну складову – евтектику (рис.4.4, б).
Заевтектичний сплав III кристалізується подібно до доевтектичного, але на першому етапі кристалізації з рідини виділяються кристали компонента В. Таким чином, кінцева структура заевтектичного сплаву складається з цих первинних кристалів і ділянок евтектики (рис. 4.4, в).
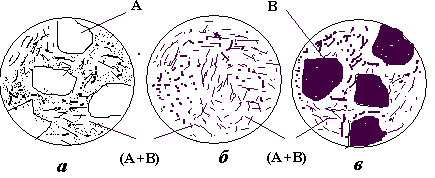
Рис. 4.4. Схеми мікроструктур доевтектичного (а), евтектичного (б) та заевтектичного (в) сплавів
Діаграми стану систем з обмеженою розчинністю компонентів у твердому стані.
Такі типи систем найчастіше мають місце в металевих сплавах. При утворенні обмежених твердих розчинів зустрічаються два типи діаграм стану: з евтектичним і з перитектичним перетворенням.
Діаграма стану систем з утворенням обмежених твердих розчинів і евтектичним перетворенням (рис.4.5)
Лінією ліквідусу на цій діаграмі є лінія СЕD, а лінією солідусу – лінія CFEGD. На горизонтальній частині цієї лінії FEG відбувається евтектичне перетворення: РЕ (F +G (читається: рідина складу точки Е перетворюється в суміш двох фаз - -твердого розчину складу точки F і -твердого розчину складу точки G) , де і - обмежені тверді розчини компонента В у компоненті А () і компонента А в компоненті В ().
Крім цих ліній на діаграмі є і дві нові – лінії так званого сольвусу, тобто обмеженої розчинності у твердому стані – FH і GI. Перша з них показує границю розчинності компонента В у компоненті А, тобто граничний вміст компонента В в -твердому розчині. Відповідно, лінія GI є граничним вмістом компонента А в -твердому розчині. З положення цих ліній видно, що взаємна розчинність компонентів із зниженням температури зменшується.
Вказані лінії діаграми ділять її площу на 3 однофазні та 3 двофазні області. До однофазних належать область рідкого розчину (вище лінії ліквідусу CED), область CFHA -фази і область DGIB -фази. Двофазними є області CEF і DEG, в яких відбувається кристалізація первинних кристалів відповідно - і -твердих розчинів, а також область існування двох твердих розчинів і - HFGI.. В цій області відбувається вторинна кристалізація, в якій, на відміну від первинної, не бере участі рідка фаза. Вторинна кристалізація полягає в тому, що після первинної кристалізації будь-якого сплаву, що лежить між точками H і I, і в складі структури якого є - чи -тверді розчини, ці тверді розчини при подальшому охолодженні до температур ліній сольвусів FH чи GI стають насиченими, а нижче цих ліній – перенасиченими. Оскільки стан перенасиченого твердого розчину є незрівноваженим, починається його розпад із виділенням надлишкового компонента.
Н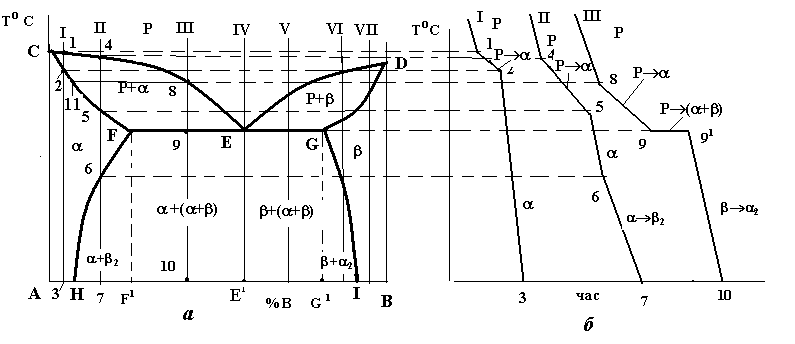 айчастіше
це відбувається на межах зерен відповідного
твердого розчину у вигляді окремих
дисперсних часток або суцільних прошарків
(див.рис.4.6).
айчастіше
це відбувається на межах зерен відповідного
твердого розчину у вигляді окремих
дисперсних часток або суцільних прошарків
(див.рис.4.6).
Рис. 4.5. Діаграма стану (а) і криві охолодження (б) системи з обмеженою розчинністю компонентів у твердому стан і евтектичним перетворенням
Як приклад розглянемо процеси кристалізації двох сплавів II і III. Первинна кристалізація сплаву II відбувається в інтервалі температур 4-5, де вся рідина закристалізується у вигляді -твердого розчину. До точки 6, яка знаходиться на лінії сольвусу FH , цей розчин є ненасиченим компонентом В, у точці 6 він стає гранично насиченим, а нижче від неї – перенасиченим і при подальшому його охолодженні до точки 7 з нього виділяється надлишковий елемент – компонент В у вигляді -твердого розчину (рис.4.6).
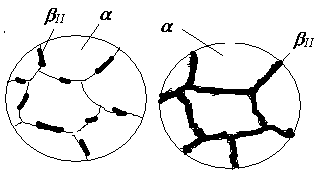
Рис.4.6. Схеми мікроструктури сплаву II (рис.4.5)
Таку остаточну структуру мають усі сплави в області FHF1 діаграми. Оскільки вторинна кристалізація відбувається в твердому стані при невисоких температурах, дифузія йде досить повільно і вторинна кристалізація за описаним механізмом може відбутися достатньо повно тільки в умовах дуже повільного охолодження. В реальних же умовах кристалізації зберігається певне перенасичення -фази компонентом В. Але перенасичений твердий розчин є нестійким і в подальшому довільно розпадається, що супроводжується суттєвою зміною властивостей сплаву, перш за все - механічних: підвищенням твердості та міцності, зниженням пластичності і в’язкості. Таке явище називається старіння або дисперсійне твердіння, яке широко використовується при термічній обробці кольорових металів, зокрема алюмінієвих сплавів (див. лаб.роботу № 9).
Аналогічно відбувається кристалізація сплавів, що знаходяться між точками G та I (наприклад, сплаву VI) . Тільки в цих сплавах перенасиченим розчином є -твердий розчин і з нього виділяється при охолодженні нижче лінії GI надлишковий компонент А у вигляді -твердого розчину.
Кристалізація сплаву III відбувається в три етапи. На першому з них, в інтервалі температур 8-9, з рідини виділяється первинні кристали -фази. Склад рідини при цьому змінюється вздовж лінії ліквідусу від точки 8 до евтектичної точки Е, а склад -фази – по лінії солідусу від точки 11 до точки F. Другим етапом є евтектична кристалізація в точці 9:
РЕ (F +G).