ВУЗ: Национальный исследовательский томский политехнический университет
Категория: Учебное пособие
Дисциплина: Химия
Добавлен: 09.02.2019
Просмотров: 9536
Скачиваний: 56
26
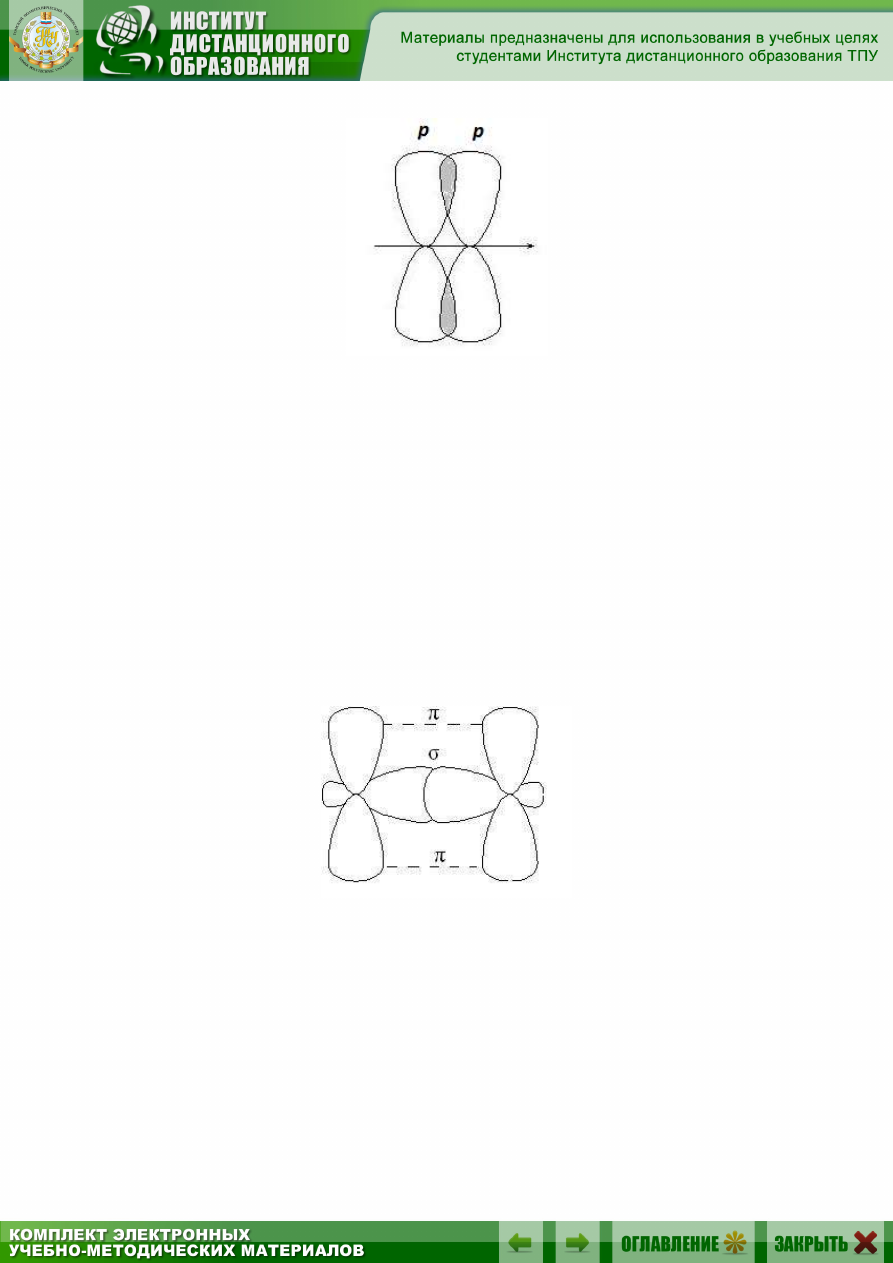
Рис. 2.3. Образование
-связей
В результате такого перекрывания образуются две области повы-
шенной электронной плотности. Ни одна из этих областей не лежит на
линии, соединяющей центры ядер двух атомов.
-Связь менее прочная, чем
-связь, ее электроны легче подверже-
ны внешнему воздействию. В соединениях с кратными связями только
одна из связей является
-cвязью, образованная перекрыванием s-, р-
или гибридных орбиталей, а остальные –
-связями, образованными пе-
рекрыванием негибридизованных р-орбиталей атомов, например, двой-
ная связь, образованная гибридными орбиталями (
-связь) и не участ-
вующими в гибридизации р-орбиталями (
-связь).
Рис. 2.4. Образование
двойной
связи
В молекулах алкенов, в частности этилена, орбитали атомов угле-
рода при двойной связи находятся в состоянии sp
2
-гибридизации, все
С–Н и С–С связи лежат в одной плоскости, перекрывание негибридных
р-орбиталей атомов углерода происходит в плоскости, перпендикуляр-
ной плоскости
-связей (рис. 2.4). Иногда эту плоскость называют плос-
костью
-связи.
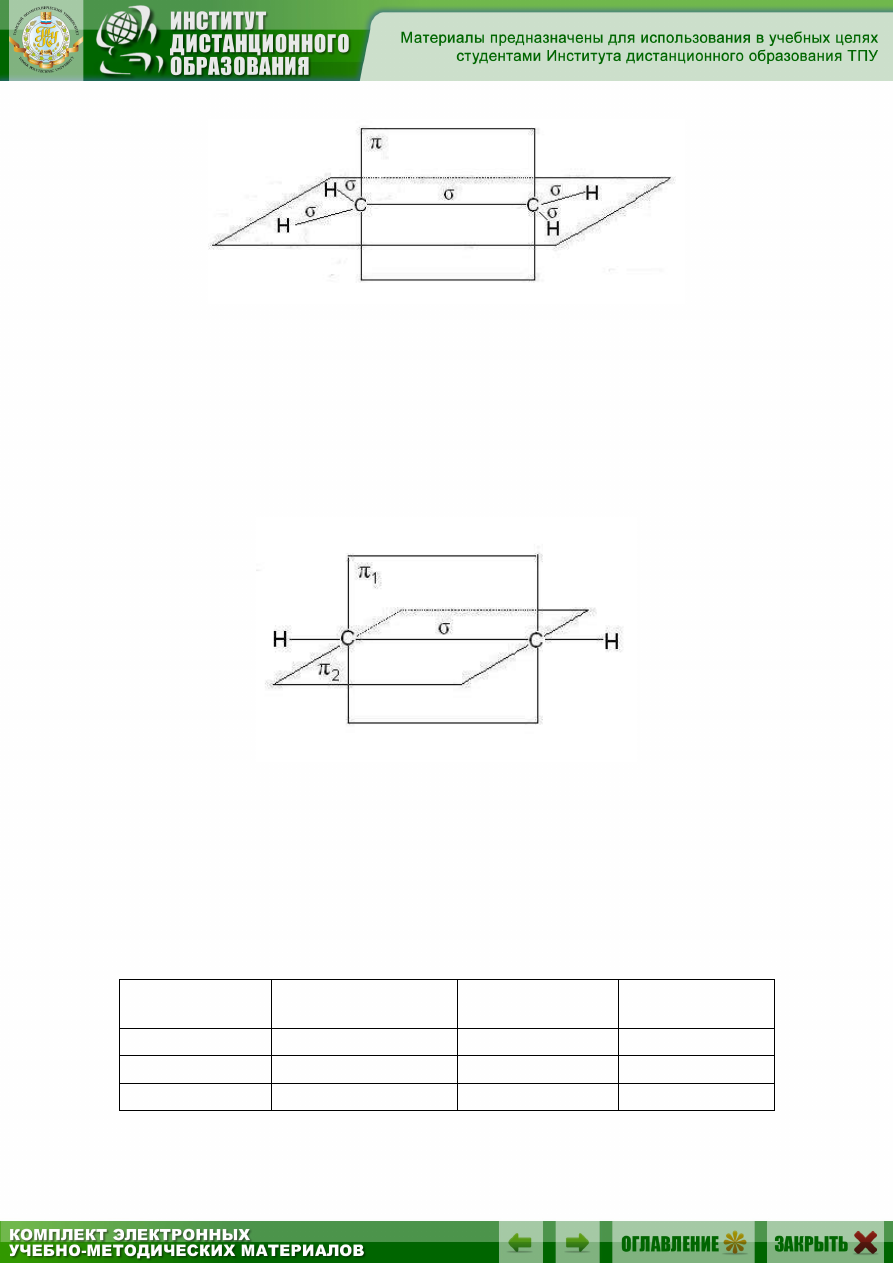
27
Рис. 2.4. Расположение
- и
-связей
в молекуле этилена
В случае тройной связи, например в молекулах алкинов, орбитали
атомов углерода при тройной связи имеют sp-гибридизацию. Две
-связи, образованные перекрыванием негибридных р-орбиталей ато-
мов углерода (по две от каждого из атомов), лежат в двух взаимно пер-
пендикулярных плоскостях (рис. 2.5).
Рис. 2.5. Расположение
- и двух
-связей
в молекуле ацетилена
В табл. 2.1 приведены основные характеристики связей между ато-
мами углерода.
Таблица 2.1
Основные характеристики связей между атомами углерода
Связь
Тип гибридизации
Длина
(нм)
Энергия
(кДж/моль)
C–C
sp
3
0,154
347
C=C
sp
2
0,134
606
C≡C
sp
0,120
828

28
2.5. Взаимное влияние атомов в молекуле
Молекула органического соединения представляет собой совокуп-
ность атомов, связанных в определенном порядке, как правило, кова-
лентными связями. При этом связанные атомы могут различаться по ве-
личине электроотрицательности. Величины электроотрицательностей
в значительной степени определяют такие важнейшие характеристики
связи, как полярность и прочность (энергия образования). В свою оче-
редь, полярность и прочность связей в молекуле в значительной степени
определяют возможности молекулы вступать в те или иные химические
реакции.
Электроотрицательность некоторых атомов по Л. Полингу выгля-
дит следующим образом:
Функциональные группы также отличаются друг от друга по элек-
троотрицательности:
Электроотрицательность атома углерода зависит от состояния его
гибридизации. Это связано с долей s-орбитали в гибридной орбитали:
она меньше у sр
3
- и больше у sр
2
- и sр-гибридизованных атомов.
Все составляющие молекулу атомы находятся во взаимосвязи
и испытывают взаимное влияние, поляризуя связи. При этом на атомах
появляется частичный заряд:
– или
+. Влияние может осуществляться
по системе σ-связей (индуктивный эффект), по цепи сопряжения (мезо-
мерный эффект) и через пространство (эффект поля). В настоящее вре-
мя понятия индуктивный эффект и эффект поля принято объединять,
т.к. считается, что смещение электронной плотности одновременно мо-
жет происходить по системе σ-связей и через пространство.
Это влияние передается в основном через систему ковалентных
связей с помощью так называемых электронных эффектов.
Электронными эффектами называют смещение электронной
плотности в молекуле под влиянием заместителей.
Атомы, связанные полярной связью, несут частичные заряды, обо-
значаемые греческой буквой
. Атом, «оттягивающий» электронную
плотность σ-связи в свою сторону, приобретает отрицательный заряд
–
.
При рассмотрении пары атомов, связанных ковалентной связью, более
электроотрицательный атом называют электроноакцептором. Его

29
партнер по σ-связи соответственно будет иметь равный по величине де-
фицит электронной плотности, т.е. частичный положительный заряд
+
,
и будет называться электронодонором.
Смещение электронной плотности по цепи s-связей называется
индуктивным эффектом и обозначается I.
2.5.1. Индуктивный эффект
Индуктивный эффект (I-эффект) – смещение электронной плотно-
сти по цепи σ-связей и через окружающее пространство, которое обу-
словлено различиями в электроотрицательностях атомов:
Электроотрицательность атома фтора больше, чем атома углерода,
поэтому он оттягивает электроны связи на себя, приобретая частичный
отрицательный заряд. Соответственно, атом углерода заряжается поло-
жительно, его электроотрицательность увеличивается, и он начинает от-
тягивать на себя пару электронов, связывающую его с соседним атомом
углерода, на котором также появляется частичный положительный за-
ряд. Из-за слабой поляризуемости σ-связей I-эффект быстро затухает
с удалением от заместителя и через 3–4 связи становится практически
равным нулю.
Индуктивный эффект заместителя является отрицательным (–I),
если заместитель уменьшает электронную плотность на данном атоме
углерода, индуцируя на нем частичный положительный заряд
+
.
Заместители с отрицательным индуктивным эффектом
–I-эффект проявляют:
1) заместители, которые содержат атомы с большей электроотрица-
тельностью, чем у углерода в sp
3
-гибридизованном состоянии, – это: –F,
–Cl, –Br, –I, –OH, замещенная ОН–группа: –OR (–OCH
3
, –OC
2
H
5
и др.);
–NH
2
, замещенная аминогруппа: –NR, –N(R)
2
,[–NHCH
3
, –N(CH
3
)
2
и др.];
2) положительно заряженные ионы:
30
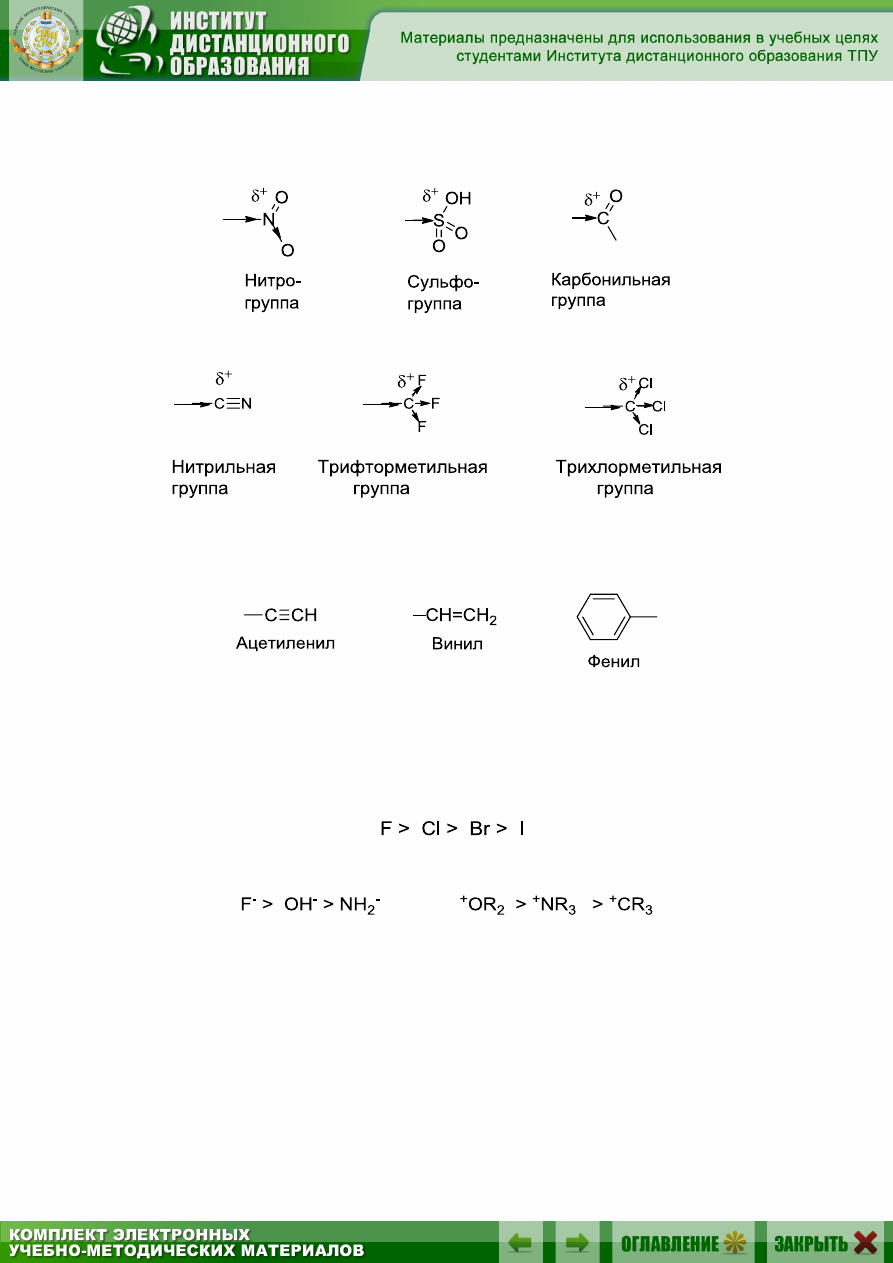
3) функциональные группы, которые на ключевом атоме несут
частичный положительный заряд:
4) углеводородные радикалы, имеющие атомы углерода в sp- и sp
2
-
гибридизованном состоянии.
Сила электроноакцепторного влияния этих групп и атомов зависит,
в первую очередь от их электроотрицательности. Поэтому в периодах
системы элементов Д.И. Менделеева отрицательный эффект атомов (–I)
растет слева направо, а в группах уменьшается сверху вниз. Например,
в ряду галогенов –I уменьшается от фтора к иоду:
В рядах следующих заместителей –I уменьшается:
Из-за разницы в электроотрицательности атомов углерода в sp
3
-,
sp
2
- и sp-гибридизованном состоянии, ацетиленовая группа обладает
большим –I-эффектом, чем винильная, фенильная и алкильная.
Индуктивный эффект заместителя является положительным (+I),
если заместитель увеличивает электронную плотность на данном атоме
углерода, индуцируя на нем частичный отрицательный заряд
–
.