Файл: Лабораторная работа 10 изучение скорости инверсии тростникового сахара.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 01.12.2023
Просмотров: 118
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Все значения углов вращения подставлять в уравнение с соответствующими знаками: имеет отрицательный знак, следовательно, эту величину нужно суммировать с величиной 0. Угол 0, соответствующий моменту начала реакции, практически измерить не удается, так как от начала реакции до первого измерения проходит значительное время, поэтому 0 определять экстраполяцией. На миллиметровой бумаге построить график в координатах ln (t ) t (рис. 4) и экстраполяцией полученной линии до t = 0 определить ln (0 ), а затем найти 0.
Вычислить константы скорости для каждого момента времени, в которое проводилось измерение угла вращения t и рассчитать kcp. Сравнить полученное значение с kcp, найденной на графике.
Для подтверждения порядка реакции использовать также график lnv = f [ln (at)]. Скорость реакции v для каждого промежутка времени от начала реакции определять с помощью кинетической кривой at= f (t) по тангенсу угла наклона касательной к соответствующей точке на кривой.
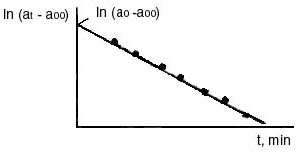
Рис. 4. Определение 0- и 0
Лабораторная работа № 10
изучение скорости инверсии тростникового сахара
Краткая теория
-
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ.
КИНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ РЕАКЦИИ
Химическая кинетика изучает скорость и механизм протекания химических процессов, а также зависимость их от различных факторов.
Скорость реакции. Скорость химической реакции определяется изменением количества данного компонента в единицу времени в единице объеме:
где n - число молей данного компонента в объеме V данной фазы в момент времени t.
При условии постоянства объема выражение (1) упрощается:
и скорость определяется изменением концентрации реагирующего вещества в единицу времени.
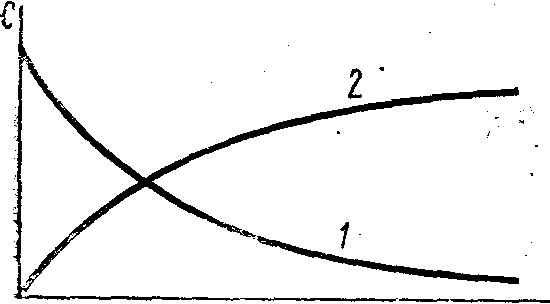
Скорость реакции всегда положительна. Однако при протекании реакции во времени концентрации исходных веществ уменьшаются, а продуктов реакции возрастают (рис. 137). В результате соотношение (C
2-C1)/(t2-t1) и производная dc/dt могут быть положительными или отрицательными в зависимости от того, изучают скорость реакции по изменению концентрации одного из продуктов реакции (знак «+») или одного из исходных веществ (знак «–»).
Скорость реакции выражается как производная от концентрации по времени для любого вещества, участвующего в реакции.
В общем случае скорость реакции, протекающей по уравнению:
n1A + n2B n1'C + n2'D, (a)
где n1, n2, n1' и n2' — стехиометрические коэффициенты, может быть представлена несколькими выражениями:
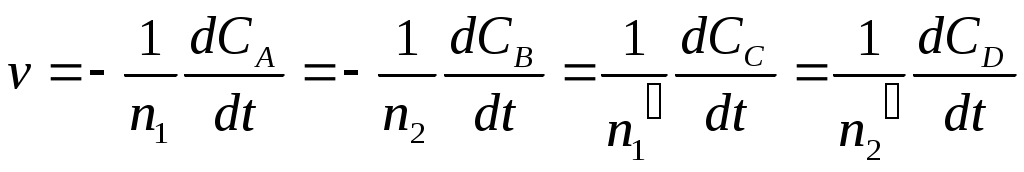
Исходные вещества расходуются, а продукты реакции образуются в эквивалентных количествах (соответственно стехиометрическим коэффициентам), поэтому при определении скорости реакции нет необходимости следить за изменением концентрации всех взаимодействующих веществ.
Скорость реакции можно определить так же, как производную степени полноты реакции (глубина ее протекания) по времени. Скорость реакции зависит от природы реагирующих веществ, их концентрации, присутствия посторонних веществ (например, катализаторов) и их концентрации; среды, в которой протекает реакция, и условий протекания реакции: температуры, давления (особенно для реакций с участием газов), облучения (фотохимические реакции) и т. п.
t
Рис. 1. Кинетические кривые:
-
изменение концентрации одного из исходных веществ во времени; -
изменение концентрации одного из продуктов реакции (а) во времени
После всех измерений следует определить угол вращения , соответствующий концу реакции. Для этого трубку, в которой находился рабочий раствор, заполнить смесью раствора сахара с 6 н НС1, предварительно охлажденной до температуры опыта (сполоснуть этим раствором трубку перед заполнением). Отсчет повторить через 15 мин и, убедившись, что угол вращения не меняется, принять его за .
По окончании работы рекомендуется проверить нулевое положение поляриметра, чтобы при необходимости ввести соответствующие поправки. Так как кислота разрушает металлическую оправу поляриметрической трубки, необходимо тотчас же по окончании опыта трубку промыть водой и высушить. Результаты наблюдений для реакций в 1 н и 2 н HCl свести в таблицы по образцу:
Температура опыта t0C =_____, концентрация НС1____н.
| № | Момент взятия пробы (по часам) | Время от начала реакции, мин | t | 0 - | ln(t - ) | Константа скорости инверсии k, (Размерность?) |
| 1 2 3 | | | | | | |
По результатам опыта вычислить константу скорости реакции при данной температуре для каждого момента, кроме t = 0 и t= , по формуле (5), где а концентрация сахара в исходном растворе; (ах) концентрация сахара в данный момент; t время, протекшее от начала реакции до момента данного измерения.
В выражение (5) вместо концентраций можно подставить пропорциональные им разности соответствующих угла вращения. Тогда:
где 0 – угол вращения в момент начала реакции;
t – угол вращения в данный момент от начала реакции;
– угол вращения, соответствующий концу реакции.
ских весах необходимое количество сахарозы и, поместив его в стаканчик, добавить нужный объем дистиллированной воды. Если раствор мутный, его нужно отфильтровать.
Затем пипеткой или мерным цилиндром отобрать в колбу 15 мл раствора сахарозы и туда же влить 15 мл 6 н НС1. Смесь перемешать и поместить в теплое место или термостат при 40° С на 3 – 3,5 ч.
З
а
б
в
г
атем пипеткой или мерным цилиндром отобрать в 2 конические колбы по 15 мл раствора сахарозы и туда же влить по 15 мл 1 н и 2 н НСl, соответственно. Момент сливания кислоты с раствором сахара отметить по часам как момент начала реакции. Смесь тотчас же тщательно перемешать и быстро влить в хорошо вымытую поляриметрическую трубку, предварительно сполоснув ее дистиллированной водой и небольшим количеством исследуемого раствора. При наполнении трубки нужно следить за тем, чтобы в нее не попал воздух. Пузырьки воздуха вызывают в поле зрения появление темных пятен. Чтобы быстро заполнить трубку без пузырьков воздуха, предварительно нужно научиться заполнять ее водой. Трубку наполнить до краев, чтобы жидкость образовала выпуклый мениск, затем осторожно сбоку надвинуть покровное стеклышко и навинтить кольцо, прижимающее стекло к торцу трубки. При этом проверить также, не подтекает ли трубка
(не образуется ли пузырьков воздуха через некоторое время после заполнения). Наполненную трубку обтереть снаружи фильтровальной бумагой, обратив особое внимание на чистоту, сухость и прозрачность стекол, закрывающих торцы трубки, и поместить в желобок поляриметра в крайнее положение, ближайшее к окуляру.
Отсчеты следует проводить только после получения четкого изображения шкалы и поля зрения при вращении соответствующей муфты на зрительной трубке поляриметра. Все измерения проводить при комнатной температуре с обязательной записью ее до и после опыта. Угол вращения определяется по полутеневому положению поляриметра через каждые 15 минут. Чем больше концентрация катализатора (кислоты), тем чаще следует производить отсчеты углов вращения, постепенно увеличивая время между измерениями. Всего следует сделать 10 - 12 определений, при этом записывать показание шкалы прибора и соответствующее ему время по часам. Все определения следует проводить по возможности быстро.
Основным законом химической кинетики является постулат, выражающий зависимость скорости реакции от концентрации реагирующих веществ: скорость реакции в каждый момент времени пропорциональна произведению возведенных в некоторую степень концентраций реагирующих веществ (закон действия масс). Так, для реакции (а) скорость может быть записана:
Коэффициент пропорциональности k в уравнении (3) называется константой скорости реакции. Она равняется скорости реакции при условии, если концентрация каждого из реагирующих веществ равна единице, поэтому ее называют также удельной скоростью реакции. Такой физический смысл константы скорости указывает на то, что величина ее должна зависеть от всех факторов, которые влияют на скорость реакции, за исключением изменения концентрации реагирующих веществ. Числовое значение константы скорости зависит также от выбора единиц времени и концентрации. Размерность ее определяется тем кинетическим уравнением, по которому производится ее расчет, т. е. зависит от порядка реакции.
Порядок реакции. Различают порядок реакции и ее молекулярность. Молекулярность реакции определяется числом частиц, участвующих в одном элементарном акте химического превращения. При этом число молекул образующихся веществ не имеет значения. В зависимости от этого различают реакции:
-
мономолекулярные, -
бимолекулярные, -
тримолекулярные.
Порядок реакции определяется показателем степени при концентрации в кинетическом уравнении реакции. Если порядок равен единице, то реакцию называют реакцией первого порядка, если двум – второго порядка, если трем – третьего порядка.
Уравнение (3), связывающее скорость реакции с концентрациями реагирующих веществ, называется кинетическим уравнением. В зависимости от порядка реакции кинетические уравнения для расчета константы скорости реакции различны.
Порядок реакции является чисто эмпирической величиной. Только для элементарной реакции, протекающей в один этап, он ра-
вен ее молекулярности, так как стехиометрическое уравнение правильно отражает истинный механизм такой реакции. Различают полный и частный порядок реакции. Каждый из показателей степени при концентрациях в дифференциальном уравнении скорости выражает частный порядок. Сумма показателей степени при концентрациях определяет полный (суммарный) порядок реакции.
Протекание реакции сложным путем, в несколько стадий, является одной из причин расхождения между порядком реакции и ее молекулярностью. Другой причиной расхождения может быть значительный избыток одного из реагентов в реакционной смеси. Тогда концентрация этого реагента остается практически постоянной в ходе реакции, а порядок реакции будет меньше, чем определяемый по стехиометрическому уравнению. Например, бимолекулярные реакции: инверсия тростникового сахара или гидролиз уксусного ангидрида – кинетически оказываются реакциями первого порядка, так как концентрацию воды здесь можно считать неизменной. Подобного рода реакции иногда называют псевдомономолекулярными. Порядок реакции зависит от условий ее протекания. Его можно изменить, например, варьированием концентрации или давления.
Кинетическая классификация реакций. В химической кинетике реакции разделяют по следующим признакам:
-
по числу частиц, участвующих в реакции (молекулярность и порядок реакции); -
по природе частиц, участвующих в элементарном акте реакции. Реакции, в которых участвуют молекулы, относятся к группе молекулярных реакций; реакции с участием атомов или свободных радикалов – к группе цепных реакций; реакции с участием ионов – к группе ионных реакций; -
по числу фаз, участвующих в реакции. Реакции, протекающие в одной фазе, называют гомогенными. Реакции, протекающие на поверхности или у поверхности раздела фаз, называют гетерогенными; -
по применимости катализаторов: каталитические, автокаталитические и некаталитические; -
по степени сложности (по механизму протекания): а) обратимые и необратимые; б) изолированные и параллельные; в) последовательные (конструктивные или многоступенчатые); г) сопряженные.