ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.08.2024
Просмотров: 92
Скачиваний: 0
СОДЕРЖАНИЕ
Многоэлектронные атомы. Заполнение электронных оболочек Конспект лекции (с демонстрациями)
Оценка энергии атомов в основном состоянии
Электронное строение атомов и их свойства
2. Атомный номер элемента. Изотопы
4. Волновые свойства электрона
5. Квантово-механическая модель атома
![]()
Cреднее расстояние электронов от ядра R меньше размера атома Rа, так как большинство электронов находится на внутренних оболочках. Размер атома Rа можно оценить, используя распределение электронной плотности p(r) и, оказывается, что он слабо зависит от Z, что показывают данные таблицы:
|
Z |
Rа/rБ |
|
30 |
2.49 |
|
50 |
2.33 |
|
90 |
2.13 |
Бóльший заряд ядра приводит к слабому уменьшению размера атома и увеличению энергии связи электронов.
Электронные конфигурации
Наша задача - разобраться в том, как заполняются электронные уровни, и как меняются при этом свойства атома по мере его усложнения.
Состояние
отдельного электрона в атоме характеризуется
четырьмя квантовыми числами:
главным квантовым числом n = 1, 2, 3,...;
орбитальным квантовым числом l = 0, 1, ...n-1;
магнитным квантовым числом ml = -1, -1+1, ...l-1 (всего 2l+1 значений);
проекцией спина ms = +1/2, -1/2;
Порядок заполнения электронных состояний определяется двумя принципами:
принцип Паули: в атоме может быть только один электрон с данным набором квантовых чисел;
принцип минимума энергии: в основном состоянии атома электрон занимает квантовое состояние с наинизшей возможной энергией. Следует учесть, что вследствие взаимодействия электронов друг с другом значения энергии зависят не только от главного квантового числа n, но и от орбитального l.
Совокупность электронов атома с заданным значением главного квантового числа n образует электронную оболочку атома (эти электроны объединяют близкие значения энергии и средняя удаленность от ядра; из последнего родилось и название). В водородоподобных атомах наиболее вероятное удаление от ядра зависит от n следующим образом
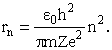
Различные оболочки атома обозначаются буквами: K (n=1), L (n=2), M (n=3),... Значение орбитального квантового числа принято обозначать буквами:
|
Значение орбитального квантового числа |
0 |
1 |
2 |
3 |
... |
|
Название состояния |
s |
p |
d |
f |
... |
Запись, указывающая оболочку, значение орбитального числа и количество электронов в оболочке, называется электронной конфигурациейатома. Сначала указывают главное квантовое число, затем название состояния по орбитальному числу (s, p, d и т.д.) и в виде степени у символа число электронов в этом состоянии. Например, 1s22s22p3 означает: 2 электрона имеют n = 1, l = 0, для следующих двух n = 2, l = 0, и последние три электрона находятся в состоянии с n = 2, l = 1. Это электронная конфигурация атома азота.
Порядок заполнения электронных состояний определяется двумя принципами:
принцип Паули, который гласит: в атоме не может быть двух электронов, все квантовые числа которых равны друг другу;
принцип минимума энергии - при данном количестве электронов в атоме реализуется состояние с наименьшей энергией;
Максимальное число электронов в оболочке с заданным значением n находим суммированием
![]()
В водородоподобных атомах с одним электроном без учета спина энергия электрона зависит только от главного квантового числа n
![]() .
.
В многоэлектронных атомах существено и взаимодействие электронов друг с другом. Расчеты показывают, что при данном n энергия электронов увеличивается с увеличением орбитального квантового числа l (образно говоря, центробежная сила, возникающая при орбитальном движении, стремится удалить электрон от ядра). По этой причине энергия электронов в 4s-состоянии оказывается меньше, чем в 3d-состоянии, и с 19K начинается заполнение состояний с n = 4, хотя не все состояния с n = 3 заняты. В итоге получаем следующую картину:
|
1s2 |
2 электрона |
|
2s22p6 |
8 электронов |
|
3s23p6 |
8 электронов |
|
4s23d104p6 |
18 электронов |
|
5s24d105p6 |
18 электронов |
|
... |
... |
Вы можете потренироваться в заполнении электронных оболочек с помощью действующей компьютерной модели.
Можно также посмотреть, как выглядят пространственные распределения электронной плотности в различных состояниях (ссылка на источник здесь). Сколь причудливы и сложны эти распределения.
Электронное строение атомов и их свойства
|
|
|
|
Z = 2 (гелий). Два электрона находятся в состоянии с квантовыми числами n = 1, l = 0, ml = 0, ms = +1/2 и -1/2 (т.е. два 1s электрона). Волновые функции, описывающие их состояние, несколько отличаются от водородных по форме из-за кулоновского отталкивания электронов, но главное отличие в масштабах величин. Для иона гелия из выражения (4), где есть множитель Z2, видно, что энергия связи электрона составит 54.4 эВ. Характерное расстояние электрона от ядра составит 0.53·10-10/Z м. В атоме гелия с двумя электронами из-за их отталкивания энергия ионизации составляет 24.6 эВ (нечто среднее между 13.6 для водорода и 54.4 для He+). Это самое большая величина для всех химических элементов. Оторвать электрон у атома гелия очень трудно, и в 1s состоянии нет вакантных мест. Поэтому гелий химически инертен, не образует молекул ни содним элементом.
Z = 3 (литий). В 1s состоянии находится два электрона, и принцип Паули запрещает поместить туда третий. Этот электрон находится в состоянии с n = 2 (2s) на большем удалении от ядра и с гораздо большей энергией (т.е. существенно меньшей энергией связи). Среднее удаление электрона от ядра так велико, что в первом приближении ядро и два электрона в 1s состоянии можно рассматриватькак точечный остов с зарядом +e. Третий электрон тогда с n = 2 должен иметь энергию (формула (4)) -13.6/4 = -3.4 эВ. Действительное значение -5.4 эВ, т.е. и правда малое (приближение не слишком плохое). Малое значение энергии ионизации означает, что литий имеет очень высокую активность. Размеры и энергии атома подтверждены надежными измерениями.
Z
= 4 (бериллий). Электронная конфигурация
- 1s22s2.
Из-за увеличения Z энергия ионизации
больше, чем для лития, и составляет 9.3
эВ. Для отрыва второго электрона в
состоянии n =
2 надо затратить не на много больше,
поэтому в химических соединениях
бериллий имеет валентность +2.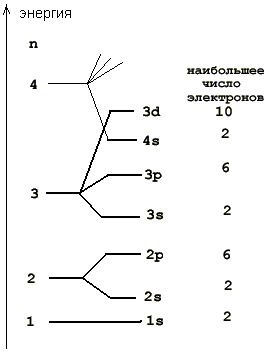
Z = 5 (бор). Электронная конфигурация - 1s22s22p1. Энергия ионизации 8.3 эВ (меньше, чем у бериллия). С одной стороны заряд ядра увеличился, с другой в 2p-состоянии энергия больше, чем в 2s. Второй фактор сильнее и, отделить электрон в 2p-состоянии легче. Валентность +3.
...
Z = 7 (азот), Z = 8 (кислород), Z = 9 (фтор). У атомов этих элементов не хватает трех, двух и одного электрона, соответственно, до заполнения оболочки с n = 2, а именно 2p состояния. Эти атомы химически электроотрицательны, т.е. в химических соединениях захватывают электроны. "Лишние" электроны оказываются связанными с ядром так же, как и остальные в 2p состоянии (хотя связь всех 2p электронов несколько меньше, чем в нейтральном атоме, из-за увеличения электрон-электронного отталкивания).
Z = 10 (неон). Все 10 возможных состояний с n = 1 и n = 2 заняты. Электронная конфигурация - 1s22s22p6. Энергия ионизации, пости непрерывно возраставшая, начиная с лития, составляет 21.6 эВ. Оторвать электрон трудно, и добавить тоже, т.к. дополнительный электрон должен был бы находиться в состоянии с n = 3 на большом удалении от ядра. Подобно гелию неон химически весьма инертен.
В элементах с Z = 11 (натрий) по Z = 18 (аргон) заполняются состояния 3s и 3p и по химическим свойствам они схожи с соответствующими элементами второго ряда (литий - неон).
Z = 19 (калий) и Z = 20 (кальций). Можно было бы ожидать, что начнется заполнение состояния 3d (l=2), но энергия электрона в состоянии 4s ниже, чем в 3d (см. схему уровней), и в обоих атомах последние электроны оказываются в 4s состоянии. Электронные конфигурации атомов - 1s22s22p63s23p64s1 и 1s22s22p63s23p64s2.
...
Далее следует заполнение состояний 3d, 4p, ... . Иногда оказывается энергетически более выгодным оказаться электрону не в 4s состоянии, а в 3d. Например, у атома меди (Z = 29) конфигурация 1s22s22p63s23p63d104s1, хотя у предшествуюшего атома никеля (Z = 28) 1s22s22p63s23p63d84s2.
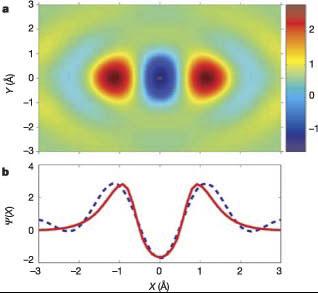 a -
полученное с помощью компьютерной
томографии (2004 г.)изображение молекулярной
орбитали 2p s g; b -
форма волновой функции вдоль межъядерной
оси (штрихи - реконструкция на основании
экспериментальных данных, сплошная
линия - расчеты из первых принципов).
a -
полученное с помощью компьютерной
томографии (2004 г.)изображение молекулярной
орбитали 2p s g; b -
форма волновой функции вдоль межъядерной
оси (штрихи - реконструкция на основании
экспериментальных данных, сплошная
линия - расчеты из первых принципов).