Файл: Сравнительная характеристика состава и свойств белков различных групп пищевых продуктов (Результаты изучения состояния белка в зрелых сырах).pdf
Добавлен: 31.03.2023
Просмотров: 290
Скачиваний: 2
СОДЕРЖАНИЕ
ГЛАВА 1. СОСТАВ И СВОЙСТВО ПОСТРОЕНИЕ БЕЛКА.
1.2 Химический состав и свойства белков.
1.3 Изменение содержания белков при хранении.
1.4 Функция белков и влияние на организм человека.
ГЛАВА 2. ПРАКТИЧЕСКОЕ ИССЛЕДОВАНИЕ БЕЛКОВ В ПИЩЕВЫХ ПРОДУКТАХ.
2.1 Практическая работа и исследование белков в пищевых продуктах.
R
|
H – C – NH2
|
COOH
Из этой формулы видно, что в состав всех аминокислот входят следующие общие группировки: – CH2, – NH2, – COOH. Боковые же цепи (радикалы – R ) аминокислот различаются. Химическая природа радикалов разнообразна: от атома водорода до циклических соединений. Именно радикалы определяют структурные и функциональные особенности аминокислот.
Все аминокислоты в зависимости от структуры разделены на несколько групп:
Ациклические . Моноаминомонокарбоновые аминокислоты имеют в своем составе одну аминную и одну карбоксильную группы, в водном растворе они нейтральны. Некоторые из них имеют общие структурные особенности, что позволяет рассматривать их вместе:
- Глицин и аланин. Глицин (гликокол или аминоуксусная к-та) является оптически неактивным – это единственная аминокислота, не имеющая энатиомеров. Глицин участвует в образовании нуклеиновых и желчных к-т, гема, необходим для обезвреживания в печени токсичных продуктов. Аланин используется организмом в различных процессах обмена углеводов и энергии. Его изомер b-аланин является составной частью витамина пантотеновой к-ты, коэнзима А (КоА), экстрактивных веществ мышц.
- Серин и треонин. Они относятся к группе гидрооксикислот, т.к. имеют гидроксильную группу. Серин входит в состав различных ферментов, основного белка молока – казеина, а также в состав многих липопротеинов. Треонин участвует в биосинтезе белка, являясь незаменимой аминокислотой.
- Цистеин и метионин. Аминокислоты, имеющие в составе атом серы. Значение цистеина определяется наличием в ее составе сульфгидрильной ( – SH) группы, которая придает ему способность легко окисляться и защищать организм о веществ с высокой окислительной способностью (при лучевом поражении, отравлении фосфором). Метионин характеризуется наличием легко подвижной метильной группы, использующейся для синтеза важных соединений в организме (холина, креатина, тимина, адреналина и др.)
- Валин, лейцин и изолейцин. Представляют собой разветвленные аминокислоты, которые активно участвуют в обмене веществ и не синтезируются в организме.
- Моноаминодикарбоновые аминокислоты имеют одну аминную и две карбоксильные группы и в водном растворе дают кислую реакцию. К ним относятся аспарагиновая и глутаминовая к-ты, аспарагин и глутамин. Они входят в состав тормозных медиаторов нервной системы.
- Диаминомонокарбоновые аминокислоты в водном растворе имеют щелочную реакцию за сет наличия двух аминных групп. Относящийся к ним лизин необходим для синтеза гистонов а также в ряд ферментов. Аргинин участвует в синтезе мочевины, креатина.
Циклические. Эти аминокислоты имеют в своем составе ароматическое или гетероциклическое ядро и, как правило, не синтезируется в организме человека и должны поступать с пищей. Они активно участвуют в разнообразных обменных процессах. Так фенил-аланин служит основным источником синтеза тирозина – предшественника ряда биологически важных веществ: гормонов (тироксина, адреналина), некоторых пигментов.
- Триптофан помимо участия в синтезе белка, служит компонентом витамина PP, серотонина, триптамина, ряда пигментов.
- Гистидин необходим для синтеза белков, является предшественником гистамина, влияющего на кровяное давление и секрецию желудочного сока.
Белки имеют высокую молекулярную массу, некоторые растворимы в воде, способны к набуханию, характеризуются оптической активностью, подвижностью в электрическом поле и некоторыми другими свойствами.
Белки активно вступают в химические реакции . Это свойство связано с тем, что аминокислоты, входящие в состав белков, содержат разные функциональные группы, способные реагировать с другими веществами. Важно, что такие взаимодействия происходят и внутри белковой молекулы, в результате чего образуется пептидная, водородная дисульфидная и другие виды связей. К радикалам аминокислот, а следовательно и белков, могут присоединяться различные соединения и ионы, что обеспечивает их транспорт по крови.
Белки являются высокомолекулярными соединениями . Это полимеры, состоящие из сотен и тысяч аминокислотных остатков – мономеров. Соответственно и молекулярная масса белков находится в пределах 10 000 – 1 000 000. Так, в составе рибонуклеазы (фермента, расщепляющего РНК) содержится 124 аминокислотных остатка и ее молекулярная масса составляет примерно 14 000.
- Миоглобин (белок мышц), состоящий из 153 аминокислотных остатков, имеет молекулярную массу 17 000
- гемоглобин – 64 500 (574 аминокислотных остатка).
Молекулярные массы других белков более высокие:
- g-глобулин ( образует антитела) состоит из 1250 аминокислот и имеет молекулярную массу около 150 000
- молекулярная масса фермента глутаматдегидрогеназы превышает 1 000 000.
Важнейшим свойством белков является их способность проявлять как кислые так и основные свойства, то есть выступать в роли амфотерных электролитов . Это обеспечивается за счет различных диссоциирующих группировок, входящих в состав радикалов аминокислот. Например, кислотные свойства белку придают карбоксильные группы аспарагиновой глутаминовой аминокислоты, а щелочные – радикалы аргинина, лизина и гистидина. Чем больше дикарбоновых аминокислот содержится в белке, тем сильнее проявляются его кислотные свойства и наоборот.
Эти же группировки имеют и электрические заряды, формирующие общий заряд белковой молекулы . В белках, где преобладают аспарагиновая и глутаминовая аминокислоты, заряд белка будет отрицательным, избыток основных аминокислот придает положительный заряд белковой молекуле. Вследствие этого в электрическом поле белки будут передвигаться к катоду или аноду в зависимости от величины их общего заряда. Так, в щелочной среде (рН 7 – 14) белок отдает протон и заряжается отрицательно, тогда как в кислой среде (рН 1 – 7) подавляется диссоциация кислотных групп и белок становится катионом.
Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией водородных ионов и выражается величиной рН. Однако при определенных значениях рН число положительных и отрицательных зарядов уравнивается и молекула становится электронейтральной, т.е. она не будет перемещаться в электрическом поле. Такое значение рН среды определяется как изоэлектрическая точка белков. При этом белок находится в наименее устойчивом состоянии и при незначительных изменениях рН в кислую или щелочную сторону легко выпадает в осадок. Для большинства природных белков изоэлектрическая точка находится в слабокислой среде (рН 4,8 – 5,4), что свидетельствует о преобладании в их составе дикарбоновых аминокислот.
Важное значение имеет способность белков адсорбировать на своей поверхности некоторые вещества и ионы (гормоны, витамины, железо, медь), которые либо плохо растворимы в воде, либо являются токсичными (билирубин, свободные жирные кислоты). Белки транспортируют их по крови к местам дальнейших превращений или обезвреживания.
Водные растворы белков имеют свои особенности. Во-первых, белки обладают большим сродством к воде, т.е. они гидрофильны . Это значит, что молекулы белка, как заряженные частицы, притягивают к себе диполи воды, которые располагаются вокруг белковой молекулы и образуют водную или гидратную оболочку. Эта оболочка предохраняет молекулы белка от склеивания и выпадения в осадок. Величина гидратной оболочки зависит от структуры белка. Например, альбумины более легко связываются с молекулами воды и имеют относительно большую водную оболочку, тогда как глобулины, фибриноген присоединяют воду хуже, и гидратная оболочка в них меньше. Таким образом, устойчивость водного раствора белка определяется двумя факторами: наличием заряда белковой молекулы и находящейся вокруг нее водной оболочки. При удалении этих факторов белок выпадает в осадок. Данный процесс может быть обратимым и необратимым.
Размер белковых молекул лежит в пределах 1 мкм до 1 нм и, следовательно, они являются коллоидными частицами , которые в воде образуют коллоидные растворы. Эти растворы характеризуются высокой вязкостью, способностью рассеивать лучи видимого света, не проходят сквозь полупроницаемые мембраны.
1.3 Изменение содержания белков при хранении.
При холодильном хранении и замораживании чистых растворов белков происходит агрегация молекул белка. Обычно этому процессу предшествует денатурация белка. Данные определения молекулярной массы, констант седиментации и скорости диффузии[1] образующихся при замораживании и холодильном хранении белковых частиц свидетельствуют о структурных изменениях этого белка. По некоторым данным, в процессе холодильной обработки рыбы возможно не только понижение, но и повышение растворимости белка. Так, в балтийской сельди растворимость белка в мышечной ткани мороженой рыбы увеличивалась даже во время окоченения.
Во время хранения мяса создаются благоприятные условия для вторичного взаимодействия липидов с белками. Это происходит потому, что нативные белки при хранении быстро разрушаются, структурная упорядоченность клеточных мембран[2] утрачивается, пространственная разграниченность химических компонентов клеток нарушается. Во взаимодействие с белками вступают при этом как полярные и нейтральные жиры, так и продукты их распада и окисления.Взаимодействие между липидами и белками происходит в продуктах и при хранении в замороженном состоянии. Результаты исследования мяса и рыбы показали, что волнообразно изменялись растворимость различных белковых фракций мышечной ткани, содержание сульфгидрильных и дисульфидных групп в белках, а также активность ряда ферментов.
Качественный состав аминокислот в процессе хранения продукта определяется многими факторами и зависит от активности различных ферментов мышечной ткани и индивидуальные превращения аминокислот, от аминокислотного состава расщепляемых белков, их количества и степени атакуемости ферментами, изменении рН, температуры и других взаимосвязанных факторов.
1.4 Функция белков и влияние на организм человека.
Белки, или протеины, имеют наибольшее значение для жизнедеятельности организма человека. Они являются структурной основой всех клеток. Белки — это сложные органические соединения, содержащие в отличии от жиров и углеводов кроме углерода, водорода и кислорода ещё и азот. Единственным источником белка для человека служит пища животного и растительного происхождения.
- наиболее вaжная функция белка – пластическая. В процессе жизнедеятельности человека происходит постоянное старение и отмирание отдельных клеточных структур и без белка невозможны процессы обновления тканей и органов, иными словами белки — «строительный материал» нашего организма;
- транспортная, необходимая для переноса питательных веществ и кислорода кровью;
- защитная функция играет важную роль в организме человека. Иммуноглобулины или антитела — это белки плазмы крови, они способны распознавать и обезвреживать чужеродные для организма вещества, тем самым отвечают за наш иммунитет;
- энергичная функция человека , при расщеплении белков выделяется энергия, необходимая для осуществления процессов жизнедеятельности организма;
- большое значение белок имеет для высшей нервной деятельности. Нормальное содержание его в пище улучшает регуляторную функцию коры головного мозга, повышает тонус нервной системы и ускоряет выработку условных рефлексов.
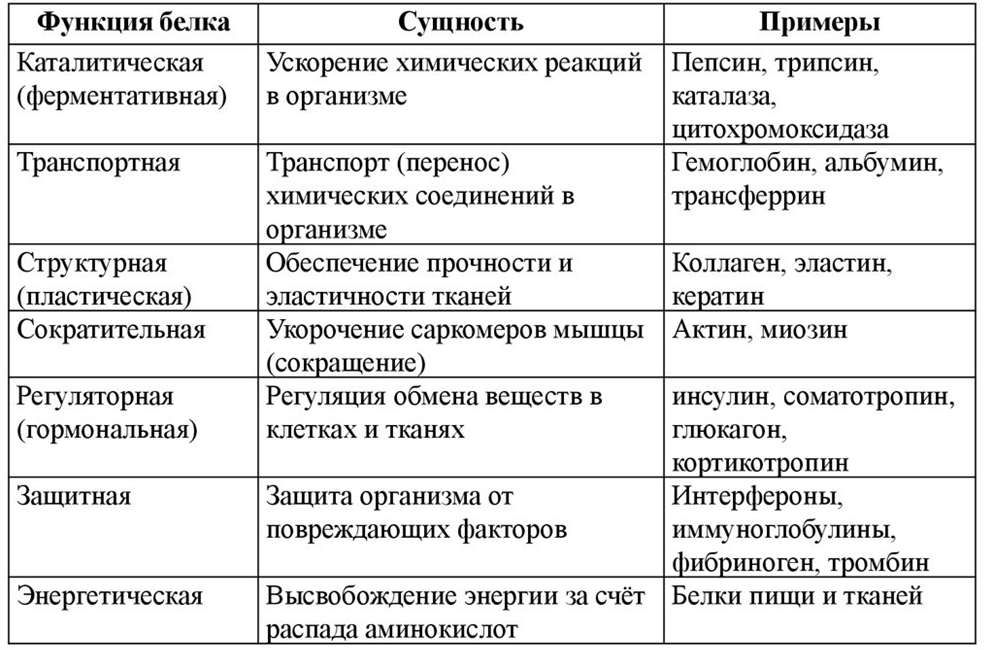
Рисунок 2. Функция белков.
Далее я подробнее остановлюсь на незаменимых аминокислотах, какое они оказывают влияние на наш организм и в каких продуктах они находятся.
Таблица 1.
Характеристика аминокислот
|
Аминокислоты |
Сущность |
Дефицит |
Натуральные источники |
|
Аргинин |
влияет практически на все функции организма, в особенности на иммунную систему и репродуктивную сферу человека, способствует выведению токсических отходов, влияет на рецепторы поджелудочной железы, усиливая выделение инсулина, тем самым снижая уровень глюкозы в крови, стимулирует силу гормона роста и незаменим для восстановления опорно-двигательного аппарата. Аргинин является в организме дозатором азота, который поддерживает тонус артериальных сосудов. Это аминокислота считается условно-незаменимой, так как у взрослого и здорового человека она вырабатывается организмом, а у детей, подростков, больных и пожилых людей уровень синтеза оказывается недостаточным. |
приводит к гипертонии, сахарному диабету, онкологическим заболеваниям, увеличению жировой массы тела, уменьшению роста. |
мясо, молочные продукты, орехи, кукуруза, желатин, шоколад, изюм, овес, кунжут. |
|
Валин |
Вырабатывает энергию, нужен для укрепления мышц и поддержания тонуса, нужен для восстановления тканей печени в случае ее повреждения. |
приводит к нарушению координации движений, повышается чувствительность кожи. |
молочные продукты, куриная грудка, мясо, грибы, продукты из сои, арахис, бобовые, крупы. |
|
Гистидин |
Особенно необходим в период роста, при стрессе и восстановлении после болезней и травм. |
приводит к ослаблению слуха, задержке умственного и физического развития, снижается посттравматическое восстановление тканей |
свинина, птица, сыр, пшеница, рис, зародыши пшеницы. |
|
Изолейцин |
влияет на рост мышц, рост энергии, участвует в выработке гемоглобина. |
приводит к депрессии, тахикардии, повышенной утомляемости, возникновению чувства страха, головокружению |
куриная грудка, рыба, орехи, семечки, зародыши пшеницы, крупы. |
|
Лейцин |
Способствует заживлению ран, нужен для развития и роста мышц, сращиванию костей, стабилизирует уровень глюкозы в крови. |
приводит к снижению роста тела, нарушению процессов восстановления, снижению обмена веществ и повышению уровня глюкозы крови |
молочные продукты, мясо, куриная грудка, овес, зародыши пшеницы, бобовые, крупы |
|
Лизин |
эффективное средство профилактики вирусных инфекций, в частности вируса герпеса. Лизин способствует выносливости мышц и участвует в формировании коллагена, основных белков опорно-двигательного аппарата |
может замедлить восстановление мышечной соединительной ткани и привести к потере костной массы тела |
рыба, куриная грудка, молочные продукты, зародыши пшеницы, бобовые, арахис. |
|
Метионин |
Содержит серу и тем самым предотвращает заболевания кожи и ногтей, влияет на рост волос. Является мощным антиоксидантом, положительно сказывается на функции печени, замедляет старение, влияет на ткани печени, снижает содержание в крови «плохого» холестерина |
может вызвать снижение уровня гемоглобина и накопление жира в клетках печени |
творог, нежирное мясо, яйца, бобовые, арахис, овощи |
|
Треонин |
Необходим для формирования эмали зубов, а так же таких белков как эластин и коллаген. Он помогает организму обезвреживать токсины, предотвращает образованию жира в клетках печени |
приводит к появлению усталости, к ожирению печени |
мясо, молочные продукты, яйца, бобовые |
|
Триптoфан |
Является предшественником серотонина, вещества, которое ответственно за наше настроение, а так же участвует в выработке мелатонина, гормона, который влияет на качество нашего сна |
приводит к хроническим головным болям, нарушению сна, расстройству нервной системы. |
индейка, куриная грудка, молочные продукты, яйца, семечки, орехи, бобовые |
|
Фенилаланин |
Требуется для нормального развития поджелудочной железы, служит предшественником для выработки такого вещества, как норадреналин, который повышает уровень бодрствования, психической энергии и физической активности. Улучшает умственные способности и память. Существует мнение, что фенилаланин влияет на уровень гормонов радости, которые вырабатываются в нашей нервной системе. |
приводит к раздражительности, плохому настроению, снижению обучаемости, может снизится сексуальная функция, обостряется синдром хронической усталости |
мясные и молочных продукты, куриная грудка, рыба, яйца, овес, зародыши пшеницы, бобовые |