ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.11.2023
Просмотров: 201
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
байланыстармен сипатталса, ерітіндідегі байланыс, газдарда кездесетіи аса әлсіз вандерваальстік, ал кейбір жағдайларда қосымша сутектік байланыстармен түсіндіріледі. Қоспалардағы заттар өзара ешбір байланыссыз-ақ араласса, ерітіндідегі еріткіш пен еритін заттар арасында әлсіз болса да химиялық байланыс болады. Мысалы, бірдей өлшемдегі құм мсн ағаш нсмесе темір үгіндісін араластырса, қоспа пайда болады және оларды бір-бірінен бөлуге болады. Ал, ас тұзын немесе қантты суда ерітсе, олар оңайлықпен әуелгі жеке заттарға бөлінбейді. Көбінесе, екі зат, бір-бірінде ерігенде, олардың арасында өзінің агрегаттық күйін өзгертпейтін немесе ерітінді құрамындағы мөлшері басым болатын бөлікті еріткіш дейді. Демек, «еріткіш», «еритін зат» ұғымдары салыстырмалы екенін ескеру керек. Мысалы, спирт пен судың тең бөлігін бір-бірінде ерітсе, олардың қайсысының еритін зат, қайсысының еріткіш екенін ажырату қиын, өйткені екеуі де сұйық және бір-бірінде ерігіштіктері бірдей. Мұндайда ерітінді құрамындағы компоненттер туралы айтқан дұрыс, Сондықтан компоненттердің агрегаттық күйін ескеріп, ерітінділерді үш топқа бөлуге болады: газдың газдардағы ерітіндісі (газ қос- пасы); сұйық ерітінділер; қатты ерітінділер. Газ ерітінділеріне ауа, ал қатты ерітінділерге түрлі металдардың қорытпалары мысал болады. Ал, сұйық ерітінділер газдардың сұйықтағы ерітінділері; сұйықтың сұйықтағы ерітінділері, қатты заттардың сұйықтағы ерітінділері болып бөлінеді. Еріткіші су болатын ерітінділер табиғатта кең тараған. Жер қыртысындағы, өсімдіктер мен тірі организмдердегі процесстер сусыз жүрмейді. Осыдан ерітінді дегеніміз жай ғана құбылыс емес, ол өте күрделі физикалық және химиялық қасиеттері бар күрделі құбылыс екенін көреміз. Еру процестері кейде жылу бөліну арқылы жүрсе, енді бірде жылу сіңіру арқылы да жүреді, яғни зат қыздырғанда ғана ериді. Сондай-ақ, кей заттарды еріткенде ерітіндінің көлемі кемуі немесе артуы мүмкін. Мысалы, күкірт қышқылын не натрий гидроксидін суда еріткенде едәуір жылу бөлінеді. Бүл еріген зат пен еріткіш арасында химиялық реакцияның жүргендігін көрсетеді. Бүл процесті сольватация, ал пайда болған қосылысты сольват дейді. Зат суда еритін болса, процесс, гидратация, қосылыс гидрат делінеді.Ерітінді жайлы ілім өз алдына жеке бөлім болып, жалпы табиғаттану ғылымынан бөліне бастағаннан оның табиғатына қатарынан екі көзқарас қалыптаса бастайды. Олардың бірін — ерітінділердің физикалық, ал екіншісін — химиялық теориясы дейді. Ерітінділердің физикалық теориясы XIX ғасырдың екінші жартысында қалыптасты. Ол теорияның негізін салушылар С. Аррениус пен Вант-Гофф болды. Бүл теория еру процесі жай физикалық қоспа ретінде, еритін заттардың ұсақ бөлшектері еріткіш көлемінде біркелкі таралған, олардың араларында ешбір әрекет болмайтын орта сияқты ұғымда қарастырылады. Олай болса, бұл теория еритін зат пен еріткіш араларында ешбір химиялық әрекет жүрмейді деген пікірді теріске шығармайды. Жалпы физикалық теория ерітінділердің қайнау температураларының жоғарылауы, қату температураларының төмендеуі, будың қысымы, осмостық қысым сияқты қасиеттеріне сүйенді. Бұл шамалар ерітінділердің концентрациясыпа тәуелді де, еріген заттың табиғатына тәуелсіз. Сондықтан да бұл теория бойынша ерітінділер еріген заттардың күйі газ күйіндегі ерітінділер секілді болып келетін молекулалардың бірыңғай қоспасы іспеттес. Ерітінділердің химиялық теориясының негізін қалаушы Д. И. Менделеев болды. Бертін келе, бүл теорияға И. А. Каблу- ков, Н. С. Курнаков сияқты әйгілі совет ғалымдары елеулі үлес қосып, оны жаңа деңгейге көтерді. Бұл теорияны бірінші тұжырымдаған Д. И. Менделеев күкірт қышқылының, этил спиртінің және баска да қосылыстардың судағы ерітінділерін нақты, жан- жақты зерттеді. Мұның нәтижесінде ол, ерітіндідегі компоненттер арасында, яғни еріген зат пен еріткіш арасында химиялық әрекеттер жүреді деген қорытынды шығарды. Мысалы, Менделеев күкірт қышқылының ерітінділерінде бірнеше гидраттардың түзілетінін аныктады. Ол сондай-ақ, еріткіш пен еритін зат молекулаларының арасындағы байланыс негізінен сутектік байланыс арқылы немесе ондағы қосылыстар құрамына енетін полюсті молекулалар араларындағы өзара электростатистикалық әрекеттесу салдарынан болатынын анықтады Сұйытылған ерітінділер. Рауль заңы. Ерітінділердің ішінде еріткіші сұйық болып келген ерітінділердің іс жүзінде маңызы зор. Оның ішінде ең жақсы зерттелгені — сұйытылған ерітінділер. Енді солардың қасиеттеріне тоқталайық. Сұйытылған ерітінділерде еріген заттың молекулалары бір-бірінен еріткіштің көптеген молекулаларымен бөлінген, яғни олар өзара нашар әрекеттеседі. Сұйытылған ерітінділердің қасиеттеріне әсер ететін факторлар: еріткіш пен еріген заттың табиғаты және ерітіндінің қоюлығы (концснтрациясы) негізінде осы екеуі болады. Бұған орай ерітінділердің мынадай қасисттері бар: 1) ерітінді буының қысымы еріткіш буының қысымынан кем болуы; 2) ерітінділердің таза еріткіштерінен төменгі температурада қатуы; 3)ерітінділердің еріткіштерінен гөрі жоғарытемпературада кайнауы. Егер ерітіндінің құрамдас бөліктері ұшқыш болса, онда белгілі бір уақытта сұйық пен газға айналған құрамдас бөліктер арасында тепе-теңдік орнығады, сөйтіп қаныққан бу түзіледі. Ерітінді бетіндегі қаныққан будың жалпы қысымы (Р) құрамдас бөліктердің үлестік қысымдарының косындыларына тең, яғни: Р = ∑Рі. Қарапайым бинарлық ерітіндіні қарастырсақ, ондағы еріткіштің үлестік қысымына мынадай байланыста болады: P1= P0 x1= P0 (1-x2) (1) Мұндағы Р1— еріткіштің үлестік қысымы, х1— оның мольдік үлесі Ро — таза еріткіш буының қысымы; х2 — -еріген заттын мольдік үлесі. Ерітінді бетінде бұрын жалпы қысымы құрамдас бөліктердің үлестік қысымдарының косындысына тең, яғни аддитивтік шама: Р ° - Р ' / Ро = Х2 (2) 2-теңдеу бу қысымының салыстырмалы түрде азаюын көрсетеді, яғни еріткіштің бу қысымының салыстырмалы түрде азаюын көрсетеді, яғни еріткіштің бу қысымының салыстырмалы кемуі еріген заттың мольдік үлесіне тең болып шығады. Осы жоғарыда көрсетілген екі теңдеу (1 және 2) Рауль заңының математикалық; өрнегі болып табылады. Қаныққан бу идеал газ сияқты қасиет көрсететін ерітінділерге 1-теңдеу қолданылады. Жоғары температурада қаныққан бу кысымы өте үлкен мәнге ие болады, оның идеал газы қасиеттерінен ауытқуы көбейіп, 1-теңдеуге сәйкес келмейді. Мұндай жағдайларда газдардың термодинамикалық касиеттерін (кысым арқылы емес) ұшкыштық (f) аркылы байланыстырып, Рауль заңын былай көрсетуге болады: f = f 0 ХІ = f 0 (1-Х2) (3) Егер ерітінді Рауль заңына кез келген қоюлық пен температурада 1-тендеуге бағынса, онда ерітінділер идеал ерітінділер деп аталады. Мысалы,
бензол мен толуол, гексан мен октан, бензол мен дихлорэтаннан тұратын коспалар идеал ерітінділерге жатады. Белгілі бір і құрамдас бөліктің тепе- тендік жағдайда ерітінді мен бу арасында таралуы ол құрамдас бөліктің химиялық потенциалы мен өзара тең болуымен сипатталады: µі (ер) = µі (бу) Егер ерітінді Рауль заңына бағынатын идеал ерітінді болса, жаңағы құрамдас бөліктің химиялық потенциалы мынаған тең: µі = µі (Т)+ RT lnx1 (4) Мұндағы µі (Т) — белгілі бір температура (Т) мен қысымдағы (Р) химиялық немесе изобарлык, потенциал. Кейбір өте сұйытылған ерітінділер идеал болмаса да Рауль заңына бағынады. Оларды шекті сұйытылған ерітінділер деп атайды. Реал ерітінділер Рауль заңына бағынбайды. Ерітінді буының жалпы және оның құрамдас беліктерінің үлестік кысымдары идеал ерітіндінің жалпы және үлестік қысымдарынан көп немесе аз болады. Рауль заңынан оң және теріс ауытқуларды әр түрлі ерітінділерден байқауға болады. Мысалы : ацетон- күкіртті көміртек, ацетон- этанол, су- метанол және т.б оң ауытқу болса, су- азот қышқылы, су- хлорлы сутек, хлороформ- ацетон, хлороформ – бензол т.б.ерітінділерде теріс ауытқуларды байқауға болады. Біртекті молекулаларға қарағанда әртекті молекулалардың ерітіндідегі өзара тартылуы әлсіздеу келеді. Ендеше ондай жағданда молекулалардың сұйық буға айналуы оңайырақ болғандықтан, Рауль заңынан оң ауытқуды байқауға болады. Әр түрлі молекулалардың өзара әрекеттесуі күштірек болса (химиялық қосылыс, сутектік байланыстар түзілу, сольватация), онда молекулалардың газ фазасына ауысуы қиындау болғандықтан, Рауль заңынан теріс ауытқуларды байқаймыз. Молекулалардың сұйықтан буға ауысының жылулық эффектісі болады. Бірдей молекулалардың буға айналуы — теріс, ал әр түрлі молекулардың әрекеттесуі кезінде оң жылулық эффектілер пайда болады. Алайда кейбір ерітінділерде оң және теріс ауытқуларды тудыратын факторлар бірдей әсер ететіндіктен, жылулық эффектілер мен ауытқулар таңбасы сәйкес келмеуі де мүмкін. Коноваловтың I-II заңы.Азеотроптық ерітінділер. Кейбір ерітінділерде идеал оң және теріс ауытқулар ерітінділер заңынан көбірек болады. Ондай жағдайда жалпы бу қысымының қисығында максимум немесе минимум кездеседі. 1881 ж. Д. П. Коновалов будың жалпы қысым қисығында немесе будың қайнау температурасы кисығындағы экстремумда (максимум немесе минимумда) қанықкқан бу мен онымен тепе-теңдікте ерітінді құрамының бірдей болатынын анықтады. Бұл тұжырымдама Коноваловтың II заңы деп аталады. Бұл заңға бағынатын сұйық ерітінділерде бу қисығы мен сұйықтық қисығы экстремумдық нүктеде қиылысатын болады. Осы экстремумдық нүктелердегі ерітінділердің құрамы айдау кезінде өзгермейді. Олар жеке сұйықтар сияқты тұрақты температурада кайнайды. Сондықтан оларды азеотроптык, (бөлінбей қайнайтын) ерітінділер деп атайды.. Кейбір азеотроптық ерітінділер төменде көрсетілген. Азеотроптық (бөлінбей қайнайтын) ерітінділер Құрамдас бөліктер Қайнау температурасы. Азеотроптың құрамы А В А В азеотроп 1 2 3 4 5 6 Максимумдық қайнау температурасы СНзСІ СНзСОСНз 61,2 56.25 64,5 20,5 Н2О НСІ 100 -85 110 20,3 Н2О НNОз 100 85 120 68,0 СНзОСН3 НСІ -23,65 -84 -1,5 40,0 1 _ 2 3 4 5 6 Минимумдық қайнау температурасы С2Н5ОН С6Н6 100 78,3 78,13 95,53 СS2 СНзСОСНз 46,25 56,25 56.25 34,0 СНСІз С2Н5ОН 61,2 78.2 59.З 6,7 Н2О С2Н5ОН 100 78,30 78,15 95,57 Көп жағдайда азеотроптық ерітінділерді химиялык, жолмен бөледі. Азеотроптық құрамдас бөліктері бөлінуін төмен немесе жоғары кысымда айдау аркылы жеңілдетуге болады, мысалы, С2Н5ОН—Н2О ерітіндісінің бетіндегі қысымды сынап бағанасы бойынша 100 мм кеміткенде, азеотроптағы спирттің мөлшері 99,6 мольдік процентке дейін көтеріледі де, оның қайнау температурасы 34,2 ° С-ге дейін төмендейді. Қазіргі кезде азеотропты ерітіндіні бөлу үшін айдау алдында оған үшінші кұрамдас бөлік қосады. Ол басқа бір температурада қайнайтын екі қабаттык жүйе түзеді. Мысалы, абсолюттік (сусыз) спирт алу үшін кәдімгі сатылатын ректификатқа химиялық заттар қосады. Олар кальций оксиді, металдық кальций, сусыз тотығатан сияқты спиртпен әрекеттеспейтін, суды жақсы сіңіретін заттар. Осыған байланысты сусыз таза спирт қайтадан айдағанда алынады. Сұйықтардың өзара еруі. Кез келген екі сұйықтықты араластырсақ, олар өзара үш түрлі жағдайда ериді: 1) екі сұйық өзара өте жақсы еритіндіктен, кез келген қатынаста араласып, гомогендік ерітінді береді (мысалы С2Н5ОН — Н2О, Н2О-ацетон, Н2О-глицерин, т.б. ); 2) екі сұйықтық бір-бірінде аздап қана ериді (мысалы, су-эфир, су-анилин, т.б.); 3) екі сұйықтық бір-бірінде іс жүзінде ерімеуі мүмкін (мысалы, су-сынап, су-бензин т.б.) Бұл үш жағдайдың біріншісі — кәдімгі ерітінді, ал үшінші жағдайдың іс жүзінде маңызы жоқ болғандықтан, тек екінші жағдайға тоқталайық. Бұл жағдай ерітінді буының үлестік қысымының Рауль заңынан оң ауытқуы өте көп болған кезде байқалады. Сұйықтықтардың өзара еруін жүйелі түрде алғаш рет В. Ф. Алексеев зерттеді. Екі сұйықтық анилин мен суды өзара еруі аздап қана болатын жағдайды қарастырайық. Егер анилинге су қосатын болсақ, олар бір-бірінде нашар еритіндіктен, екі қабат түзіледі. Оларды әбден шайқап, біраз қойғаннан соң қайтадан екі қабатқа балінеді: жоғары қабаты-анилинге қаныққан су қабаты, ал төменгісі суға қаныққан анилиннің қабаты. Осы екі кабаттың құрамы температураға байланысты өзгереді және әр қабаттың құрамында екінші еритін сұйықтық мөлшері көбейеді. Оны мына мәліметтерден көруге болады. 4.2-кесте Температура °С 20 60 100 140 160 168 100 г ерітіндіде 1 г Н2О баранилиннің қабаты 5,0 5,8 8,5 11,9 28,8 51,4 100 г ерітіндіде 1 г анилин бар су кабаты 3,1 3,8 7,21 10,5 24,9 48,6 4.2-кестеден температура артқан сайын анилин қабатында біртіндеп су мөлшерінің, ал су қабатында анилин мөлшерінің көбейетінін көреміз. 168°С температураға дейін әр кабаттың құрамдарының айырмашылығы кемиді ал 168°С температурада екі сұйықтық бір-бірінде шексіз ериді. Осы нашар ерудің шексіз (өте жақсы) еруге ауысатын температурасы дағдарыстық температура деп аталады. Бұл терминді алғаш В. Ф. Алсксеев енгізген. Су-анилин жүйе күйінің диаграммасы 3.5.1-суретте көрсетілген. Өзара еру қисығы бөліну қисығы немесе бинодальдық қисық деп аталады. Никотин 3.5.1-сурет. Су-анилин жүйесінің 3.5.2-сурет. Никотин-су жүйссінің диаграммасы. диаграммасы. Осы қисықтың сыртқы алаңы гомогендік әр түрлі құрамдағы сұйық ерітіндіге сәйкес келеді. Ал қисықпен шектелген алаң екі сұймқтықтың тепе-теқдікте болатын гетерогендік аймағы болып табылады. Қисықтағы кез келген нүкте белгілі бір температурадағы тепе-тендік қабаттарының құрамын сипаттайды. Бір температура сәйкес келетін осындай екі нүктені қосатын түзу АА “нода” немесе “коннода” деп аталады. Сұйықтықтың шексізеруіне сәйкес келетін нүкте (К) ерудің дағдарыстық температурасы болады. Өзара шектеле еритін фенол-су, күкіртті көміртек-метил спирті сияқты қоспаларда да температура артқан сайын өзара ерігіштік көбейіп, жоғары бір температурада яғни дағдарыстық температурада шексіз ерігіштікке айналады. Кей жағдайда температура артқан сайын екі сұйықтықтың өзара ерігіштігі кемиді. Мұндай жағдайлар үшін екі сұйықтықтың шексіз ерігіштігі ең төменгі температурада яғни төменгі дағдарыстық температурада болатыны байқалады. Мысалы, коллидин мен су үшін “төменгі” дағдарыстық температура — 57°С. Коллидин дегеніміз — триметилпиридин С5Н2(СНз)зN. Төменгі дағдарыстық температураны триметиламин-су (12,5°С), метилпипиридин-су (480 С) сияқты басқа да жүйелерден байқауға болады. Шексіз ерігіштіктері жоғары және төменгі температуларда байқалатын жүйелер бар. Олардың жоғары және төменгі дағдарыстық температуралары болады. Мысалы, су-никотин жүйесінде 2 дағдарыстық температура бар (3.5.2-сурет). Мұндағы жоғары дағдарыстық температура (К1) — 207°С, ал төменгі дағдарыстық температураға (К2)— 60,8°С сәйкес келеді. Төменгі дағдарыстық температурада шексіз еріген ерітінді құрамында — 29%, ал жоғарғы дағдарыстық' температурада 32% никотин болады. Жүйеге үшінші бір затты енгізгенде екі сұйықтың өзара еруі өзгереді. Егер осы үшінші зат екі сұйықтықта да еритін болса, онда екі сұйықтықтың өзара еруі артады. Мысалы, егер жүйеге LiJ- тың қажетті мөлшерін енгізсе, онда су мен анилиннің кез
келген температурада, кез келген қатынаста бір-бірінде шексіз еритінін байқаймыз. Егер үшінші құрамдас бөлік екі сұйықтықтың біреуінде ғана ерісе, онда олардың өзара ерігіштігі әдетте кемиді. Мысалы, фенол су жүйесінде 3% КСІ ерітсе, ол жүйенің дағдарыстық температурасы 30 градусқа артады. Кейбір жағдайларда жүйеге үшінші қүрамдас бөлікті енгізгенде біртекті ерітінді екі қабатқа бөлінеді. Мысалы, су-спирт біртекті ерітіндісі кальций карбонатын қосқанда екі қабатқа бөлінеді: біреуі — сусыз этил спирті, ал екіншісі — К2СОз-тің судағы ерітіндісі. Ерігіштіктің түз катысуында кемуін ығыстырылу деп атайды. Егер өзара ерігіштік өте аз болса (мысалы, су-бензол тәрізді бір-бірінде іс жүзінде ерімейтін сұйықтықтар), онда әр сұйықтықтың қоспа бетіндегі қысымы сол таза сұйықтық бетіндегі қысымға, ал жалпы қысым таза сұйықтықтың сол температурадағы қысымдарының қосындысына яғни Р = Р01 + Р02-ға тең болады.. Өзара ерімейтін сұйықтықтар қоспасының қайнау температурасы жеке сұйықтықтың қайнау температурасынан төмен болып кетеді. Бу қысымының құрамы сұйықтықтар қоспасының құрамына тәуелсіз болады, ейткені құрамдас бөліктердін мольдік үлестері X және (1 - X) сол температурада тұрақты шамалармен (Р01 жәнс Р02) анықталады: Х=Р01 / (Р01+Р02) және (1-Х)= Р02 / (Р01+Р02) Аздап ұшатын сұйықты басқа ұшқыш, бірақ ерігіштігі аз, химиялық әрекеттеспейтін сұйықпен араластырып қайнатқанда, оның қайнау температурасының кемуі сұйық қоспаларды су буымен айдауда жиі қолданылады. Аса қыздырылған су буын қолдана отырып, сумен араласпайтын сұйықты қаныққан буының қысымын арттыру арқылы белгілі бір жоғарырақ температураға дейін ыдыратпай қыздыру арқылы айдау кезінде заттың еруін арттыруға болады. Бұл тәсіл органикалық технология мен лабораторияларда жиі пайдаланылады. Мысалы, эфирмайларын осы тәсілмен айдайды. Сұйықтарды сипаттайтын термодинамикалық теңдеулерде реал ерітінділердің і құрамдас баліктерінің химиялық потенциалын жазғанда, оның мольдік үлесінің орнына сол құрамдас бөліктің активтілігі колданылады: m = m° = m і0 (Т) + RТ 1п аі (7) Тендеуді (7) кез келген идеал емес ерітінділерге колдануға болады. Реал ерітінділердегі әрекеттесуді есепке алу үшін қолданылатын активтілік ерітіндісінің идеал ерітінді занынан ауыткуын түсіндірмесе де, ерітінді термодинамикасын математикалық түрде көрсетуге мүмкітідік береді. Активтік немесе активтілік коэффициентін (аі) бу мен идеал газ қысымының қатынасымен бу және реал газ ұшқыштықтарының қатынасы арқылы табуға болады: аі = Рі / Рі0 (8а) аі = f і / f і0 (8Ә) Активтілікті тек осы формулалар арқылы ғана емес, сонымен қатар қайнау температурасы мен қату температурасын, электр қозғаушы күшті өлшеу т.б. арқылы да табуға болады. Ол тәсілдерді кейінірек қарастырамыз. Заттың өзара араласпайтын екі еріткіште таралуы. Егер өзара ерімейтін екі сұйықты араластырсақ, онда таза сұйықтардан екі қабат түзіледі. Енді осы жүйеге екі сұйықта да еритін үшінші бір құрамдас бөлікті қоссақ, онда тепе-теңдік орныкканда, ол сүйықтардағы ерігіштігі бірдей болмағандықтан екі түрлі концентрация (қоюлық) көрсетіп, таралады. Тепе-теңдіктің орнығу жағдайы сол заттың екі фазадағы химиялық потенциалының теңесуі яғни: m’3 = m3’’ ендеше: m 30 ‘+ RТ 1п х3’ = m 30’’ (Т) + RТ 1п x3 (9) 9-тендеудегі хз және хз — үшінші заттың бірінші және екінші фазадағы мольдік үлестері. Осы теңдеуді (9) түрлендіріп, мынадай өрнек алуға болады: 1п (Хз'/Хз")=( m 3°"+m 3°') RТ=f (Т)=сопst (10) 10-теңдеу белгілі бір температурада заттың әр фазадағы мольдік үлесінің көрінісі болып табылады. Демек: Х3’ /Х3" = Km-y болады. (11) Мұндағы Кт-у таралу түрақтысы деп аталады. Ол температураға байланысты шама және белгілі- бір температурада тұрақты болады. Жоғарыда айтылғандай, егер ерітінді идеал емес болса, онда 11-тендеудегі мольдік үлестердің орнына заттың активтілігін, ал ерітіндісұйытылған болса, онда заттың концентрациясын (қоюлығын) пайдаланып таралу тұрақтысын табуға болады: а3'/а3" = Кт-у (12а) С3'/С3" = Кт-у (12Ә) Сұйытылған ерітінділерде бірнеше зат болса, олардың әрқайсысы екі фазада әр заттың таралу коэффицентіне байланысты таралады.Жеке заттың таралу коэффициенті-басқа заттардың болу- болмауына тәуелсіз шама. Бұл тұжырымдаманы 1890 ж. Нернст айтқан болатын. Таралу коэффициенттерін өлшеу арқылы еріген заттың активтілігің анықтауға болады. Таралу заңы сол ерігін затты бөліп жиып алуға мүмкіндік береді. Егер еріген заттың екінші еріткіштен ерігіштігі көп болса, ерітіндіге сол еріткішті қоса отырып, барлық затты осы еріткішке ауыстыруға болады. Кендерді байытудың бір тәсілі — эксракция осы таралу заңына негізделген. Мысалы, суда еріген органикалық заттарды эфирмен экстракциялағанда оған күшті қышқыл немесе күшті негіз қосады. Сонда оның ерігіштігі артады. Себебі органикалық қышқылдар мен оның тұздары суда аздап болса да иондарға диссоцияланады. Ал эфирде тек диссоциацияланбаған молекулалар ғана ериді. Өте күшті қышқыл не негіз қосқанда органикалық қышқылдар мен оның тұздарыныңдиссоциациялануы кеміп, эфирде еруі артады. Сулы ерітіндіге тұздарды қосып та экстракцияның тиімділігін арттыруға болады. Қазіргі кезде экстракция кендерге өте аз тараған элементтерді байытып, өсімдік материалдарынан қажетті заттарды бөліп алуда кең қолданылып жүр. Қорытынды. Ерітінділер туралы ілімнің дәрігерлер мен фармацевттер үшін ерекше мәні бар, себебі негізгі биологиялық сұйықтықтар, қан плазмасы жұлын сұйықтығы – лимфа сұйық т.б. тірі ағзада ерітінділер күйінде болады. Дәрілік заттар тек ерітінді немесе ағзада еріген күйге көшкен кезде ғана пайдалы. Тағам құрамындағы қоректік заттар ағзаға сіңуі үшін ерітіндіге айналуы керек. Тірі ағзадағы биохимиялық реакциялар ерітінділерде өтеді. Глоссарий 1. Ерітінді — деп кем дегенде екі құрамдас бөліктерден тұратын құрамы өзгермелі гомогенді (біртекті) жүйелер. 2. Идеал ерітінділер - кез келген температура мен концентрацияларда Рауль заңына бағынатын ерітінділер. 3. Реалды ерітінділер - деп біртекті және әртекті молекулалар және арасындағы байланыс күші бірдей емес компоненттерден құралған ерітінділерді айтамыз. 4. Коноваловтың I заңы – ерітінді буында, бастапқы ерітіндінің қайнау температурасын төмендететін немесе ерітінді бетіндегі жалпы қаныққан бу қысымын жоғарылататын компонент мөлшері көп. 5. Коноваловтың II заңы – екі фаза құрамының тұрақтылығын қамтамасыз ететін ерітінді мен оның қаныққан буының тепе-теңдігін жалпы қысым қисығының максимумы қайнау температурасының минимумына сәйкес келуі. 6. Азеотроптык ерітінділер - жеке сұйықтар сияқты тұрақты температурада кайнайды. 7. Шекті сұйытылған ерітінділер - кейбір өте сұйытылған ерітінділер идеал болмаса да Рауль заңына бағынады. 8. Дағдарыстық температура - осы нашар ерудің шексіз (өте жақсы) еруге ауысатын температурасы. 9. “нода” немесе “коннода” - Бір температура сәйкес келетін осындай екі нүктені қосатын түзу.
Дәріс №6
Электролиттердің сулы ерітінділері
Дәрістің мақсаты: ерітінділердің концентрацияларын, титрін, массалық үлесін есептеу, электролиттердің диссоциациялануын және гиздролиз процесінің қандай жағдайларда жүретінін білу.
Ерітінді деп екі немесе бірнеше компоненттен тұратын гомогенді жүйелерді айтады. Компоненттердің агрегаттық күйі бойынша ерітінділерді үш топқа бөлуге болады: газдың-газдағы ерітіндісі, сұйық ерітінділер, қатты ерітінділер. Газ ерітінділеріне ауа, ал қатты ерітінділерге түрлі металдардың қортпалары жатады. Ал сұйық ерітінділер газдардың сұйықтағы ерітінділері, қатты заттардың сұйықтағы ерітінділері, сұйықтың сұйықтағы ерітінділері болып бөлінеді.
Ерітінділер еріген заттан және еріткіштерден тұрады. Заттардың белгілі бір еріткіштегі ерігіштігі шектеулі болады. Сондықтан белгілі бір температурада берілген еріткіште ери алатын зат еріткіш деп аталады. Ерітінділерді ерігіштігіне байланысты жіктейді.
Қаныққан – берілген температурада зат одан әрі ерімейтін ерітінді, яғни ерітінді еритін затпен тепе-теңдікте болады. Қанықпаған – берілген температурада ондағы еритін заттың мөлшері оның қаныққан ерітіндідегісінен аз ерітінді, аса қаныққан ерітінді – бірдей жағдайда қаныққан ерітіндіде еріген затпен салыстырғанда, еріген заты артық болатын ерітінді. Ерігіштік – температура мен қысымға тәуелді. Сонымен бірге ерітінділер сұйық және концентрлі ерітінділер деп те жіктеледі.
Ерітінділердің маңызды сипаттамаларының біріне концентрация жатады. Концентрация – ерітіндінің немесе еріткіштің белгілі мөлшеріндегі еріген заттың мөлшері.
Массалық үлес (пайыздық үлес) – еритін зат шамасының ерітіндінің жалпы шамасына пайыздық қатынасы, пайыздық үлес әр 100 г ерітіндіде еріген заттың (грамм) мөлшерін көрсетеді.
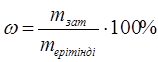 .
.
Молярлық концетрация CМ – 1 л ерітіндідегі еріген заттың мөлшері
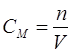 ,
,
мұндағы М – еріген заттың молярлық салмағы, г/моль;
V – ерітінді көлемі,
бензол мен толуол, гексан мен октан, бензол мен дихлорэтаннан тұратын коспалар идеал ерітінділерге жатады. Белгілі бір і құрамдас бөліктің тепе- тендік жағдайда ерітінді мен бу арасында таралуы ол құрамдас бөліктің химиялық потенциалы мен өзара тең болуымен сипатталады: µі (ер) = µі (бу) Егер ерітінді Рауль заңына бағынатын идеал ерітінді болса, жаңағы құрамдас бөліктің химиялық потенциалы мынаған тең: µі = µі (Т)+ RT lnx1 (4) Мұндағы µі (Т) — белгілі бір температура (Т) мен қысымдағы (Р) химиялық немесе изобарлык, потенциал. Кейбір өте сұйытылған ерітінділер идеал болмаса да Рауль заңына бағынады. Оларды шекті сұйытылған ерітінділер деп атайды. Реал ерітінділер Рауль заңына бағынбайды. Ерітінді буының жалпы және оның құрамдас беліктерінің үлестік кысымдары идеал ерітіндінің жалпы және үлестік қысымдарынан көп немесе аз болады. Рауль заңынан оң және теріс ауытқуларды әр түрлі ерітінділерден байқауға болады. Мысалы : ацетон- күкіртті көміртек, ацетон- этанол, су- метанол және т.б оң ауытқу болса, су- азот қышқылы, су- хлорлы сутек, хлороформ- ацетон, хлороформ – бензол т.б.ерітінділерде теріс ауытқуларды байқауға болады. Біртекті молекулаларға қарағанда әртекті молекулалардың ерітіндідегі өзара тартылуы әлсіздеу келеді. Ендеше ондай жағданда молекулалардың сұйық буға айналуы оңайырақ болғандықтан, Рауль заңынан оң ауытқуды байқауға болады. Әр түрлі молекулалардың өзара әрекеттесуі күштірек болса (химиялық қосылыс, сутектік байланыстар түзілу, сольватация), онда молекулалардың газ фазасына ауысуы қиындау болғандықтан, Рауль заңынан теріс ауытқуларды байқаймыз. Молекулалардың сұйықтан буға ауысының жылулық эффектісі болады. Бірдей молекулалардың буға айналуы — теріс, ал әр түрлі молекулардың әрекеттесуі кезінде оң жылулық эффектілер пайда болады. Алайда кейбір ерітінділерде оң және теріс ауытқуларды тудыратын факторлар бірдей әсер ететіндіктен, жылулық эффектілер мен ауытқулар таңбасы сәйкес келмеуі де мүмкін. Коноваловтың I-II заңы.Азеотроптық ерітінділер. Кейбір ерітінділерде идеал оң және теріс ауытқулар ерітінділер заңынан көбірек болады. Ондай жағдайда жалпы бу қысымының қисығында максимум немесе минимум кездеседі. 1881 ж. Д. П. Коновалов будың жалпы қысым қисығында немесе будың қайнау температурасы кисығындағы экстремумда (максимум немесе минимумда) қанықкқан бу мен онымен тепе-теңдікте ерітінді құрамының бірдей болатынын анықтады. Бұл тұжырымдама Коноваловтың II заңы деп аталады. Бұл заңға бағынатын сұйық ерітінділерде бу қисығы мен сұйықтық қисығы экстремумдық нүктеде қиылысатын болады. Осы экстремумдық нүктелердегі ерітінділердің құрамы айдау кезінде өзгермейді. Олар жеке сұйықтар сияқты тұрақты температурада кайнайды. Сондықтан оларды азеотроптык, (бөлінбей қайнайтын) ерітінділер деп атайды.. Кейбір азеотроптық ерітінділер төменде көрсетілген. Азеотроптық (бөлінбей қайнайтын) ерітінділер Құрамдас бөліктер Қайнау температурасы. Азеотроптың құрамы А В А В азеотроп 1 2 3 4 5 6 Максимумдық қайнау температурасы СНзСІ СНзСОСНз 61,2 56.25 64,5 20,5 Н2О НСІ 100 -85 110 20,3 Н2О НNОз 100 85 120 68,0 СНзОСН3 НСІ -23,65 -84 -1,5 40,0 1 _ 2 3 4 5 6 Минимумдық қайнау температурасы С2Н5ОН С6Н6 100 78,3 78,13 95,53 СS2 СНзСОСНз 46,25 56,25 56.25 34,0 СНСІз С2Н5ОН 61,2 78.2 59.З 6,7 Н2О С2Н5ОН 100 78,30 78,15 95,57 Көп жағдайда азеотроптық ерітінділерді химиялык, жолмен бөледі. Азеотроптық құрамдас бөліктері бөлінуін төмен немесе жоғары кысымда айдау аркылы жеңілдетуге болады, мысалы, С2Н5ОН—Н2О ерітіндісінің бетіндегі қысымды сынап бағанасы бойынша 100 мм кеміткенде, азеотроптағы спирттің мөлшері 99,6 мольдік процентке дейін көтеріледі де, оның қайнау температурасы 34,2 ° С-ге дейін төмендейді. Қазіргі кезде азеотропты ерітіндіні бөлу үшін айдау алдында оған үшінші кұрамдас бөлік қосады. Ол басқа бір температурада қайнайтын екі қабаттык жүйе түзеді. Мысалы, абсолюттік (сусыз) спирт алу үшін кәдімгі сатылатын ректификатқа химиялық заттар қосады. Олар кальций оксиді, металдық кальций, сусыз тотығатан сияқты спиртпен әрекеттеспейтін, суды жақсы сіңіретін заттар. Осыған байланысты сусыз таза спирт қайтадан айдағанда алынады. Сұйықтардың өзара еруі. Кез келген екі сұйықтықты араластырсақ, олар өзара үш түрлі жағдайда ериді: 1) екі сұйық өзара өте жақсы еритіндіктен, кез келген қатынаста араласып, гомогендік ерітінді береді (мысалы С2Н5ОН — Н2О, Н2О-ацетон, Н2О-глицерин, т.б. ); 2) екі сұйықтық бір-бірінде аздап қана ериді (мысалы, су-эфир, су-анилин, т.б.); 3) екі сұйықтық бір-бірінде іс жүзінде ерімеуі мүмкін (мысалы, су-сынап, су-бензин т.б.) Бұл үш жағдайдың біріншісі — кәдімгі ерітінді, ал үшінші жағдайдың іс жүзінде маңызы жоқ болғандықтан, тек екінші жағдайға тоқталайық. Бұл жағдай ерітінді буының үлестік қысымының Рауль заңынан оң ауытқуы өте көп болған кезде байқалады. Сұйықтықтардың өзара еруін жүйелі түрде алғаш рет В. Ф. Алексеев зерттеді. Екі сұйықтық анилин мен суды өзара еруі аздап қана болатын жағдайды қарастырайық. Егер анилинге су қосатын болсақ, олар бір-бірінде нашар еритіндіктен, екі қабат түзіледі. Оларды әбден шайқап, біраз қойғаннан соң қайтадан екі қабатқа балінеді: жоғары қабаты-анилинге қаныққан су қабаты, ал төменгісі суға қаныққан анилиннің қабаты. Осы екі кабаттың құрамы температураға байланысты өзгереді және әр қабаттың құрамында екінші еритін сұйықтық мөлшері көбейеді. Оны мына мәліметтерден көруге болады. 4.2-кесте Температура °С 20 60 100 140 160 168 100 г ерітіндіде 1 г Н2О баранилиннің қабаты 5,0 5,8 8,5 11,9 28,8 51,4 100 г ерітіндіде 1 г анилин бар су кабаты 3,1 3,8 7,21 10,5 24,9 48,6 4.2-кестеден температура артқан сайын анилин қабатында біртіндеп су мөлшерінің, ал су қабатында анилин мөлшерінің көбейетінін көреміз. 168°С температураға дейін әр кабаттың құрамдарының айырмашылығы кемиді ал 168°С температурада екі сұйықтық бір-бірінде шексіз ериді. Осы нашар ерудің шексіз (өте жақсы) еруге ауысатын температурасы дағдарыстық температура деп аталады. Бұл терминді алғаш В. Ф. Алсксеев енгізген. Су-анилин жүйе күйінің диаграммасы 3.5.1-суретте көрсетілген. Өзара еру қисығы бөліну қисығы немесе бинодальдық қисық деп аталады. Никотин 3.5.1-сурет. Су-анилин жүйесінің 3.5.2-сурет. Никотин-су жүйссінің диаграммасы. диаграммасы. Осы қисықтың сыртқы алаңы гомогендік әр түрлі құрамдағы сұйық ерітіндіге сәйкес келеді. Ал қисықпен шектелген алаң екі сұймқтықтың тепе-теқдікте болатын гетерогендік аймағы болып табылады. Қисықтағы кез келген нүкте белгілі бір температурадағы тепе-тендік қабаттарының құрамын сипаттайды. Бір температура сәйкес келетін осындай екі нүктені қосатын түзу АА “нода” немесе “коннода” деп аталады. Сұйықтықтың шексізеруіне сәйкес келетін нүкте (К) ерудің дағдарыстық температурасы болады. Өзара шектеле еритін фенол-су, күкіртті көміртек-метил спирті сияқты қоспаларда да температура артқан сайын өзара ерігіштік көбейіп, жоғары бір температурада яғни дағдарыстық температурада шексіз ерігіштікке айналады. Кей жағдайда температура артқан сайын екі сұйықтықтың өзара ерігіштігі кемиді. Мұндай жағдайлар үшін екі сұйықтықтың шексіз ерігіштігі ең төменгі температурада яғни төменгі дағдарыстық температурада болатыны байқалады. Мысалы, коллидин мен су үшін “төменгі” дағдарыстық температура — 57°С. Коллидин дегеніміз — триметилпиридин С5Н2(СНз)зN. Төменгі дағдарыстық температураны триметиламин-су (12,5°С), метилпипиридин-су (480 С) сияқты басқа да жүйелерден байқауға болады. Шексіз ерігіштіктері жоғары және төменгі температуларда байқалатын жүйелер бар. Олардың жоғары және төменгі дағдарыстық температуралары болады. Мысалы, су-никотин жүйесінде 2 дағдарыстық температура бар (3.5.2-сурет). Мұндағы жоғары дағдарыстық температура (К1) — 207°С, ал төменгі дағдарыстық температураға (К2)— 60,8°С сәйкес келеді. Төменгі дағдарыстық температурада шексіз еріген ерітінді құрамында — 29%, ал жоғарғы дағдарыстық' температурада 32% никотин болады. Жүйеге үшінші бір затты енгізгенде екі сұйықтың өзара еруі өзгереді. Егер осы үшінші зат екі сұйықтықта да еритін болса, онда екі сұйықтықтың өзара еруі артады. Мысалы, егер жүйеге LiJ- тың қажетті мөлшерін енгізсе, онда су мен анилиннің кез
келген температурада, кез келген қатынаста бір-бірінде шексіз еритінін байқаймыз. Егер үшінші құрамдас бөлік екі сұйықтықтың біреуінде ғана ерісе, онда олардың өзара ерігіштігі әдетте кемиді. Мысалы, фенол су жүйесінде 3% КСІ ерітсе, ол жүйенің дағдарыстық температурасы 30 градусқа артады. Кейбір жағдайларда жүйеге үшінші қүрамдас бөлікті енгізгенде біртекті ерітінді екі қабатқа бөлінеді. Мысалы, су-спирт біртекті ерітіндісі кальций карбонатын қосқанда екі қабатқа бөлінеді: біреуі — сусыз этил спирті, ал екіншісі — К2СОз-тің судағы ерітіндісі. Ерігіштіктің түз катысуында кемуін ығыстырылу деп атайды. Егер өзара ерігіштік өте аз болса (мысалы, су-бензол тәрізді бір-бірінде іс жүзінде ерімейтін сұйықтықтар), онда әр сұйықтықтың қоспа бетіндегі қысымы сол таза сұйықтық бетіндегі қысымға, ал жалпы қысым таза сұйықтықтың сол температурадағы қысымдарының қосындысына яғни Р = Р01 + Р02-ға тең болады.. Өзара ерімейтін сұйықтықтар қоспасының қайнау температурасы жеке сұйықтықтың қайнау температурасынан төмен болып кетеді. Бу қысымының құрамы сұйықтықтар қоспасының құрамына тәуелсіз болады, ейткені құрамдас бөліктердін мольдік үлестері X және (1 - X) сол температурада тұрақты шамалармен (Р01 жәнс Р02) анықталады: Х=Р01 / (Р01+Р02) және (1-Х)= Р02 / (Р01+Р02) Аздап ұшатын сұйықты басқа ұшқыш, бірақ ерігіштігі аз, химиялық әрекеттеспейтін сұйықпен араластырып қайнатқанда, оның қайнау температурасының кемуі сұйық қоспаларды су буымен айдауда жиі қолданылады. Аса қыздырылған су буын қолдана отырып, сумен араласпайтын сұйықты қаныққан буының қысымын арттыру арқылы белгілі бір жоғарырақ температураға дейін ыдыратпай қыздыру арқылы айдау кезінде заттың еруін арттыруға болады. Бұл тәсіл органикалық технология мен лабораторияларда жиі пайдаланылады. Мысалы, эфирмайларын осы тәсілмен айдайды. Сұйықтарды сипаттайтын термодинамикалық теңдеулерде реал ерітінділердің і құрамдас баліктерінің химиялық потенциалын жазғанда, оның мольдік үлесінің орнына сол құрамдас бөліктің активтілігі колданылады: m = m° = m і0 (Т) + RТ 1п аі (7) Тендеуді (7) кез келген идеал емес ерітінділерге колдануға болады. Реал ерітінділердегі әрекеттесуді есепке алу үшін қолданылатын активтілік ерітіндісінің идеал ерітінді занынан ауыткуын түсіндірмесе де, ерітінді термодинамикасын математикалық түрде көрсетуге мүмкітідік береді. Активтік немесе активтілік коэффициентін (аі) бу мен идеал газ қысымының қатынасымен бу және реал газ ұшқыштықтарының қатынасы арқылы табуға болады: аі = Рі / Рі0 (8а) аі = f і / f і0 (8Ә) Активтілікті тек осы формулалар арқылы ғана емес, сонымен қатар қайнау температурасы мен қату температурасын, электр қозғаушы күшті өлшеу т.б. арқылы да табуға болады. Ол тәсілдерді кейінірек қарастырамыз. Заттың өзара араласпайтын екі еріткіште таралуы. Егер өзара ерімейтін екі сұйықты араластырсақ, онда таза сұйықтардан екі қабат түзіледі. Енді осы жүйеге екі сұйықта да еритін үшінші бір құрамдас бөлікті қоссақ, онда тепе-теңдік орныкканда, ол сүйықтардағы ерігіштігі бірдей болмағандықтан екі түрлі концентрация (қоюлық) көрсетіп, таралады. Тепе-теңдіктің орнығу жағдайы сол заттың екі фазадағы химиялық потенциалының теңесуі яғни: m’3 = m3’’ ендеше: m 30 ‘+ RТ 1п х3’ = m 30’’ (Т) + RТ 1п x3 (9) 9-тендеудегі хз және хз — үшінші заттың бірінші және екінші фазадағы мольдік үлестері. Осы теңдеуді (9) түрлендіріп, мынадай өрнек алуға болады: 1п (Хз'/Хз")=( m 3°"+m 3°') RТ=f (Т)=сопst (10) 10-теңдеу белгілі бір температурада заттың әр фазадағы мольдік үлесінің көрінісі болып табылады. Демек: Х3’ /Х3" = Km-y болады. (11) Мұндағы Кт-у таралу түрақтысы деп аталады. Ол температураға байланысты шама және белгілі- бір температурада тұрақты болады. Жоғарыда айтылғандай, егер ерітінді идеал емес болса, онда 11-тендеудегі мольдік үлестердің орнына заттың активтілігін, ал ерітіндісұйытылған болса, онда заттың концентрациясын (қоюлығын) пайдаланып таралу тұрақтысын табуға болады: а3'/а3" = Кт-у (12а) С3'/С3" = Кт-у (12Ә) Сұйытылған ерітінділерде бірнеше зат болса, олардың әрқайсысы екі фазада әр заттың таралу коэффицентіне байланысты таралады.Жеке заттың таралу коэффициенті-басқа заттардың болу- болмауына тәуелсіз шама. Бұл тұжырымдаманы 1890 ж. Нернст айтқан болатын. Таралу коэффициенттерін өлшеу арқылы еріген заттың активтілігің анықтауға болады. Таралу заңы сол ерігін затты бөліп жиып алуға мүмкіндік береді. Егер еріген заттың екінші еріткіштен ерігіштігі көп болса, ерітіндіге сол еріткішті қоса отырып, барлық затты осы еріткішке ауыстыруға болады. Кендерді байытудың бір тәсілі — эксракция осы таралу заңына негізделген. Мысалы, суда еріген органикалық заттарды эфирмен экстракциялағанда оған күшті қышқыл немесе күшті негіз қосады. Сонда оның ерігіштігі артады. Себебі органикалық қышқылдар мен оның тұздары суда аздап болса да иондарға диссоцияланады. Ал эфирде тек диссоциацияланбаған молекулалар ғана ериді. Өте күшті қышқыл не негіз қосқанда органикалық қышқылдар мен оның тұздарыныңдиссоциациялануы кеміп, эфирде еруі артады. Сулы ерітіндіге тұздарды қосып та экстракцияның тиімділігін арттыруға болады. Қазіргі кезде экстракция кендерге өте аз тараған элементтерді байытып, өсімдік материалдарынан қажетті заттарды бөліп алуда кең қолданылып жүр. Қорытынды. Ерітінділер туралы ілімнің дәрігерлер мен фармацевттер үшін ерекше мәні бар, себебі негізгі биологиялық сұйықтықтар, қан плазмасы жұлын сұйықтығы – лимфа сұйық т.б. тірі ағзада ерітінділер күйінде болады. Дәрілік заттар тек ерітінді немесе ағзада еріген күйге көшкен кезде ғана пайдалы. Тағам құрамындағы қоректік заттар ағзаға сіңуі үшін ерітіндіге айналуы керек. Тірі ағзадағы биохимиялық реакциялар ерітінділерде өтеді. Глоссарий 1. Ерітінді — деп кем дегенде екі құрамдас бөліктерден тұратын құрамы өзгермелі гомогенді (біртекті) жүйелер. 2. Идеал ерітінділер - кез келген температура мен концентрацияларда Рауль заңына бағынатын ерітінділер. 3. Реалды ерітінділер - деп біртекті және әртекті молекулалар және арасындағы байланыс күші бірдей емес компоненттерден құралған ерітінділерді айтамыз. 4. Коноваловтың I заңы – ерітінді буында, бастапқы ерітіндінің қайнау температурасын төмендететін немесе ерітінді бетіндегі жалпы қаныққан бу қысымын жоғарылататын компонент мөлшері көп. 5. Коноваловтың II заңы – екі фаза құрамының тұрақтылығын қамтамасыз ететін ерітінді мен оның қаныққан буының тепе-теңдігін жалпы қысым қисығының максимумы қайнау температурасының минимумына сәйкес келуі. 6. Азеотроптык ерітінділер - жеке сұйықтар сияқты тұрақты температурада кайнайды. 7. Шекті сұйытылған ерітінділер - кейбір өте сұйытылған ерітінділер идеал болмаса да Рауль заңына бағынады. 8. Дағдарыстық температура - осы нашар ерудің шексіз (өте жақсы) еруге ауысатын температурасы. 9. “нода” немесе “коннода” - Бір температура сәйкес келетін осындай екі нүктені қосатын түзу.
Дәріс №6
Электролиттердің сулы ерітінділері
Дәрістің мақсаты: ерітінділердің концентрацияларын, титрін, массалық үлесін есептеу, электролиттердің диссоциациялануын және гиздролиз процесінің қандай жағдайларда жүретінін білу.
-
Ерітінділердің концентрацияларын, титрін, массалық үлесін есептееу. -
Электролиттердің диссоциациялануы. -
Гидролизі процесі.
Ерітінді деп екі немесе бірнеше компоненттен тұратын гомогенді жүйелерді айтады. Компоненттердің агрегаттық күйі бойынша ерітінділерді үш топқа бөлуге болады: газдың-газдағы ерітіндісі, сұйық ерітінділер, қатты ерітінділер. Газ ерітінділеріне ауа, ал қатты ерітінділерге түрлі металдардың қортпалары жатады. Ал сұйық ерітінділер газдардың сұйықтағы ерітінділері, қатты заттардың сұйықтағы ерітінділері, сұйықтың сұйықтағы ерітінділері болып бөлінеді.
Ерітінділер еріген заттан және еріткіштерден тұрады. Заттардың белгілі бір еріткіштегі ерігіштігі шектеулі болады. Сондықтан белгілі бір температурада берілген еріткіште ери алатын зат еріткіш деп аталады. Ерітінділерді ерігіштігіне байланысты жіктейді.
Қаныққан – берілген температурада зат одан әрі ерімейтін ерітінді, яғни ерітінді еритін затпен тепе-теңдікте болады. Қанықпаған – берілген температурада ондағы еритін заттың мөлшері оның қаныққан ерітіндідегісінен аз ерітінді, аса қаныққан ерітінді – бірдей жағдайда қаныққан ерітіндіде еріген затпен салыстырғанда, еріген заты артық болатын ерітінді. Ерігіштік – температура мен қысымға тәуелді. Сонымен бірге ерітінділер сұйық және концентрлі ерітінділер деп те жіктеледі.
Ерітінділердің маңызды сипаттамаларының біріне концентрация жатады. Концентрация – ерітіндінің немесе еріткіштің белгілі мөлшеріндегі еріген заттың мөлшері.
Массалық үлес (пайыздық үлес) – еритін зат шамасының ерітіндінің жалпы шамасына пайыздық қатынасы, пайыздық үлес әр 100 г ерітіндіде еріген заттың (грамм) мөлшерін көрсетеді.
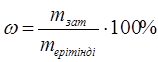 .
.Молярлық концетрация CМ – 1 л ерітіндідегі еріген заттың мөлшері
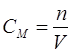 ,
,мұндағы М – еріген заттың молярлық салмағы, г/моль;
V – ерітінді көлемі,