ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.11.2023
Просмотров: 199
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
л;
mзат – еріген заттың шамасы, г.
Еріген зат шамасының ерітінді көлеміне қатынасы моль/л белгіленеді.
Мольдік үлесN – еріген зат санының немесе еріткіштің ерітіндідегі барлық зат санының мөлшеріне қатынасы. Еріткіш және бір еріген заттан тұратын жүйеде, соңғының мольдік үлесі тең
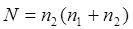 .
.
Мұнда n1, n2 – еріткіштің және еріген заттың моль санына сәйкес.
Моляльдық концентрация 1000 г еріткіште еріген заттың моль саны көрсетіледі
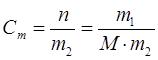 ,
,
мұндағы n – еріген заттың моль саны;
m1 – еріген заттың массасы;
m2 – еріткіштін массасы;
M – еріген заттың молярлық массасы.
Эквиваленттік немесе нормальдық концентрация – Сн еріген заттың грамм эквивалент шамасы
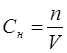 .
.
Титр – еріген зат массасының ерітінді көлеміне қатынасын көрсетеді. Өлшем бірлігі: г/мл:
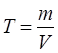 ,
, 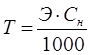 .
.
Ерітінділердің еруі еритін заттардың табиғатына, ерітіндінің концентрациясына, температурасына байланысты.
Ерітіндінің қайнау температурасының жоғарлауы мен қату температурасының төмендеуі еріген заттың концентрациясына тура пропорционалды тәуелділікте болады.
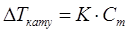 ,
,
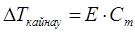 .
.
Мұнда Сm – моляльдық концентрация;
DТқату = Tеріткіштің қату температурасы – Терітіндінің қату температурасы;
DТқайнау = Tерітіндінің қайнау температурасы – Теріткіштің қайнау температурасы;
Е және K – эбулиоскопиялық және криоскопиялық тұрақты шама, табиғи еріткішке қатысты.
Жартылай өткізгіш қалқа арқылы еріткіштің бір жақты диффузия құбылысы
осмос деп аталады. Еріткіштің молекулаларына жартылай өткізгіш қалқа арқылы өтуіне кедергі болатын жазықтықтың бірлігіне әсер ететін күш осмостық қысым деп аталады. Осмостық қысым Р еріген заттың және ерітінді температурасының концентрациясына тікелей қатынасы бар
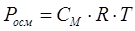 ,
,
мұнда CM – молярлық концентрация;
Т – абсолюттік температура.
Ерітіндіде иондарға – катиондар мен аниондарға бөлініп ыдырайтын заттарды электролит деп атайды. Осы заттардың ерітіндісі электр тогын өткізеді. Қышқылдар, негіздер және тұздар электролиттер болып табылады. Электролиттер молекулаларының катион мен аниондарға бөлініп ыдырау үрдісін электролиттік диссоциация деп атайды:
CH3COOH ↔ H+ + CH3COO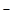 ,
,
Сонда
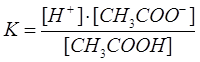 ,
,
K – диссоциациялану константасы.
Ыдырамаған молекулалардың концентрациясы мен иондар концентрациясының ара қатынасына байланысты барлық электролиттер күшті, орташа және әлсіздерге бөлінеді. Егер заттардың молекулалары ерітіндіде толық бөлініп ыдыраса, онда оларды күшті электролиттер деп атайды (HCl, HBr, HI, HClO4, H2SO4, HNO3, LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2, НMnO4).
Егер заттардың молекулалары ерітіндіде толық бөлініп ыдырамаса, онда орташа немесе әлсіз электролиттер деп атайды(CH3COOH, C2H5COOH, H2CO3, H2S, Cu(OH)2, Al(OH)3, NH4OH, су, HNO2, H2SO3, H2O2, H2SiO3, HF, HCN). Орташа және әлсіз электролиттердің ерітіндісінде иондармен қатар ионды емес молекулалар бар. Электролиттің сандық сипаттамасы иондарға бөлініп ыдырауға мүмкіндік туғызатын электролиттік ыдырау дәрежесі (α) болып табылады. Бұл электролиттің жалпы санынан (N) қаншасы иондарға ыдырайтынын көрсетеді. Осы ерітіндіде иондарға бөлініп ыдырайтын молекула саны (n) мен ерітіндідегі электролит молекулаларының жалпы санының (N) арасындағы өзара қатынас электролиттік бөлініп ыдырау дәрежесіне тең.
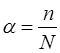 .
.
Диссоциациялану дәрежесі неғұрлым көп болса, электролит соғұрлым күштірек болады және мұндай ерітінді соғұрлым үлкен электр өткізгіштікке ие болады. Сондықтан диссоциациялану дәрежесін электр өткізгіштікті өлшеп табуға болады.
Диссоциациялану константасы мен дәрежесі келесі қатынаспен байланысқан (Освальдтың сұйылту заңы):
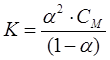 ,
,
мұнда СМ – электролиттің молекулалық концентрациясы.
Ыдыраудың шамасы диссоциация константасы мен дәрежесінің ара қатынасы Оствальдтың сұйылту заңына байланысты
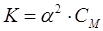 ,
,
одан
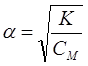 .
.
Ерітіндіні сұйылту ыдырау дәрежесінің өсетінін көрсетеді.
Концентрацияға тәуелді болатын электролит ерітінділер қасиеттері (қату температурасының төмендеуі, қайнау температурасының жоғарылауы, осмостық қысым) Вант-Гофф заңына бағыттайды, себебі диссоциация кезінде ерітіндінің концентрациясы артады. Берілген ерітіндінің сандық қасиеттерін сипаттау үшін Вант-Гофф теңдеуіне көбейткіш i – изотондық коэффициент енгізген. Электролиттер үшін
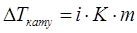 ,
,
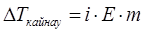 ,
,
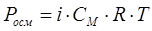 .
.
Изотондық коэффициенті DТқату, DТқайнау, Росм эксперимент өлшемдерін есептеу арқылы анықталған өлшемдермен салыстыра отырып табады.
Ерітіндідегі иондар жағдайын бағалау үшін активті – тиімділік ұғымы, иондар концентрациясының химиялық реакцияға сәйкестігі. Активті ион оның концентрациясына және коэффициент активтігінің көбейтіндісіне тең коэффициент активтілігі f:
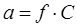 .
.
Коэффициент активтілігі әртүрлі иондарға әртүрлі. Концентрацияның өзгеруіне байланысты былай өзгереді. Мысалы: егер f<1, иондар арасындағы әрекеттесу оларды біріктіруге әкеледі. Егер f»1, онда иондар арасындағы әрекеттесулері әлсіз болып келеді .
Сұйытылған ерітінділер табиғатына активтілік коэффициенті аз әсер етеді. Жуықтап алғанда, коэффициент активтілігі ионның зарядымен қатар ерітіндінің иондық күшіне тәуелді I, жартылай барлық ерітіндінің концентрациясының квадратына тең:
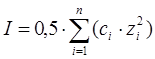 ,
,
мұндағы z – ионның заряды.
Дебай-Хюккель теориясына сәйкес, электролиттің активтілік коэффициенті ерітіндінің иондық күшімен келесі қатынаспен байланысқан:
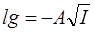 .
.
Сутектік көрсеткіш. Таза су аз мөлшерінде өзін құрайтын иондарға диссоциацияланады:
H2O → H+ + OH ,
,
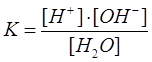 .
.
K – судың диссоциация тұрақтысы; оның 22°С-дағы мәні тең:
K = 1,8∙10-16.
Судың өте аз мөлшері ғана иондарға ыдырайтындықтан теңдеудегі судың концентрациясын тұрақты шама деп есептеуге болады, ол 1 л. Массасын судың молярлық массасына бөлгенге тең:
[H2O] = 1000/18 = 55,56 моль.
Енді жоғарыдағы теңдеуді былай жазуға болады:
[H+][OH ] = K∙[H2O] = Kс.
] = K∙[H2O] = Kс.
Kс – судың иондық көбейтіндісі деп аталатын тұрақты шама. Судың иондық көбейтіндісінің сандық мәнін табамыз:
Kс = [H+][OH ] = 1,8∙10-16 ∙55,56 = 1∙10-14.
] = 1,8∙10-16 ∙55,56 = 1∙10-14.
Таза суда сутегі ионының концентрациясы гидроксид ионының концентрациясына тең, өйткені судың бір мелекуласында бір Н+бір ОН түзіледі, яғни бұл иондардың әрқайсысының 22°С-дағы концентрациясы өзара тең болады:
түзіледі, яғни бұл иондардың әрқайсысының 22°С-дағы концентрациясы өзара тең болады:
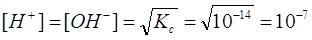 .
.
Ерітіндінің қышқылдығын немесе сілтілігін анықтау үшін сутегі иондарының конценрациясын қолданады. Бұл жағдайда бейтарап орта үшін [H+] = 10-7, сілтілік ортада [H+] > 10-7, қышқылдық ортада [H+] < 10-7.
Сутектік көрсеткіш деп сутек иондары концентрациясының теріс таңбамен алынған ондық логарифмін айтады:
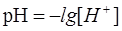
.
Гидролиз дегеніміз – тұз иондары мен су иондары әрекеттескенде әлсіз электролит түзілуі нәтижесінде ерітіндідегі сутегі және гидроксид иондары өзгеруі арқылы жүретін реакцияны айтады.
Гидролизге келесі тұздар ұшырайды: әлсіз қышқыл және күшті негіз; әлсіз негіз және күшті қышқыл; әлсіз қышқыл және әлсіз негіз.
Күшті негіз және күшті қышқыл гидролизденбейді, нәтижесінде бейтараптану процесі жүреді. Әлсіз қышқыл және күшті негіз арасындағы гидролиз (натрий ацетаты):
CH3COONa + H2O = CH3COOH + NaOH,
CH3COO + H2O = CH3COOH + OH
+ H2O = CH3COOH + OH .
.
Бұл жағдайда анион тұзы гидролизге ұшырайды, нәтижесінде ОН- ион түзіледі. Реакция ортасы – сілтілік.
Әлсіз негіз және күшті қышқыл арасындағы гидролиз:
NH4NO3 + H2O = NH4OH + HNO3,
NH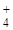 + H2O = NH4OH + H+.
+ H2O = NH4OH + H+.
Бұл жағдайда тұздың катионы Н+ түзіледі . Реакция ортасы – қышқылдық.
Әлсіз негіз және әлсіз қышқыл арасындағы гидролиз:
CH3COONH4 + H2O = CH3COOH + NH4OH,
CH3COO + NH
+ NH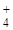 + H2O = CH3COOH + NH4OH.
+ H2O = CH3COOH + NH4OH.
Гидролиз бұл жағдайда катионды және анионды бірден екі әлсіз электролит түзіледі.
Дәріс №7
Электролит ертінділеріндегі алмасу реакциялары
Дәрістің мақсаты: электролит ерітінділеріндегі алмасу реакцияларын қарастырып оқу.
Электролиттік диссоцияция теор б – ша ерітінділер екі түрде бөлінеді
mзат – еріген заттың шамасы, г.
Еріген зат шамасының ерітінді көлеміне қатынасы моль/л белгіленеді.
Мольдік үлесN – еріген зат санының немесе еріткіштің ерітіндідегі барлық зат санының мөлшеріне қатынасы. Еріткіш және бір еріген заттан тұратын жүйеде, соңғының мольдік үлесі тең
Мұнда n1, n2 – еріткіштің және еріген заттың моль санына сәйкес.
Моляльдық концентрация 1000 г еріткіште еріген заттың моль саны көрсетіледі
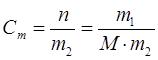 ,
, мұндағы n – еріген заттың моль саны;
m1 – еріген заттың массасы;
m2 – еріткіштін массасы;
M – еріген заттың молярлық массасы.
Эквиваленттік немесе нормальдық концентрация – Сн еріген заттың грамм эквивалент шамасы
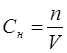 .
. Титр – еріген зат массасының ерітінді көлеміне қатынасын көрсетеді. Өлшем бірлігі: г/мл:
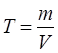 ,
, 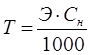 .
.Ерітінділердің еруі еритін заттардың табиғатына, ерітіндінің концентрациясына, температурасына байланысты.
Ерітіндінің қайнау температурасының жоғарлауы мен қату температурасының төмендеуі еріген заттың концентрациясына тура пропорционалды тәуелділікте болады.
Мұнда Сm – моляльдық концентрация;
DТқату = Tеріткіштің қату температурасы – Терітіндінің қату температурасы;
DТқайнау = Tерітіндінің қайнау температурасы – Теріткіштің қайнау температурасы;
Е және K – эбулиоскопиялық және криоскопиялық тұрақты шама, табиғи еріткішке қатысты.
Жартылай өткізгіш қалқа арқылы еріткіштің бір жақты диффузия құбылысы
осмос деп аталады. Еріткіштің молекулаларына жартылай өткізгіш қалқа арқылы өтуіне кедергі болатын жазықтықтың бірлігіне әсер ететін күш осмостық қысым деп аталады. Осмостық қысым Р еріген заттың және ерітінді температурасының концентрациясына тікелей қатынасы бар
мұнда CM – молярлық концентрация;
Т – абсолюттік температура.
Ерітіндіде иондарға – катиондар мен аниондарға бөлініп ыдырайтын заттарды электролит деп атайды. Осы заттардың ерітіндісі электр тогын өткізеді. Қышқылдар, негіздер және тұздар электролиттер болып табылады. Электролиттер молекулаларының катион мен аниондарға бөлініп ыдырау үрдісін электролиттік диссоциация деп атайды:
CH3COOH ↔ H+ + CH3COO
Сонда
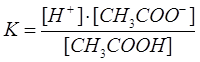 ,
, K – диссоциациялану константасы.
Ыдырамаған молекулалардың концентрациясы мен иондар концентрациясының ара қатынасына байланысты барлық электролиттер күшті, орташа және әлсіздерге бөлінеді. Егер заттардың молекулалары ерітіндіде толық бөлініп ыдыраса, онда оларды күшті электролиттер деп атайды (HCl, HBr, HI, HClO4, H2SO4, HNO3, LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2, НMnO4).
Егер заттардың молекулалары ерітіндіде толық бөлініп ыдырамаса, онда орташа немесе әлсіз электролиттер деп атайды(CH3COOH, C2H5COOH, H2CO3, H2S, Cu(OH)2, Al(OH)3, NH4OH, су, HNO2, H2SO3, H2O2, H2SiO3, HF, HCN). Орташа және әлсіз электролиттердің ерітіндісінде иондармен қатар ионды емес молекулалар бар. Электролиттің сандық сипаттамасы иондарға бөлініп ыдырауға мүмкіндік туғызатын электролиттік ыдырау дәрежесі (α) болып табылады. Бұл электролиттің жалпы санынан (N) қаншасы иондарға ыдырайтынын көрсетеді. Осы ерітіндіде иондарға бөлініп ыдырайтын молекула саны (n) мен ерітіндідегі электролит молекулаларының жалпы санының (N) арасындағы өзара қатынас электролиттік бөлініп ыдырау дәрежесіне тең.
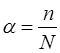 .
. Диссоциациялану дәрежесі неғұрлым көп болса, электролит соғұрлым күштірек болады және мұндай ерітінді соғұрлым үлкен электр өткізгіштікке ие болады. Сондықтан диссоциациялану дәрежесін электр өткізгіштікті өлшеп табуға болады.
Диссоциациялану константасы мен дәрежесі келесі қатынаспен байланысқан (Освальдтың сұйылту заңы):
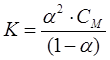 ,
,мұнда СМ – электролиттің молекулалық концентрациясы.
Ыдыраудың шамасы диссоциация константасы мен дәрежесінің ара қатынасы Оствальдтың сұйылту заңына байланысты
одан
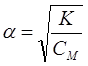 .
. Ерітіндіні сұйылту ыдырау дәрежесінің өсетінін көрсетеді.
Концентрацияға тәуелді болатын электролит ерітінділер қасиеттері (қату температурасының төмендеуі, қайнау температурасының жоғарылауы, осмостық қысым) Вант-Гофф заңына бағыттайды, себебі диссоциация кезінде ерітіндінің концентрациясы артады. Берілген ерітіндінің сандық қасиеттерін сипаттау үшін Вант-Гофф теңдеуіне көбейткіш i – изотондық коэффициент енгізген. Электролиттер үшін
Изотондық коэффициенті DТқату, DТқайнау, Росм эксперимент өлшемдерін есептеу арқылы анықталған өлшемдермен салыстыра отырып табады.
Ерітіндідегі иондар жағдайын бағалау үшін активті – тиімділік ұғымы, иондар концентрациясының химиялық реакцияға сәйкестігі. Активті ион оның концентрациясына және коэффициент активтігінің көбейтіндісіне тең коэффициент активтілігі f:
Коэффициент активтілігі әртүрлі иондарға әртүрлі. Концентрацияның өзгеруіне байланысты былай өзгереді. Мысалы: егер f<1, иондар арасындағы әрекеттесу оларды біріктіруге әкеледі. Егер f»1, онда иондар арасындағы әрекеттесулері әлсіз болып келеді .
Сұйытылған ерітінділер табиғатына активтілік коэффициенті аз әсер етеді. Жуықтап алғанда, коэффициент активтілігі ионның зарядымен қатар ерітіндінің иондық күшіне тәуелді I, жартылай барлық ерітіндінің концентрациясының квадратына тең:
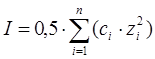 ,
, мұндағы z – ионның заряды.
Дебай-Хюккель теориясына сәйкес, электролиттің активтілік коэффициенті ерітіндінің иондық күшімен келесі қатынаспен байланысқан:
Сутектік көрсеткіш. Таза су аз мөлшерінде өзін құрайтын иондарға диссоциацияланады:
H2O → H+ + OH
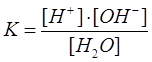 .
. K – судың диссоциация тұрақтысы; оның 22°С-дағы мәні тең:
K = 1,8∙10-16.
Судың өте аз мөлшері ғана иондарға ыдырайтындықтан теңдеудегі судың концентрациясын тұрақты шама деп есептеуге болады, ол 1 л. Массасын судың молярлық массасына бөлгенге тең:
[H2O] = 1000/18 = 55,56 моль.
Енді жоғарыдағы теңдеуді былай жазуға болады:
[H+][OH
Kс – судың иондық көбейтіндісі деп аталатын тұрақты шама. Судың иондық көбейтіндісінің сандық мәнін табамыз:
Kс = [H+][OH
Таза суда сутегі ионының концентрациясы гидроксид ионының концентрациясына тең, өйткені судың бір мелекуласында бір Н+бір ОН
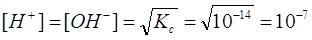 .
.Ерітіндінің қышқылдығын немесе сілтілігін анықтау үшін сутегі иондарының конценрациясын қолданады. Бұл жағдайда бейтарап орта үшін [H+] = 10-7, сілтілік ортада [H+] > 10-7, қышқылдық ортада [H+] < 10-7.
Сутектік көрсеткіш деп сутек иондары концентрациясының теріс таңбамен алынған ондық логарифмін айтады:
.
Гидролиз дегеніміз – тұз иондары мен су иондары әрекеттескенде әлсіз электролит түзілуі нәтижесінде ерітіндідегі сутегі және гидроксид иондары өзгеруі арқылы жүретін реакцияны айтады.
Гидролизге келесі тұздар ұшырайды: әлсіз қышқыл және күшті негіз; әлсіз негіз және күшті қышқыл; әлсіз қышқыл және әлсіз негіз.
Күшті негіз және күшті қышқыл гидролизденбейді, нәтижесінде бейтараптану процесі жүреді. Әлсіз қышқыл және күшті негіз арасындағы гидролиз (натрий ацетаты):
CH3COONa + H2O = CH3COOH + NaOH,
CH3COO
Бұл жағдайда анион тұзы гидролизге ұшырайды, нәтижесінде ОН- ион түзіледі. Реакция ортасы – сілтілік.
Әлсіз негіз және күшті қышқыл арасындағы гидролиз:
NH4NO3 + H2O = NH4OH + HNO3,
NH
Бұл жағдайда тұздың катионы Н+ түзіледі . Реакция ортасы – қышқылдық.
Әлсіз негіз және әлсіз қышқыл арасындағы гидролиз:
CH3COONH4 + H2O = CH3COOH + NH4OH,
CH3COO
Гидролиз бұл жағдайда катионды және анионды бірден екі әлсіз электролит түзіледі.
Дәріс №7
Электролит ертінділеріндегі алмасу реакциялары
Дәрістің мақсаты: электролит ерітінділеріндегі алмасу реакцияларын қарастырып оқу.
-
Электролиттік диссоциация теориясы туралы қазіргі түсініктер. -
ЭД – ға әсер етуші факторлар. -
ЭД дәрежесі. -
Күшті және әлсіз электролиттер. -
Диссоциацияның мүмкін болатын дәрежесі.
Электролиттік диссоцияция теор б – ша ерітінділер екі түрде бөлінеді