ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.11.2023
Просмотров: 47
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Практическая работа
на тему:
Синтез этилбензоата
Выполнил:
Николина А.А.
Содержание
Введение
1. Теоретическая часть
1.1 формула соединения и его название
1.2 Физические свойства
1.3 Химические свойства
1.4 Методы получения
1.5 Примечание
2. Экспериментальная часть
Вывод
Список цитируемой литературы
Список используемой литературы
Введение
Органический синтез - это получение вещества заданного строения путем целенаправленного изучения структуры исходных соединений.
При получении любого органического соединения возможны два случая: необходимый препарат уже известен, для него разработаны и описаны в литературе методы получения, либо необходимое вещество не описано. В первом случае задача сводится к описанию всех известных методик синтеза и выбору оптимальной. Наиболее применимым является метод, предполагающий использование доступного сырья с наименьшими энергетическими и трудовыми затратами. Особенностью взаимодействия органических веществ является возможность протекания многочисленных побочных реакций. Преимущества метода получения заданного препарата могут быть сведены на нет трудностью его выполнения и очистки. В этих случаях, если это возможно, предпочтительнее многостадийный синтез, более сложный, но дающий возможность получить относительно чистый препарат или же смесь веществ, резко отличающихся по температурам кипения или растворимости, что позволяет легко растворить его.
Цель данной работы - применить на практике все теоретические знания по курсу органической химии. Целью литературного синтеза является изучение свойств и методик получения этилбензоата.
1. Теоретическая часть
1.1 Формула соединения и его названия

этилбензоат - систем. наименование;
этиловый эфир бензойной кислоты - тривиальное наименование.
1.2 Физические свойства
(данные из практикума Храмкина М. Н. «Практикум по орг. синтезу» [1])
Этиловый эфир бензойной кислоты (этилбензоат) - бесцветная жидкость с фруктовым запахом.
Температура кипения  ; температура плавления
; температура плавления  . Хорошо растворим в этиловом спирте, серном эфире, хлороформе. Нерастворим в воде.
. Хорошо растворим в этиловом спирте, серном эфире, хлороформе. Нерастворим в воде.  ;
;  . Мол. Вес 150,17.
. Мол. Вес 150,17.
1.3 Химические свойства
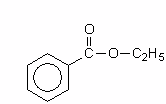
Химические свойства этилбензоата обуславливаются наличием бензольного кольца и сложноэфирной группы в молекуле соединения.
) Реакции по сложноэфирной группе
а) Как и все сложные эфиры, этилбензоат подвергается гидролизу, который протекает с образованием бензойной кислоты и этилового спирта:

бензойная кислота этиловый спирт
б) Переэтерификация с простыми эфирами (например, с CH3OH):

метилбензоат этиловый спирт
в) Взаимодействие с реактивами Гриньяра с образованием третичного спирта (диметилфенилкарбинола):

г) Конденсация с другими эфирами с образованием кето-сложных эфиров (1,3-диоксо-2-метил-3-этокси-1-фенилпропана):

) Реакции по бензольному кольцу.
Из-за того, что группа  является ориентантом 2 рода, реакции будут идти в мета-положения бензольного кольца. Так как данный заместитель - дезактивирующий, реакции будут идти довольно медленно.
является ориентантом 2 рода, реакции будут идти в мета-положения бензольного кольца. Так как данный заместитель - дезактивирующий, реакции будут идти довольно медленно.
Для бензольного кольца характерны реакции замещения атома водорода.
а) Галогенирование
Замещение атома водорода в молекуле арена является методом получения хлор- и бромзамещенных ароматических соединений. В качестве катализаторов используются кислоты Льюиса. Хлорирование и бромирование можно проводить и трифторацетилгипогалогенитами.
Фторирование и йодирование аренов проводят крайне редко, т.к. фторирование является исключительно активным процессом и трудным для контроля, а йодирование протекает очень медленно. Реакцию можно осуществить, проводя ее в присутствии окислителя, например азотной кислоты.

м-хлор-этилбензоат
б) Нитрование

м-нитро-этилбензоат
Ароматические соединения реагируют с концентрированной азотной кислотой медленно. Поэтому нитрование проводят действием более активного нитрующего агента - смеси концентрированных азотной и серной кислот. Реакцию проводят при  .
.
в) Сульфирование
Данная реакция является обратимой, поэтому, для избегания обратного процесса, реакцию проводят в избытке сульфирующего агента. В качестве сульфирующих агентов применяют олеум, комплексы  -диоксан и
-диоксан и  -пиридин, пары
-пиридин, пары  с нейтральным газом, хлорсульфоновую кислоту
с нейтральным газом, хлорсульфоновую кислоту  .
.

м-сульфо-этилбензоат
г) Алкилирование по Фриделю-Крафтсу

 м-алкил-этилбензоат
м-алкил-этилбензоат
В качестве катализаторов используют хлорид и бромид алюминия. К реакциям алкилирования также относятся реакции присоединения алкенов, спиртов и альдегидов в присутствии сильных кислот, например серной, ортофосфорной.
д) Ацилирование по Фриделю-Крафтсу.
Ацилирование проводят галогенангидридами или ангидридами в присутствии кислот Льюиса (галогенид алюминия, трифторид бора, пентафторид сурьмы). Реакцию проводят в присутствии нитробензола, сероуглерода, тетрахлорэтана или хлористого метилена как растворителя.

м-ацетил-этилбензоат
1.4 Методы получения
а) Получение бензойной кислоты. Окисление толуола раствором перманганата калия при нагревании.
Авторы методик получения бензойной кислоты описывают похожие способы получения данного вещества, основанные на окислении толуола марганцовокислым калием, различающиеся пропорциями взятых исходных веществ, временем проведения синтеза и выходом конечного продукта:

В круглодонную колбу ёмкостью 200 мл с обратным холодильником помещают 1 г (1,2 мл) толуола, 75 мл воды и 3,4 г мелко растертого перманганата калия. Реакционную смесь кипятят в течение 4 ч на песчаной бане при частом взбалтывании (Для равномерного кипячения в колбу бросают «кипелки»). Об окончании реакции окисления судят по обесцвечиванию раствора. Если смесь остаётся окрашенной, прибавляют несколько капель этилового спирта или щавелевой кислоты до её обесцвечивания. Реакционную смесь охлаждают, отсасывают на воронке Бюхнера выпавший осадок оксида марганца (IV). Дважды промывают его на фильтре горячей водой порциями по 10 мл. Объединенные фильтраты упаривают в чашке на водяной бане или песчаной бане до объёма 10-15 мл. Затем фильтруют от выпавшего вновь оксида марганца (IV) и также промывают осадок на воронке 10 мл горячей воды. Объединённый фильтрат с промывной водой охлаждают о добавляют в него по каплям раствор HCl (1:1) до кислой реакции по конго красному. Выпавшую бензойную кислоту отфильтровывают на воронке Бюхнера. Промывают на воронке небольшим количеством ледяной воды и сушат на воздухе. Выход бензойной кислоты около 1 г. Бензойная кислота - кристаллическое вещество в виде пластинок.I. Получение из бензальдегида реакцией Канниццаро
При действии на бензальдегид концентрированного раствора щелочи происходит реакция диспропорционирования:

В колбу на 50 мл помещают 10,6 г свежеперегнанного бензальдегида и охлажденный раствор, содержащий 9 г едкого кали в 6 мл воды. Смесь встряхивают до образования стойкой эмульсии. Затем смесь оставляют стоять в продолжение ночи, закрыв колбу пробкой. К образовавшейся кристаллической массе прибавляют небольшое количество воды. Из полученного раствора извлекают бензиловый спирт эфиром, делая 2-3 эфирных вытяжки (по 10 мл каждая). Воднощелочной раствор подкисляют соляной кислотой; выпавшую бензойную кислоту отсасывают и перекристаллизовывают из кипящей воды. Тпл  , выход 5 г (82%).
, выход 5 г (82%).
б) Получение этилбензоата
Авторы методик получения этилбензоата предлагают получать его при взаимодействии бензойной кислоты и этилового спирта разной концентрации - 100% или 95-96%:

I. Получение этилбензоата при взаимодействии бензойной кислоты и этанола исходя из абсолютного этилового спирта
[2] В круглодонную колбу ёмкостью 150 мл, снабженную обратным холодильником, закрытым хлоркальциевой трубкой, помещают 12,2 г бензойной кислоты, 100 мл абсолютного этилового спирта и 3 мл концентрированной серной кислоты. Смесь нагревают в течение 6 ч. По окончании реакции основную массу спирта отгоняют, к остатку добавляют 100 мл воды и органическое вещество извлекают эфиром. Эфирную вытяжку взбалтывают с раствором соды (для удаления кислоты), промывают водой и сушат в течение ночи безводным сернокислым натрием. После отгонки эфира остаток перегоняют. Выход бензойноэтилового эфира 10-12 г (68-80% теоретического), Ткип  ,
,  .
.
II. Получение при взаимодействии бензойной кислоты и этанола исходя из водного этилового спирта
[1] В круглодонную колбу ёмкостью 150 мл помещают 12,2 г бензойной кислоты, 35 мл 95%-ного этилового спирта и прибавляют 4 мл концентрированной серной кислоты. Смесь нагревают в течение 3-4 ч на водяной бане. После окончания реакции отгоняют избыток этилового спирта. Остаток охлаждают и для растворения оставшегося спирта и бензойной кислоты выливают в стакан с 60 мл холодной воды. Добавляют порциями углекислый натрий до слабощелочной реакции. Выделившийся в виде масла этиловый эфир бензойной кислоты извлекают диэтиловым эфиром, отделяют при помощи делительной воронки эфирный слой и сушат его несколько часов хлористым кальцием. После отгонки эфира остаток этилового эфира бензойной кислоты перегоняют, собирая фракцию, кипящую при 210-212 ºС. Выход
10 г.
1.5 Применение
Применяется в парфюмерной промышленности (запах этилбензоата напоминает запах жасмина), используется в качестве реагента в основном органическом синтезе.
2. Экспериментальная часть
Первая стадия: получение бензойной кислоты
Для следующего синтеза нам нужно получить 10 г бензойной кислоты
Уравнения реакции:

Расчет синтеза:
Толуол -
Перманганат калия -
Соляная кислота - HCl, M=36,5 г/моль
Для синтеза 1 г-молей бнзойной кислоты нужно 1г-молей толуола
122г(
г - Хг
Х=7,5 г или 0,073 г- моля толуола
Пересчитываем на мл Х= 6,7/0,86694=7,7 мл
Для синтеза 1г-молей бензойной кислоты нужно 2г-молей перманганата калия
122г(
г - Хг
Х=26 г или 0,146 г- моля перманганата калия
Для синтеза 1 г-молей бензойной кислоты нужно 1г-молей соляной кислоты
122г(
г - Хг
Х=2,9 г или 0,073 г- моля соляной кислоты
Пересчет количеств веществ по практикуму
Для получения 2г бензойной кислоты берут 2г (2,3 мл) толуола и 6,8 г перманганата калия.
Значит, для получения 10 г бензойной кислоты потребуется:
г - 2г
г - Хг
Х=10г толуола (11,5 мл)
г - 6,8 г
г - Хг
Х=34г перманганата калия
Характеристики и количества веществ
| Название реактивов | Брутто формула | М | Основные константы | Количество исходных реагентов | |||||||||||||
| | | | Т кип. | Т пл. | d204 | по уравнению | по методике | ||||||||||
| Толуол | С6Н5СН3 | 92 | 110,6 | -95 | 0,86694 | 7,5 | 0,073 | 10 | 11,5 | 0,097 | |||||||
| Перманганат калия | КMnO4 | 158 | - | - | 6,4 | 26 | 0,146 | 34 | 5,3 | 0,193 | |||||||
| Соляная кислота | HCl | 36,5 | 48 | -26 | 1,19 | 2,9 | 0,073 | - | - | - | |||||||
Описание хода синтеза
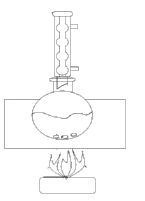
Окисление.
1) в круглодонной колбе, снабженной обратным холодильником, кипятят в течении 3 часов на песчаной бане 11б5 мл толуола с 640 мл воды и 34 г мелкорастворенного перманганата калия. Для равномерного кипения реакционной смеси в колбу бросают несколько «кипелок».
2) Выделение продукта. После окончания реакции бесцветный раствор ( если не произошло обесцвечиваения, то к раствору добавляют 1-2 мл спирта). Охлаждают.
) Выпавший оксид марганца(IV) отфильтровывают и дважды промывают теплой водой (по 5 мл)
) Фильтрат упаривают до объема 50-70 мл, подкисляют концентрированной соляной кислотой до кислой реакции и охлаждают. При этом осаждается бензойная кислота.
) Осадок отфильтровывают, промывают небольшим количеством холодной воды и сушат.
) Полученную бензойную кислоту перекристализовывают из минимального количества воды. Высушивают на воздухе.
Ожидаемый выход: 9г
Температура плавления 120-121 ˚С
Схема установки:
Вторая стадия: получение этилбензоата
Уравнение реакции:
Реактивы:
Бензойная кислота (
Этиловый спирт (
Серная кислота (
Сульфат натрия(безводный) (
Расчет синтеза
Для синтеза 1г-молей этилбензоата нужно 1г-молей бензойной кислоты
г - 122г
г - Хг
Х= 7,32 г или 0,06 г-молей
Для синтеза 1г-молей этилбензоата нужно 1г-молей этилового спирта
г - 46г
г - Хг
Х=2, 76 г или 0,06 г-молей
Пересчет количества веществ по практикуму
Для получения 11г этилбензоата используют 12,2г бензойной кислоты и 100мл этилового спирта и 3 мл серной кислоты.
Значит, для получения 9г этилбензоата нужно:
г - 12,2 г
г - Хг
Х=10г бензойной кислоты
г-79,4г (100 мл)
г - Хг
Х=65г (81мл) этилового спирта
Характеристики и количества исходных веществ
| Название реактивов | Брутто формула | М | Основные константы | Количество исходных реагентов | ||||||
| | | | Т кип. | Т пл. | d204 | по уравнению | по методике | |||
| Бензойная кислота | С6Н5СOOH | 122 | 249,2 | 122,4 | | 7,32 | 0,06 | 10 | - | 0,081 |
| Этиловый спирт | C2H5OH | 46 | 78,4 | -114,3 | 0,794 | 2,76 | 0,06 | 65 | 81 | 1,4 |
| Серная кислота | H2SO4 | 98 | 279,6 | 10,38 | 1,84 | - | - | - | 3 | - |
Описание хода синтеза
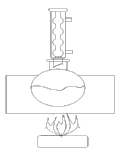
1) В круглодонную колбу ёмкостью 150 мл, снабжённую обратным холодильником, закрытым хлоркальциевой трубкой, помещают 10г бензойной кислоты, 81 мл абсолютного этилового спирта и 3 мл концентрированной серной кислоты.
2) Смесь нагревают в течении 6 часов
) По окончании реакции основную массу спирта отгоняют, к остатку добавляют 100 мл воды и органическое вещество извлекают эфиром.
) Эфирную вытяжку взбалтывают с раствором соды ( для удаления кислоты), промывают водой и сушат в течение ночи безводным сернокислым натрием.
) После отгонки эфира остаток перегоняют.
Т кип.=212˚С,
Схема установки:
Вывод
В данной курсовой работе были изучены свойства этилбензоата.
Также была найдена и изучена литература о методах синтеза этилбензоата, его физических и химических свойствах.
Список цитируемой литературы
1. Храмкина М.Н. «Практикум по органическому синтезу», Химия, Ленинград, 1977, стр. 163, 198.
2. Голодников Г.В., Мандельштам Т.В. «Практикум по органическому синтезу», Издательство ЛГУ, Ленинград, 1976, стр. 215, 325, 337.
. Птицына О.А. и др. «Лабораторные работы по органическому синтезу», Просвещение, Москва, 1979, стр. 189.
. Юрьев Ю.К. «Практические работы по органической химии», Издательство МГУ, Москва, 1961, 211.
Список используемой литературы
этилбензоат соединение синтез
5. А.Е. Агрономов, Ю.С. Шабаров «Лабораторные работы в органическом практикуме. Учебное пособие для вузов», 2-е изд., перераб. и доп.- М.: Химия, 1974.
6. Лабораторные работы по органической химии под. редакцией А.А. Петрова, издание М.: «Высшая школа», 1974
. И. Губен, Методы органической химии, перевод с немецкого под редакцией А.Я. Берлина, Т.4, выпуск первый, книга вторая, Л.: издательство ГХИ,1949.
. А.А. Петров, Органическая химия: Учебник для вузов- 5-е изд., перераб. и доп., СПб.: «Иван Федоров», 2002.
. В.Ф. Травень, Органическая химия, Учебник для вузов, Том 2, М.:ИКЦ «Академкнига», 2006.