ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 154
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2+ в среде и от энергии расщепления АТФ. Вещества, разрушающие микротрубочки и нейрофиламенты (колхицин, винбластин и др.), недостаток АТФ, метаболические яды, создающие дефицит энергии (динитрофенол, цианиды), нарушают аксоток. Аксональный транспорт страдает при дегенерации аксона, вызываемой недостатком витамина В6 и витамина B1 (болезнь берибери), промышленными ядами (акриламидом, гексахлорофосом), солями тяжелых металлов (свинца), фармакологическими препаратами (дисульфирамом), алкоголем, при диабете, сдавлении нервов и дистрофических повреждениях нейрона. При перерыве аксона возникает уоллеровская дегенерация (распад) его периферической части и ретроградная дегенерация центральной части. Эти процессы связаны с нарушением трофики в обеих частях аксона.
Расстройства аксонального транспорта трофогенов и веществ, необходимых для образования и выделения медиаторов нервным окончанием, обусловливают развитие дистрофических изменений нейронов и иннервируемых тканей и нарушение синаптических процессов. Распространение с аксональным транспортом патотрофогенов, антител к нервной ткани и к нейромедиаторам приводит
к вовлечению в патологический процесс нейронов в других отделах ЦНС.
Дендриты и их шипики являются самыми ранимыми структурами нейрона. При старении шипики и ветви дендритов редуцируются, при некоторых дегенеративных и атрофических заболеваниях мозга (старческое слабоумие, болезнь Альцгеймера) они исчезают. Дендрошипиковый аппарат страдает при гипоксии, ишемии, сотрясении мозга, стрессорных и невротизирующих воздействиях.
21.3.3. Патология структурных элементов нейронов
Значительную роль в патологии нейрона играют нарушения внутриклеточного структурного гомеостаза. В норме процессы изнашивания и распада внутриклеточных структур и нейрональных мембран уравновешиваются процессами их обновления и регенерации. Совокупность этих процессов составляет динамический структурный гомеостаз.
Повреждения как клеточной (цитоплазматической), так и внутриклеточных мембран возникают при различных патогенных воздействиях и сами являются причиной дальнейшей патологии нейрона.
Усиленное перекисное окисление липидов (ПОЛ) нейрональных мембран оказывает влияние не только на мембранные, но и на другие внутриклеточные процессы.
Практически нет патологического процесса в нервной системе, при котором не возникало бы усиленного ПОЛ. Оно имеет место при эпилепсии, эндогенных психозах (например, шизофрении, маниакально-депрессивном синдроме), при неврозах, стрессах и повреждениях, при ишемии, хронической гипоксии, функциональных перегрузках нейронов и пр. С ним связана дальнейшая гиперактивация нейронов.
Вследствие увеличения проницаемости мембран происходит выход из нейрона различных веществ, в том числе антигенов, которые вызывают образование антинейрональных антител, что приводит к развитию аутоиммунного процесса. Нарушение барьерных свойств мембран обусловливает возрастание тока ионов Са2+ и Na+ в нейрон и К+ - из нейрона; эти процессы в сочетании с недостаточностью энергозависимых Na+-, K+- и Са2+-насосов (их деятельность изменяется также под влиянием усиленного ПОЛ) приводят к частичной деполяризации мембраны. Увеличенный вход Ca2+ не
только вызывает гиперактивацию нейрона, но и при чрезмерном его содержании в клетке ведет к патологическим изменениям метаболизма и внутриклеточным повреждениям (см. главу 3).
Нормализация перекисного окисления липидов и стабилизация нейрональных мембран должны быть частью комплексной патогенетической терапии различных форм патологии нервной системы.
Для жизнедеятельности нейрона, который как высокодифференцированная клетка не способен митотически делиться, внутриклеточная регенерация является единственным способом структурного обновления нейронов и поддержания их целостности. К ней относятся синтез белков, образование внутриклеточных органелл, митохондрий, мембранных структур, рецепторов, рост нервных отростков (аксоны, дендриты, дендритные шипики) и др.
Процессы внутриклеточной регенерации требуют высокого энергетического и трофического обеспечения и полноценного метаболизма клетки. При повреждениях нейрона, возникновении энергетического и трофического дефицита, нарушениях деятельности генома страдает внутриклеточная регенерация
, падает пластический потенциал клетки, распад внутриклеточных структур не уравновешивается ими.
21.3.4. Энергетический дефицит
Потребность нейронов в энергообеспечении - самая высокая из всех клеток организма, и нарушение энергообеспечения является одной из распространенных причин патологии нейрона. Энергетический дефицит может быть первичным - при действии метаболических ядов (например, динитрофенола, цианидов) либо вторичным - при различных повреждениях, нарушениях кровообращения, шоке, отеке, общих судорогах, усиленной функциональной нагрузке и др. Дефицит энергии относится к разряду типовых внутриклеточных патологических процессов (см. главу 3).
Главными условиями развития энергетического дефицита являются недостаток кислорода и значительное повреждение митохондрий, в которых синтезируется основной носитель энергии - АТФ. Причиной дефицита энергии может быть также недостаток субстрата окисления, в частности глюкозы, которая является для мозга основным субстратом окисления. Нейроны коры не имеют запасов глюкозы и потребляют ее непосредственно из крови (глюкоза свободно проходит ГЭБ), поэтому они особенно чувстви-
тельны к гипогликемии. Мозг потребляет около 20% от всей находящейся в крови глюкозы. Инсулиновые шоки, применяемые для лечения некоторых психозов, связаны с глубокой гипогликемией и протекают с потерей сознания и нередко с судорогами. При ряде патологических состояний (травматический шок, кровопотеря) мозг может дольше обеспечиваться кислородом и глюкозой благодаря перераспределению крови и уменьшению их потребления другими тканями. Для быстрейшего восстановления деятельности мозга после общих судорог необходим достаточно высокий уровень глюкозы в крови. Энергетический дефицит усугубляется нарушением цикла Кребса.
При глубоком нарушении окислительного фосфорилирования и синтеза макроэргов источником энергии становится анаэробный гликолиз. Он имеет характер компенсаторного механизма, однако его эффект не может восполнить дефицит энергии, а нарастающее увеличение содержания молочной кислоты в мозгу оказывает отрицательное влияние на деятельность нейронов и усугубляет отек мозга.
21.3.5. Эффекты ишемии и гипоксии
В связи с высокой потребностью в энергии нейроны ЦНС нуждаются в значительном кислородном обеспечении. Нейрон коры головного мозга потребляет 250-450 мкл О
2/мин (для сравнения - глиоцит и гепатоцит потребляют до 60 мкл О2). Снижение потребления кислорода мозгом всего лишь на 20% может вызвать потерю сознания у человека. Исчезновение импульсной активности нейронов возникает уже в первые десятки секунд ишемии мозга. Через 5-6 мин после начала асфиксии наступает глубокое и нередко необратимое нарушение деятельности мозга. Гибель нейрона при ишемии является результатом осуществления комплекса взаимосвязанных внутриклеточных процессов (рис. 21-5).
При аноксии головного мозга в первую очередь страдает кора. Гибель всего мозга означает «мозговую смерть», которая проявляется в полном исчезновении биоэлектрической активности. Филогенетически более старые структуры ЦНС (спинной мозг, ствол головного мозга) менее чувствительны к асфиксии, чем молодые (подкорка и особенно кора). Поэтому при запоздалом оживлении организма может наступить декортикация.
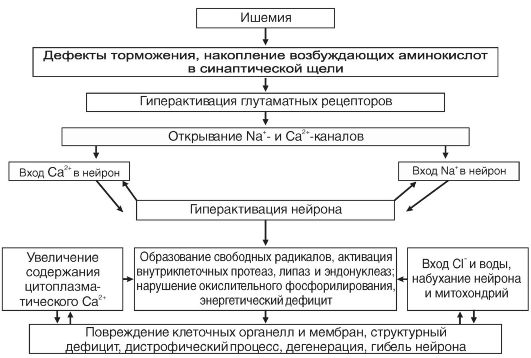 Рис. 21-5. Комплекс внутриклеточных процессов, возникающих при ишемии и вызывающих дегенерацию и гибель мембран
Рис. 21-5. Комплекс внутриклеточных процессов, возникающих при ишемии и вызывающих дегенерацию и гибель мембран
Весьма чувствительны к аноксии тормозные механизмы. Одним из следствий этого является растормаживание неповрежденных структур ЦНС. На ранних стадиях ишемии, когда нейроны мозга еще способны давать реакцию, они могут гиперактивироваться. На поздних стадиях ишемии гиперактивация нейронов сменяется их инактивацией.
С поступлением Na+ в нейрон связана первая, острая фаза поражения нейрона. Возрастание концентрации Na+ в цитозоле нейрона приводит к повышению осмолярности, что обусловливает вход воды в нейрон и его набухание. В дальнейшем повышение осмолярности нейрона связано также с накоплением в нем Са2+, молочной кислоты, неорганического фосфора. С входом Са2+ в нейрон связана вторая фаза повреждения нейрона. Увеличение количества Са2+, поступающего в нейрон, обусловливается активацией глутаматных рецепторов в связи с усиленным выделением глутамата нервными окончаниями при ишемии. Антагонисты глутаматных рецепторов и антагонисты Са2+ (блокаторы Са2+-каналов) способ-
ны предотвратить ишемическую дегенерацию нейронов и оказать лечебный эффект.
Повреждение нейрона происходит не только во время ишемии, но и в связи с реперфузией мозга и возобновлением циркуляции крови. Именно они могут представлять главную опасность. Большую роль в реперфузионных постишемических повреждениях играют: новая волна поступления Са
Расстройства аксонального транспорта трофогенов и веществ, необходимых для образования и выделения медиаторов нервным окончанием, обусловливают развитие дистрофических изменений нейронов и иннервируемых тканей и нарушение синаптических процессов. Распространение с аксональным транспортом патотрофогенов, антител к нервной ткани и к нейромедиаторам приводит
| |
к вовлечению в патологический процесс нейронов в других отделах ЦНС.
Дендриты и их шипики являются самыми ранимыми структурами нейрона. При старении шипики и ветви дендритов редуцируются, при некоторых дегенеративных и атрофических заболеваниях мозга (старческое слабоумие, болезнь Альцгеймера) они исчезают. Дендрошипиковый аппарат страдает при гипоксии, ишемии, сотрясении мозга, стрессорных и невротизирующих воздействиях.
21.3.3. Патология структурных элементов нейронов
Значительную роль в патологии нейрона играют нарушения внутриклеточного структурного гомеостаза. В норме процессы изнашивания и распада внутриклеточных структур и нейрональных мембран уравновешиваются процессами их обновления и регенерации. Совокупность этих процессов составляет динамический структурный гомеостаз.
Повреждения как клеточной (цитоплазматической), так и внутриклеточных мембран возникают при различных патогенных воздействиях и сами являются причиной дальнейшей патологии нейрона.
Усиленное перекисное окисление липидов (ПОЛ) нейрональных мембран оказывает влияние не только на мембранные, но и на другие внутриклеточные процессы.
Практически нет патологического процесса в нервной системе, при котором не возникало бы усиленного ПОЛ. Оно имеет место при эпилепсии, эндогенных психозах (например, шизофрении, маниакально-депрессивном синдроме), при неврозах, стрессах и повреждениях, при ишемии, хронической гипоксии, функциональных перегрузках нейронов и пр. С ним связана дальнейшая гиперактивация нейронов.
Вследствие увеличения проницаемости мембран происходит выход из нейрона различных веществ, в том числе антигенов, которые вызывают образование антинейрональных антител, что приводит к развитию аутоиммунного процесса. Нарушение барьерных свойств мембран обусловливает возрастание тока ионов Са2+ и Na+ в нейрон и К+ - из нейрона; эти процессы в сочетании с недостаточностью энергозависимых Na+-, K+- и Са2+-насосов (их деятельность изменяется также под влиянием усиленного ПОЛ) приводят к частичной деполяризации мембраны. Увеличенный вход Ca2+ не
| |
только вызывает гиперактивацию нейрона, но и при чрезмерном его содержании в клетке ведет к патологическим изменениям метаболизма и внутриклеточным повреждениям (см. главу 3).
Нормализация перекисного окисления липидов и стабилизация нейрональных мембран должны быть частью комплексной патогенетической терапии различных форм патологии нервной системы.
Для жизнедеятельности нейрона, который как высокодифференцированная клетка не способен митотически делиться, внутриклеточная регенерация является единственным способом структурного обновления нейронов и поддержания их целостности. К ней относятся синтез белков, образование внутриклеточных органелл, митохондрий, мембранных структур, рецепторов, рост нервных отростков (аксоны, дендриты, дендритные шипики) и др.
Процессы внутриклеточной регенерации требуют высокого энергетического и трофического обеспечения и полноценного метаболизма клетки. При повреждениях нейрона, возникновении энергетического и трофического дефицита, нарушениях деятельности генома страдает внутриклеточная регенерация
, падает пластический потенциал клетки, распад внутриклеточных структур не уравновешивается ими.
21.3.4. Энергетический дефицит
Потребность нейронов в энергообеспечении - самая высокая из всех клеток организма, и нарушение энергообеспечения является одной из распространенных причин патологии нейрона. Энергетический дефицит может быть первичным - при действии метаболических ядов (например, динитрофенола, цианидов) либо вторичным - при различных повреждениях, нарушениях кровообращения, шоке, отеке, общих судорогах, усиленной функциональной нагрузке и др. Дефицит энергии относится к разряду типовых внутриклеточных патологических процессов (см. главу 3).
Главными условиями развития энергетического дефицита являются недостаток кислорода и значительное повреждение митохондрий, в которых синтезируется основной носитель энергии - АТФ. Причиной дефицита энергии может быть также недостаток субстрата окисления, в частности глюкозы, которая является для мозга основным субстратом окисления. Нейроны коры не имеют запасов глюкозы и потребляют ее непосредственно из крови (глюкоза свободно проходит ГЭБ), поэтому они особенно чувстви-
| |
тельны к гипогликемии. Мозг потребляет около 20% от всей находящейся в крови глюкозы. Инсулиновые шоки, применяемые для лечения некоторых психозов, связаны с глубокой гипогликемией и протекают с потерей сознания и нередко с судорогами. При ряде патологических состояний (травматический шок, кровопотеря) мозг может дольше обеспечиваться кислородом и глюкозой благодаря перераспределению крови и уменьшению их потребления другими тканями. Для быстрейшего восстановления деятельности мозга после общих судорог необходим достаточно высокий уровень глюкозы в крови. Энергетический дефицит усугубляется нарушением цикла Кребса.
При глубоком нарушении окислительного фосфорилирования и синтеза макроэргов источником энергии становится анаэробный гликолиз. Он имеет характер компенсаторного механизма, однако его эффект не может восполнить дефицит энергии, а нарастающее увеличение содержания молочной кислоты в мозгу оказывает отрицательное влияние на деятельность нейронов и усугубляет отек мозга.
21.3.5. Эффекты ишемии и гипоксии
В связи с высокой потребностью в энергии нейроны ЦНС нуждаются в значительном кислородном обеспечении. Нейрон коры головного мозга потребляет 250-450 мкл О
2/мин (для сравнения - глиоцит и гепатоцит потребляют до 60 мкл О2). Снижение потребления кислорода мозгом всего лишь на 20% может вызвать потерю сознания у человека. Исчезновение импульсной активности нейронов возникает уже в первые десятки секунд ишемии мозга. Через 5-6 мин после начала асфиксии наступает глубокое и нередко необратимое нарушение деятельности мозга. Гибель нейрона при ишемии является результатом осуществления комплекса взаимосвязанных внутриклеточных процессов (рис. 21-5).
При аноксии головного мозга в первую очередь страдает кора. Гибель всего мозга означает «мозговую смерть», которая проявляется в полном исчезновении биоэлектрической активности. Филогенетически более старые структуры ЦНС (спинной мозг, ствол головного мозга) менее чувствительны к асфиксии, чем молодые (подкорка и особенно кора). Поэтому при запоздалом оживлении организма может наступить декортикация.
| |
 Рис. 21-5. Комплекс внутриклеточных процессов, возникающих при ишемии и вызывающих дегенерацию и гибель мембран
Рис. 21-5. Комплекс внутриклеточных процессов, возникающих при ишемии и вызывающих дегенерацию и гибель мембранВесьма чувствительны к аноксии тормозные механизмы. Одним из следствий этого является растормаживание неповрежденных структур ЦНС. На ранних стадиях ишемии, когда нейроны мозга еще способны давать реакцию, они могут гиперактивироваться. На поздних стадиях ишемии гиперактивация нейронов сменяется их инактивацией.
С поступлением Na+ в нейрон связана первая, острая фаза поражения нейрона. Возрастание концентрации Na+ в цитозоле нейрона приводит к повышению осмолярности, что обусловливает вход воды в нейрон и его набухание. В дальнейшем повышение осмолярности нейрона связано также с накоплением в нем Са2+, молочной кислоты, неорганического фосфора. С входом Са2+ в нейрон связана вторая фаза повреждения нейрона. Увеличение количества Са2+, поступающего в нейрон, обусловливается активацией глутаматных рецепторов в связи с усиленным выделением глутамата нервными окончаниями при ишемии. Антагонисты глутаматных рецепторов и антагонисты Са2+ (блокаторы Са2+-каналов) способ-
ны предотвратить ишемическую дегенерацию нейронов и оказать лечебный эффект.
Повреждение нейрона происходит не только во время ишемии, но и в связи с реперфузией мозга и возобновлением циркуляции крови. Именно они могут представлять главную опасность. Большую роль в реперфузионных постишемических повреждениях играют: новая волна поступления Са