Файл: Методические указания и задания к занятиям семинарского типа, контрольной и самостоятельной работе по дисциплине Неорганическая химия.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 293
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2 + ? + ? + ?;
б) KJO3 + Na2SO3 + H2SO4 → J2 + ? + ? + ?;
в) S + KOH → K2S + K2SO3 + ?;
г) K2S + KMnO4 + H2SO4 → S+ ? + ? + ?;
д) Cr(OH)3 + Br2 + NaOH → Na2CrO4 + ? + ?;
е) K2Cr2O7 + H2SO4 + NaNO2 → Cr2(SO4)3 + NaNO3+ ? + ?;
ж) NaJ + KMnO4 + KOH → J2 + ? + ?;
з) KNO2 + KJ + H2SO4 → J2 + NO +? + ?.
8. Используя таблицы 14 и 15 приложения, допишите формулы продуктов реакций в указанных ниже уравнениях, подберите коэффициенты методом электронного баланса, расставьте их в уравнениях, отметьте в каждом из них окислитель и восстановитель:
а) H2S + H2SO3 ® ; б) J2 + H2S ® ;
в) HNO2 + H2S ® ; г) NaBr + NaBrO3 + H2SO4 ® ;
д) H2SO3 + CI2 + H2O ® ; е) K2S + NaCIO + H2SO4 ® ;
ж) HCIO4 + SO2 + H2O ® ; з) HNO3 + J2 + H2O ® ;
и) KCIO3 + KNO2 ® ; к) NO + NO2 + NaOH ® .
Используя таблицу 15 приложения, сравните значения стандартных окислительно-восстановительных потенциалов и объясните, можно ли вместо хлора применять бром или йод?
Лабораторная 9.
Энергетика и направленность химических процессов
План занятия
1. Основные понятия химической термодинамики:
а) термодинамическая система, ее разновидности и параметры состояния;
б) термодинамические процессы и термодинамические функции (полная и внутренняя энергия, энтальпия, энтропия, энергия Гиббса).
2. Первый закон термодинамики, его математическое выражение. Значение Q V и Q P.
3. Термохимия. Тепловой эффект реакции. Термохимические уравнения. Экзотермические и эндотермические реакции.
4. Закон Гесса, его следствия. Теплоты образования и сгорания веществ.
5. Направленность химических процессов. ΔSо и ΔGо, их взаимосвязь.
Задания для самостоятельной работы
1. Что изучает химическая термодинамика?
2. Понятие о термодинамической системе. Приведите примеры открытых и изолированных, гомогенных и гетерогенных систем.
3. Перечислите параметры, характеризующие состояние термодинамических систем:
а) NH4CI (к)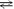 NH3 (г) + HCI (г), ΔH
NH3 (г) + HCI (г), ΔH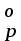 > 0;
> 0;
б) N2 (г) + 3 H2 (г)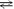 2 NH3 (г), ΔH
2 NH3 (г), ΔH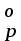 < 0.
< 0.
4. Назовите виды термодинамических процессов и укажите, к какому из них можно отнести химические реакции, выполняемые в учебной лаборатории.
5. Приведите определение основных термодинамических функций и поясните их физический смысл.
6. Сформулируйте первый закон термодинамики и приведите его математическое выражение при V = const и P = const.
7. Что понимают под тепловым эффектом реакции и термохимическим уравнением? Приведите примеры уравнений термохимических реакций.
8. Сформулируйте закон Гесса и отметьте его практическое значение.
9. Что понимают под теплотой образования вещества? Используя таблицу 5 приложения, укажите значение энтальпии образования ΔНообр веществ:
а) СО (г) и CO2 (г);
б) H2O (ж) и Н2О (г);
в) CaO3 (к), Ca(OH)2 (к) и CaCO3 (к).
10. Сформулируйте следствия из закона Гесса о тепловом эффекте химической реакции и приведите их математическое выражение.
11. Используя таблицу 5 приложения, вычислите тепловые эффекты реакций ΔH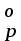 :
:
а) Fe2O3 (к) + 2 AI (к) = AI2O3 (к) + 2 Fe (к);
б) 2 SO2 (г) + O2 (г) = 2 SO3 (г);
в) NH3 (г) + HCI (г) = NH4CI (к).
12. Вычислите тепловые эффекты реакций сгорания 10 г следующих веществ: C(алмаз) и P(к); H2 (г) и H2S (г); C2H5OH (ж) и C6H12O6 (к).
13. Какие термодинамические функции определяют направленность химических реакций? Приведите их математическое выражение.
14. Определите направление указанных реакций по значениям ΔS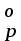 и ΔG
и ΔG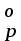 , используя для вычислений таблицу 5 приложения:
, используя для вычислений таблицу 5 приложения:
а) 2 CO (г) + O2 (г) = 2 CO2 (г)
;
б) 2 Н2S (г) + 3 O2 (г) = 2 Н2О (г) + 2 SO2 (г);
в) С(графит) + Н2О (г) = СО (г) + Н2 (г).
15. Используя таблицу 5 приложения, вычислите значения ΔH , ΔS
, ΔS и ΔG
и ΔG в представленных системах и определите возможность их осуществления в стандартных условиях:
в представленных системах и определите возможность их осуществления в стандартных условиях:
а) CaO (к) + H2O (ж) = Ca(OH)2 (к);
б) СaО (к) + СО2 (г) = СaСО3 (к);
в) Ca(OH)2 (к) + CO2 (г) = CaCO3 (к) + H2O (ж).
16. Используя таблицу 5 приложения, определите количество теплоты, выделяющейся при взрыве 8,4 л гремучего газа (н. у.).
17. При восстановлении 12,7 г оксида меди(II) углем (с образованием СО) поглощается 8,24 кДж энергии. Определите ΔH образования CuO ( используйте таблицу 5 приложения).
образования CuO ( используйте таблицу 5 приложения).
18. Вычислите ΔH образования MgCO3(к), пользуясь следующими данными:
образования MgCO3(к), пользуясь следующими данными:
С (графит) + О2 = СО2 (г), ΔH = - 393,5 кДж;
= - 393,5 кДж;
2 Mg (к) + O2 = 2 MgO (к), ΔH = - 1203,6 кДж;
= - 1203,6 кДж;
MgO (к) + СО2 (г) = MgCO3 (к), ΔH = - 117,7 кДж.
= - 117,7 кДж.
Лабораторная 10.
Химическая кинетика и химическое равновесие
План занятия
1. Понятие о скорости химической реакции, выражение ее для гомогенных и гетерогенных процессов.
2. Факторы, влияющие на скорость химической реакции:
а) влияние концентрации (закон действующих масс - ЗДМ);
б) влияние температуры (правило Вант-Гоффа, активные молекулы, энергия активации);
в) влияние катализаторов, понятие о гомогенном и гетерогенном катализе;
г) влияние других факторов.
3. Состояние химического равновесия, его количественная характеристика.
4. Смещение химического равновесия. Принцип Ле Шателье. Влияние концентрации, давления и температуры на смещение химического равновесия.
Растворы: H2O (дист.), 2н - Na2S2O3, H2SO4; CuSO4 (1н),
H2O2 (3%), FeCI3 (0,0025M и насыщ.), KNCS (0,0025M и насыщ.), NH4OH (6н).
Приборы и материалы:штативы с пробирками, лопатки, секундомеры, MnO2 (крист.), KCI (крист.).
Опыт 1. Влияние концентрации на скорость
химической реакции
Начертите таблицу 1 и, используя ее данные, приготовьте в трех пробирках растворы Na2S2O3 разной концентрации путем разбавления водой его 2н раствора.
Далее возьмите первую пробирку, поместите в нее одну каплю 2н раствора H2SO4 и быстро встряхните пробирку. С помощью секундомера отметьте время с момента слияния растворов до появления слабого голубоватого помутнения, обусловленного образованием коллоидного раствора серы. Полученный результат внесите в пятую графу таблицы 1. Аналогичные исследования проведите со второй и третьей пробирками.
Таблица 1
Влияние концентрации на скорость реакции
Вычислите значение скорости реакции, протекающей в каждой из пробирок. Результаты всех вычислений внесите в седьмую колонку таблицы 1.
Запишите приведенное ниже уравнение реакции, протекающей в пробирках, и приведите выражение ее скорости:
Na2S2O3 + H2SO4 = Na2SO4 + S¯ + SO2 + H2O.
Сделайте вывод о зависимости скорости химической реакции от концентрации реагирующих веществ и выразите эту зависимость графически. Для этого отложите на оси абсцисс значения концентрации растворов Na2S2O3, а на оси ординат - соответствующие им значения скорости. При этом учтите, что график представляет собой усредненную прямую линию.
Опыт 2. Влияние катализаторов на скорость
химической реакции
2.1. Гомогенный катализ
В пробирку с пятью каплями 1н раствора CuSO4 добавьте по каплям 6н раствор NH4OH до образования интенсивно-синего раствора катализатора [Cu(NH3)4]SO4.
В другую пробирку поместите шесть капель 3%-го раствора H2O2 и добавьте в нее по каплям полученный раствор катализатора (с помощью капельной пипетки). Отметьте интенсивность реакции.
Составьте уравнения реакций образования катализатора и разложения Н2О2. Укажите тип катализа.
2.2. Гетерогенный катализ
Поместите в пробирку шесть капель 3%-го раствора Н2О2 и добавьте в нее с помощью лопатки несколько крупинок катализатора MnO2. Отметьте интенсивность реакции.
Укажите тип катализа и составьте уравнение реакции разложения Н2О2.
Сделайте вывод о влиянии катализаторов на скорость реакции.
Опыт 3. Смещение равновесия в обратимой реакции
Начертите таблицу 2. Используя ее данные, смешайте в четырех пробирках 0,0025М растворы FeCI3 и KNCS и наблюдайте слабо-красное окрашивание растворов во всех пробирках.
Далее добавьте в первые три пробирки вещества, указанные в таблице 2. Наблюдайте изменение окраски, сравните ее с окраской раствора в контрольной пробирке и заполните седьмую графу таблицы 2.
Составьте уравнение обратимой реакции и укажите, какой из ее компонентов обусловливает окраску раствора.
Используя данные седьмой графы таблицы 2, отметьте направление смещения равновесия в указанной реакции. Заполните восьмую (последнюю) графу таблицы 2.
Запишите выражения скоростей прямой и обратной реакций приведенного уравнения и выражение константы химического равновесия.
Сделайте вывод о влиянии концентрации на направление смещения равновесия.
Таблица 2
б) KJO3 + Na2SO3 + H2SO4 → J2 + ? + ? + ?;
в) S + KOH → K2S + K2SO3 + ?;
г) K2S + KMnO4 + H2SO4 → S+ ? + ? + ?;
д) Cr(OH)3 + Br2 + NaOH → Na2CrO4 + ? + ?;
е) K2Cr2O7 + H2SO4 + NaNO2 → Cr2(SO4)3 + NaNO3+ ? + ?;
ж) NaJ + KMnO4 + KOH → J2 + ? + ?;
з) KNO2 + KJ + H2SO4 → J2 + NO +? + ?.
8. Используя таблицы 14 и 15 приложения, допишите формулы продуктов реакций в указанных ниже уравнениях, подберите коэффициенты методом электронного баланса, расставьте их в уравнениях, отметьте в каждом из них окислитель и восстановитель:
а) H2S + H2SO3 ® ; б) J2 + H2S ® ;
в) HNO2 + H2S ® ; г) NaBr + NaBrO3 + H2SO4 ® ;
д) H2SO3 + CI2 + H2O ® ; е) K2S + NaCIO + H2SO4 ® ;
ж) HCIO4 + SO2 + H2O ® ; з) HNO3 + J2 + H2O ® ;
и) KCIO3 + KNO2 ® ; к) NO + NO2 + NaOH ® .
-
Сколько моль азотной кислоты участвует в качестве окислителя в реакции: FeS + HNO3 → Fe(NO3)3 + S + NO + H2O? -
Пермангагат калия можно получить окислением манганата калия хлором: 2 K2MnO4 + Cl2 = 2 KMnO4 + 2 KCl.
Используя таблицу 15 приложения, сравните значения стандартных окислительно-восстановительных потенциалов и объясните, можно ли вместо хлора применять бром или йод?
-
Хватит ли 120 г 4%-го раствора перманганата калия для окисления 50 г 3%-го раствора сульфита натрия, который содержит также гидроксид калия? -
Какой объем сероводорода (н. у.) прореагирует с 150 г 0,1н раствора йода?
Лабораторная 9.
Энергетика и направленность химических процессов
План занятия
1. Основные понятия химической термодинамики:
а) термодинамическая система, ее разновидности и параметры состояния;
б) термодинамические процессы и термодинамические функции (полная и внутренняя энергия, энтальпия, энтропия, энергия Гиббса).
2. Первый закон термодинамики, его математическое выражение. Значение Q V и Q P.
3. Термохимия. Тепловой эффект реакции. Термохимические уравнения. Экзотермические и эндотермические реакции.
4. Закон Гесса, его следствия. Теплоты образования и сгорания веществ.
5. Направленность химических процессов. ΔSо и ΔGо, их взаимосвязь.
Задания для самостоятельной работы
1. Что изучает химическая термодинамика?
2. Понятие о термодинамической системе. Приведите примеры открытых и изолированных, гомогенных и гетерогенных систем.
3. Перечислите параметры, характеризующие состояние термодинамических систем:
а) NH4CI (к)
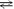 NH3 (г) + HCI (г), ΔH
NH3 (г) + HCI (г), ΔH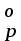 > 0;
> 0;б) N2 (г) + 3 H2 (г)
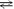 2 NH3 (г), ΔH
2 NH3 (г), ΔH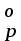 < 0.
< 0.4. Назовите виды термодинамических процессов и укажите, к какому из них можно отнести химические реакции, выполняемые в учебной лаборатории.
5. Приведите определение основных термодинамических функций и поясните их физический смысл.
6. Сформулируйте первый закон термодинамики и приведите его математическое выражение при V = const и P = const.
7. Что понимают под тепловым эффектом реакции и термохимическим уравнением? Приведите примеры уравнений термохимических реакций.
8. Сформулируйте закон Гесса и отметьте его практическое значение.
9. Что понимают под теплотой образования вещества? Используя таблицу 5 приложения, укажите значение энтальпии образования ΔНообр веществ:
а) СО (г) и CO2 (г);
б) H2O (ж) и Н2О (г);
в) CaO3 (к), Ca(OH)2 (к) и CaCO3 (к).
10. Сформулируйте следствия из закона Гесса о тепловом эффекте химической реакции и приведите их математическое выражение.
11. Используя таблицу 5 приложения, вычислите тепловые эффекты реакций ΔH
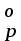 :
:а) Fe2O3 (к) + 2 AI (к) = AI2O3 (к) + 2 Fe (к);
б) 2 SO2 (г) + O2 (г) = 2 SO3 (г);
в) NH3 (г) + HCI (г) = NH4CI (к).
12. Вычислите тепловые эффекты реакций сгорания 10 г следующих веществ: C(алмаз) и P(к); H2 (г) и H2S (г); C2H5OH (ж) и C6H12O6 (к).
13. Какие термодинамические функции определяют направленность химических реакций? Приведите их математическое выражение.
14. Определите направление указанных реакций по значениям ΔS
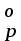 и ΔG
и ΔG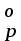 , используя для вычислений таблицу 5 приложения:
, используя для вычислений таблицу 5 приложения:а) 2 CO (г) + O2 (г) = 2 CO2 (г)
;
б) 2 Н2S (г) + 3 O2 (г) = 2 Н2О (г) + 2 SO2 (г);
в) С(графит) + Н2О (г) = СО (г) + Н2 (г).
15. Используя таблицу 5 приложения, вычислите значения ΔH
 , ΔS
, ΔS и ΔG
и ΔG в представленных системах и определите возможность их осуществления в стандартных условиях:
в представленных системах и определите возможность их осуществления в стандартных условиях:а) CaO (к) + H2O (ж) = Ca(OH)2 (к);
б) СaО (к) + СО2 (г) = СaСО3 (к);
в) Ca(OH)2 (к) + CO2 (г) = CaCO3 (к) + H2O (ж).
16. Используя таблицу 5 приложения, определите количество теплоты, выделяющейся при взрыве 8,4 л гремучего газа (н. у.).
17. При восстановлении 12,7 г оксида меди(II) углем (с образованием СО) поглощается 8,24 кДж энергии. Определите ΔH
 образования CuO ( используйте таблицу 5 приложения).
образования CuO ( используйте таблицу 5 приложения).18. Вычислите ΔH
 образования MgCO3(к), пользуясь следующими данными:
образования MgCO3(к), пользуясь следующими данными:С (графит) + О2 = СО2 (г), ΔH
 = - 393,5 кДж;
= - 393,5 кДж;2 Mg (к) + O2 = 2 MgO (к), ΔH
 = - 1203,6 кДж;
= - 1203,6 кДж;MgO (к) + СО2 (г) = MgCO3 (к), ΔH
 = - 117,7 кДж.
= - 117,7 кДж.Лабораторная 10.
Химическая кинетика и химическое равновесие
План занятия
1. Понятие о скорости химической реакции, выражение ее для гомогенных и гетерогенных процессов.
2. Факторы, влияющие на скорость химической реакции:
а) влияние концентрации (закон действующих масс - ЗДМ);
б) влияние температуры (правило Вант-Гоффа, активные молекулы, энергия активации);
в) влияние катализаторов, понятие о гомогенном и гетерогенном катализе;
г) влияние других факторов.
3. Состояние химического равновесия, его количественная характеристика.
4. Смещение химического равновесия. Принцип Ле Шателье. Влияние концентрации, давления и температуры на смещение химического равновесия.
Растворы: H2O (дист.), 2н - Na2S2O3, H2SO4; CuSO4 (1н),
H2O2 (3%), FeCI3 (0,0025M и насыщ.), KNCS (0,0025M и насыщ.), NH4OH (6н).
Приборы и материалы:штативы с пробирками, лопатки, секундомеры, MnO2 (крист.), KCI (крист.).
Опыт 1. Влияние концентрации на скорость
химической реакции
Начертите таблицу 1 и, используя ее данные, приготовьте в трех пробирках растворы Na2S2O3 разной концентрации путем разбавления водой его 2н раствора.
Далее возьмите первую пробирку, поместите в нее одну каплю 2н раствора H2SO4 и быстро встряхните пробирку. С помощью секундомера отметьте время с момента слияния растворов до появления слабого голубоватого помутнения, обусловленного образованием коллоидного раствора серы. Полученный результат внесите в пятую графу таблицы 1. Аналогичные исследования проведите со второй и третьей пробирками.
Таблица 1
Влияние концентрации на скорость реакции
| Номер пробирки | Количество капель | Время t, с | Концен-трация Na2S2O3, моль/л | Скорость u = 1/t, у. e. | |||||
| Na2S2O3, 2н | H2O | H2SO4, 2н | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |||
| 1 | 4 | 8 | 1 | | 1/3 | | |||
| 2 | 8 | 4 | 1 | | 2/3 | | |||
| 3 | 12 | 0 | 1 | | 1 | | |||
Вычислите значение скорости реакции, протекающей в каждой из пробирок. Результаты всех вычислений внесите в седьмую колонку таблицы 1.
Запишите приведенное ниже уравнение реакции, протекающей в пробирках, и приведите выражение ее скорости:
Na2S2O3 + H2SO4 = Na2SO4 + S¯ + SO2 + H2O.
Сделайте вывод о зависимости скорости химической реакции от концентрации реагирующих веществ и выразите эту зависимость графически. Для этого отложите на оси абсцисс значения концентрации растворов Na2S2O3, а на оси ординат - соответствующие им значения скорости. При этом учтите, что график представляет собой усредненную прямую линию.
Опыт 2. Влияние катализаторов на скорость
химической реакции
2.1. Гомогенный катализ
В пробирку с пятью каплями 1н раствора CuSO4 добавьте по каплям 6н раствор NH4OH до образования интенсивно-синего раствора катализатора [Cu(NH3)4]SO4.
В другую пробирку поместите шесть капель 3%-го раствора H2O2 и добавьте в нее по каплям полученный раствор катализатора (с помощью капельной пипетки). Отметьте интенсивность реакции.
Составьте уравнения реакций образования катализатора и разложения Н2О2. Укажите тип катализа.
2.2. Гетерогенный катализ
Поместите в пробирку шесть капель 3%-го раствора Н2О2 и добавьте в нее с помощью лопатки несколько крупинок катализатора MnO2. Отметьте интенсивность реакции.
Укажите тип катализа и составьте уравнение реакции разложения Н2О2.
Сделайте вывод о влиянии катализаторов на скорость реакции.
Опыт 3. Смещение равновесия в обратимой реакции
Начертите таблицу 2. Используя ее данные, смешайте в четырех пробирках 0,0025М растворы FeCI3 и KNCS и наблюдайте слабо-красное окрашивание растворов во всех пробирках.
Далее добавьте в первые три пробирки вещества, указанные в таблице 2. Наблюдайте изменение окраски, сравните ее с окраской раствора в контрольной пробирке и заполните седьмую графу таблицы 2.
Составьте уравнение обратимой реакции и укажите, какой из ее компонентов обусловливает окраску раствора.
Используя данные седьмой графы таблицы 2, отметьте направление смещения равновесия в указанной реакции. Заполните восьмую (последнюю) графу таблицы 2.
Запишите выражения скоростей прямой и обратной реакций приведенного уравнения и выражение константы химического равновесия.
Сделайте вывод о влиянии концентрации на направление смещения равновесия.
Таблица 2