ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 01.12.2023
Просмотров: 476
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
+ H2SO4 = AlOHSO4 + 2H2O
недост. сульфат
гидроксоалюминия
г) 2AlOHSO4 + H2SO4 = Al2(SO4)3 + 2H2O
сульфат
алюминия
д) Al2(SO4)3 + 3Mg = 2Al + 3MgSO4
φºAl3+ | Al = -1,68 B
φºMg2+ | Mg = -2,37 B
Следовательно, магний активнее алюминия и может вытеснить алюминий из его соли:
е) Al + 4HNO3 = Al(NO3)3 + NO + 2H2O
Al – 3e = Al3+ | 1
NO3- + 4H+ + 3e = NO + 2H2O | 1
Пример 8. Напишите уравнения реакций в молекулярных и ионо-молекулярных формах гидроксида натрия со следующими веществами: P2O5, Al(OH)3, CuSO4, ZnO.
Решение:
1) P2O5 + 6NaOH = 2Na3PO4 + 3H2O
P2O5 + 6OH- = 2PO43-+ 3H2O
2) Al(OH)3 + NaOH = Na[Al(OH)4]
амфотер. изб. тетрагидроксоалюминат
натрия
Al(OH)3+ OH- = [Al(OH)4]-
3) CuSO4 + 2NaOH = ↓Cu(OH)2 + Na2SO4
эквивалентные гидроксид
количества меди (II)
Cu2+ + 2OH- = Cu(OH)2
4) PbSO4 + 2NaOH = Na2PbO2 + H2SO4
изб. плюмбит
натрия
PbSO4 +2OH-= PbO22- + SO42-
5) ZnO + 2NaOH = Na2ZnO2 + H2O
амфотер. изб. цинкат
гидроксид натрия
ZnO + 2OH- = ZnO22- + H2O
Пример 9. Напишите реакции следующих превращений
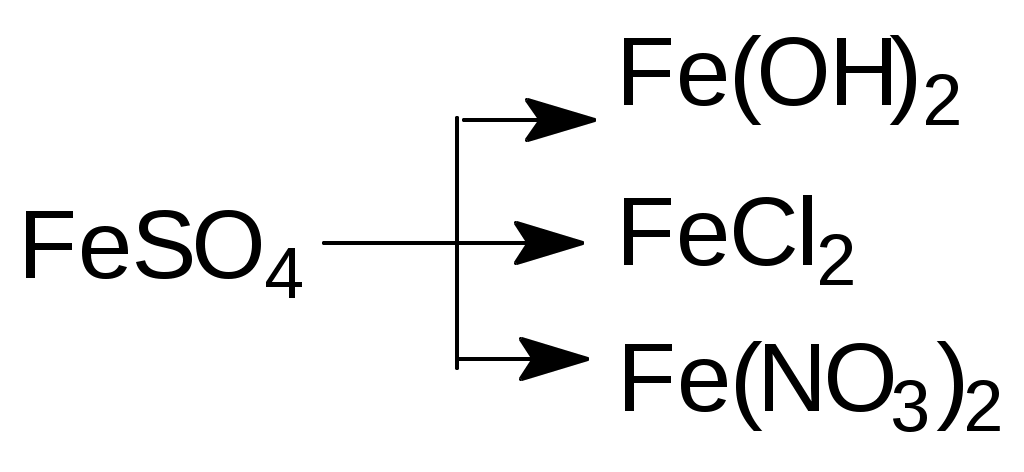
Решение:
1) FeSO4 + 2NaOH = ↓Fe(OH)2 + Na2SO4
2) FeSO4 + BaCl2 = FeCl2 + BaSO4↓
3) FeSO4 + Ba(NO3)2 = Fe(NO3)2 + BaSO4↓
Пример 10. Сколько литров раствора серной кислоты с массовой долей H2SO4 10% и плотностью 1,07 г/мл требуется для нейтрализации гидроксида натрия массой 16 кг?
Решение:
Запишем уравнение реакции нейтрализации:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Определяем массу H2SO4, необходимую для нейтрализации:
2ּ 40 г NaOH – 98 г H2SO4
16000 г NaOH – х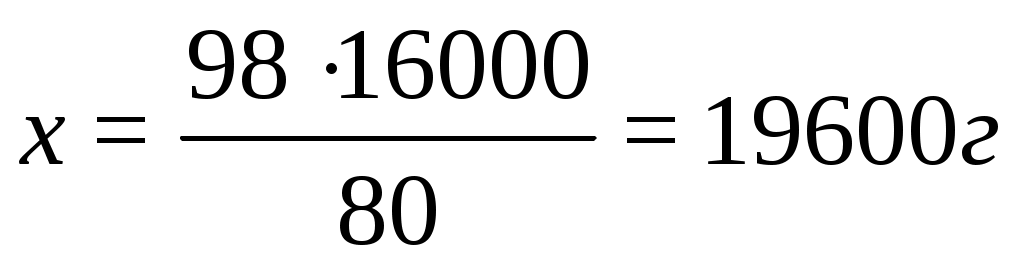
Находим массу 10% раствора H2SO4 по формуле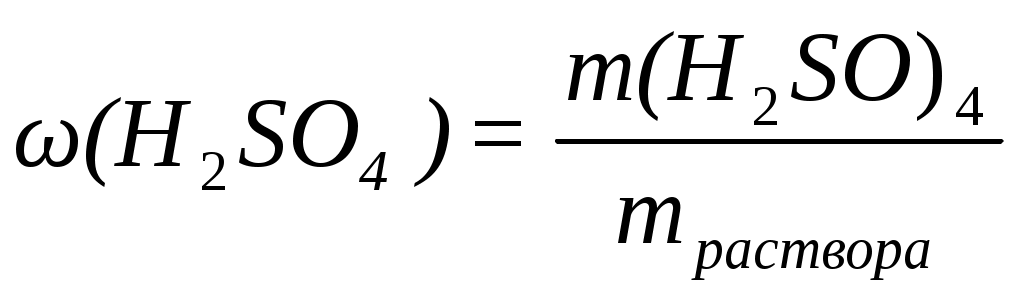 ,
,
Следовательно,
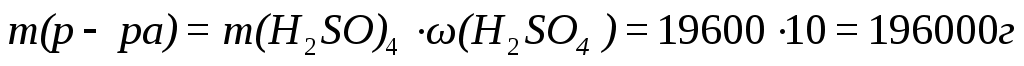
Находим объем раствора H2SO4, необходимый для нейтрализации NaOH:
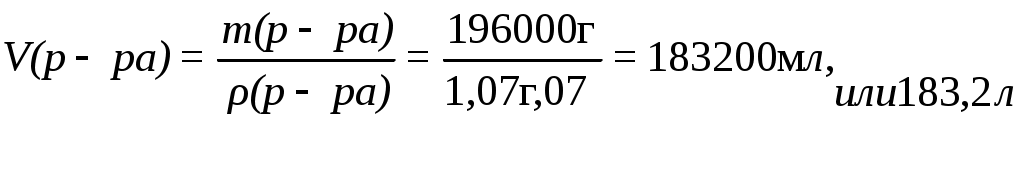
H2SO4, H3BO3, H4P2O7, HClO, HMnO4.
а) основного и кислотного оксидов;
б) основания и кислотного оксида;
в) основного оксида и кислоты.
а) лития, бериллия, бора, углерода, азота;
б) натрия, магния, алюминия, фосфора, серы;
в) стронция, серебра, цинка, сурьмы, мышьяка.
а) рубидия, цезия, галлия, ртути (II);
б) таллия (I), таллия (III), углерода (II), мышьяка (III);
в) мышьяка (V), сурьмы (V), висмута (III), сурьмы (III);
г) серы (IV), серы (VI), селена (IV), селена (VI);
д) теллура (IV), теллура (VI), хлора (I), хлора (VII);
е) хрома (III), хрома (VI), марганца (II), марганца (IV);
ж) марганца (VII), железа (II), железа (III), олова (IV).
а) ClO2, P2O5, P2O3, N2O3, SiO2;
б) MgO, PbO2, PbO, GeO2, Pb2O.
а) CrCl3, Ba(HCO3)2, MgSO4, AlOHCl2;
б) Fe(NO3)3, CrOHSO4, Ca3(PO4)2, Fe(HS)2;
в) (ZnOH)2SO3, Al(H2PO4)3, CaSiO3, FeCl2;
г) Cr2(HPO4)3, FeOHNO3, Al2(SO4)3, CoS;
д) AlN, (CuOH)2CO3, Al2(SO3)3, Mg(HCO3);
е) MgSO3, Na2HPO4, Al(OH)2Cl, CaSiO3;
ж) Na2S, KClO3, FeOHNO3, Ca(H2PO4)2;
и) FeOHCl, FeHPO4, Cu(AlO2), Al2O3;
к) Cu2(OH)2SO4, Na2Cr2O7, Al2S3, NaHZnO2;
л) Ba(HSO3)2, CrOHSO4, Na2PbO2, Na3AlO3;
м) Mg(ClO4)2, CoOHCl, Al2(CO3)3, ZnF2;
н) PbOHNO3, BaHAlO3, K2Cr2O7, Mg2Si;
п) Al4(SiO4)3, Cd(HS)2, NaH2PO4, K2MnO4;
р) NaMnO4, Al2(ZnO2)3, Fe(HCO3)2, CrOHSO4
;
с) Ba(OCl)2, NaVO3, Ca(HSiO3)2, (PbOH)2SO4.
а) дигидрофосфат кальция, сульфат гидроксоалюминия, сульфат бария, карбонат алюминия;
б) нитрит кальция, гидроалюминат цинка, сульфид бария, хлорид гидроксоцинка;
в) сульфат гидроксоникеля (II), гидросульфид кадмия, карбид железа (III), хромат кальция;
г) хлорид гидроксожелеза (II), силицид магния, дигидроалюминат бария, нитрит цинка;
д) хлорид дигидроксоалюминия, гидросульфит бария, нитрид кальция, манганат железа (III);
е) нитрат гидроксохрома (III), бихромат стронция, дигидросиликат калия, ортоалюминат бария;
ж) метаборат меди (II), ортоалюминат алюминия, хлорид гидроксоцинка (II), сульфид железа (III);
и) гипохлорит алюминия, гидроортоалюминат кальция, бромид ванадия (V), сульфит гидроксомеди (II);
к) метафосфат кальция, перхлорат натрия, гидрокарбонат магния, сульфат дигидроксожелеза (II);
л) ортосиликат магния, нитрит свинца (II), гидрохромат меди (II), бромид гидроксоалюминия;
м) метасиликат цинка, сульфит железа (III), нитрат гидроксожелеза (III), дигидроортоалюминат кобальта (II);
н) метаалюминат кальция, гидросульфид железа (III), перманганат бария, хлорид дигидроксомагния;
п) ортоалюминат магния, гидроксокарбонат алюминия, метафосфат цинка;
р) плюмбит магния, ортосиликат алюминия, нитрат дигидроксохрома (III), гидрофосфат никеля (II);
с) плюмбит алюминия, сульфид алюминия, хлорид дигидроксохрома (III), гидросульфит меди (II).
а) KOH+H2SO3
г) KOH+H3PO3
б) Ca(OH)2+H3PO4 д) NaOH+H2S
в) KOH+CO2 е) Ba(OH)2+H2SO4
а) Al(OH)3+HNO3 ; б) Mg(OH)2+HCl; в) Cu(OH)2+HNO3; г) Bi(OH)3+HNO3;
д) Fe(OH)3+H2SO4; е) Al(OH)3+H2SO4.
а)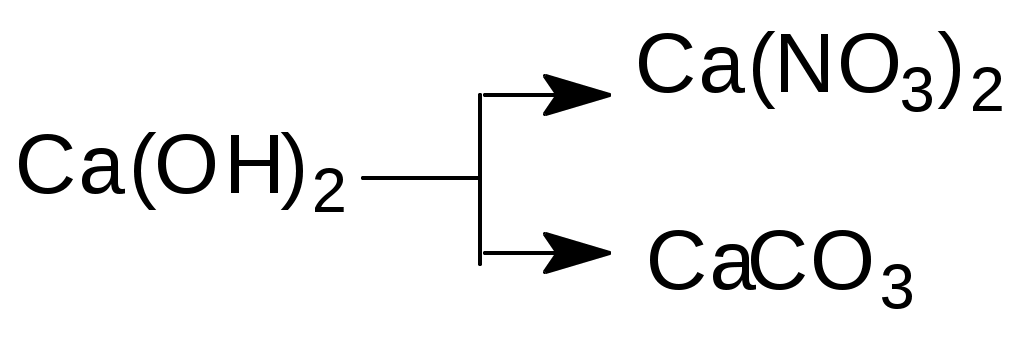 б)
б) 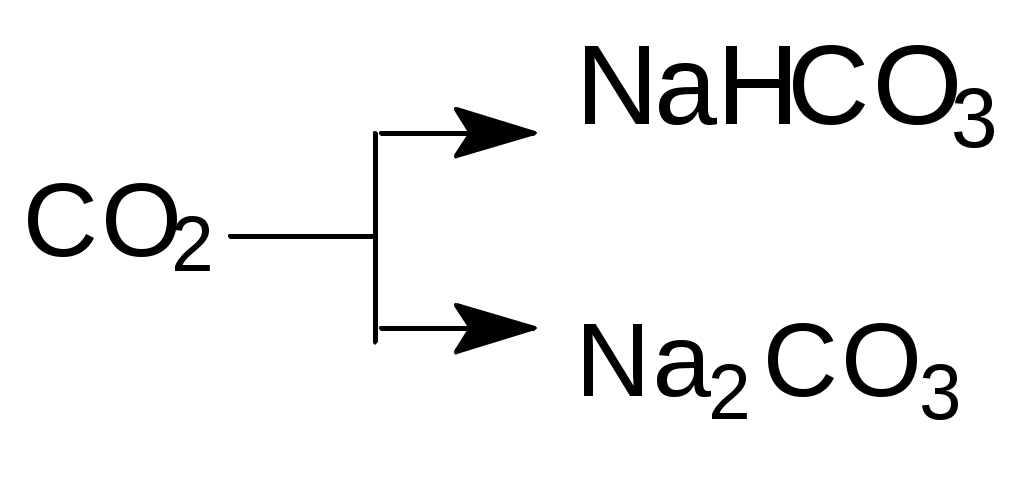 в)
в) 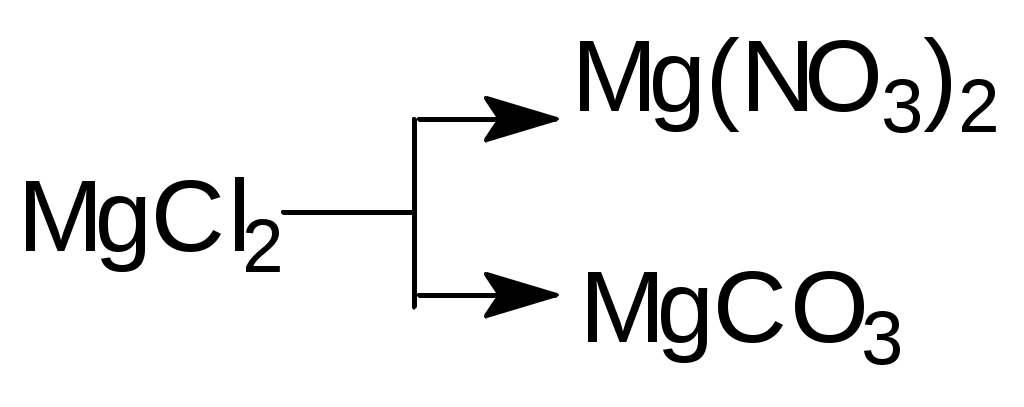
а)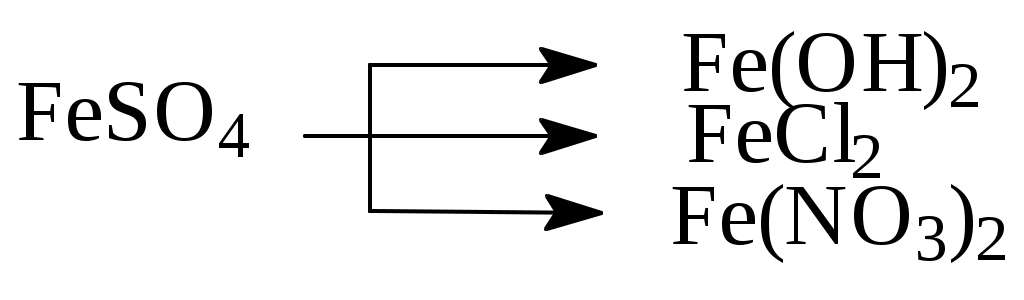 б)
б)  в)
в) 
а) Al2(SO
недост. сульфат
гидроксоалюминия
г) 2AlOHSO4 + H2SO4 = Al2(SO4)3 + 2H2O
сульфат
алюминия
д) Al2(SO4)3 + 3Mg = 2Al + 3MgSO4
φºAl3+ | Al = -1,68 B
φºMg2+ | Mg = -2,37 B
Следовательно, магний активнее алюминия и может вытеснить алюминий из его соли:
е) Al + 4HNO3 = Al(NO3)3 + NO + 2H2O
Al – 3e = Al3+ | 1
NO3- + 4H+ + 3e = NO + 2H2O | 1
Пример 8. Напишите уравнения реакций в молекулярных и ионо-молекулярных формах гидроксида натрия со следующими веществами: P2O5, Al(OH)3, CuSO4, ZnO.
Решение:
1) P2O5 + 6NaOH = 2Na3PO4 + 3H2O
P2O5 + 6OH- = 2PO43-+ 3H2O
2) Al(OH)3 + NaOH = Na[Al(OH)4]
амфотер. изб. тетрагидроксоалюминат
натрия
Al(OH)3+ OH- = [Al(OH)4]-
3) CuSO4 + 2NaOH = ↓Cu(OH)2 + Na2SO4
эквивалентные гидроксид
количества меди (II)
Cu2+ + 2OH- = Cu(OH)2
4) PbSO4 + 2NaOH = Na2PbO2 + H2SO4
изб. плюмбит
натрия
PbSO4 +2OH-= PbO22- + SO42-
5) ZnO + 2NaOH = Na2ZnO2 + H2O
амфотер. изб. цинкат
гидроксид натрия
ZnO + 2OH- = ZnO22- + H2O
Пример 9. Напишите реакции следующих превращений

Решение:
1) FeSO4 + 2NaOH = ↓Fe(OH)2 + Na2SO4
2) FeSO4 + BaCl2 = FeCl2 + BaSO4↓
3) FeSO4 + Ba(NO3)2 = Fe(NO3)2 + BaSO4↓
Пример 10. Сколько литров раствора серной кислоты с массовой долей H2SO4 10% и плотностью 1,07 г/мл требуется для нейтрализации гидроксида натрия массой 16 кг?
Решение:
Запишем уравнение реакции нейтрализации:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Определяем массу H2SO4, необходимую для нейтрализации:
2ּ 40 г NaOH – 98 г H2SO4
16000 г NaOH – х
Находим массу 10% раствора H2SO4 по формуле
Следовательно,
Находим объем раствора H2SO4, необходимый для нейтрализации NaOH:
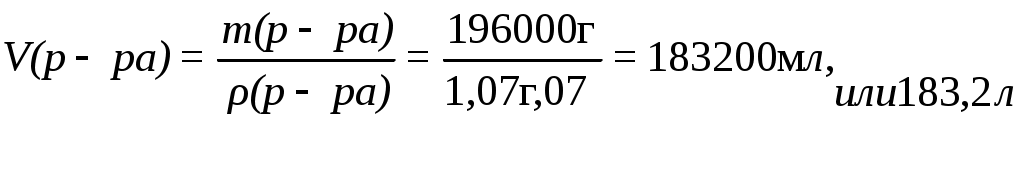
-
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
-
Написать формулы и наименования оксидов указанных кислот:
H2SO4, H3BO3, H4P2O7, HClO, HMnO4.
-
Написать формулы и наименования оксидов, соответствующих указанным гидроксидам: H2SiO3, Cu(OH)2, H3AsO4, H2WO4, Fe(OH)3. -
Выведите формулы ангидридов и назовите их, зная формулы следующих кислот: H2MoO4, H2Cr2O7, HNO3, HBO2, H2MnO4. -
Назовите и напишите графические формулы следующих оксидов: N2O, SO2, Mn2O7, CO, SnO2. Приведите соответствующие им гидратные соединения. -
Назовите и напишите графические формулы следующих оксидов: N2O5, P2O3, CaO, K2O, NO2. Напишите уравнения реакций их гидратации. -
Какие оксиды можно получить, разлагая при нагревании следующие вещества: Fe(OH)3, Cr(OH)3, Pb(NO3)2, H2SiO3, H2SO4? Напишите уравнения реакций и названия оксидов. -
С какими из перечисленных ниже оксидов будет реагировать соляная кислота: SiO2, CuO, SO2, Fe2O3, CdO, P2O5, CO2, ZnO? Напишите соответствующие реакции. -
Могут ли одновременно находиться в растворе: LiOH и NaOH, KOH и SO2, Ca(OH)2 и Ba(OH)2, Sr(OH)2 и NO2, NaOH и P2O5, Ba(OH)2 и CO2? Ответ поясните. Напишите необходимые реакции и названия образующихся соединений. -
Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: P2O5, CO2, N2O5, SO2, NO2? -
Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Al2O3, CaO, CrO. -
Написать уравнения реакций, доказывающих кислотный характер SO3, Mn2O7, P2O5, CrO3. -
Какие из веществ, формулы которых приведены ниже, будут реагировать с оксидом бария: CO2, NaOH, P2O5, AlCl3, K2O, CuO, H2O? Дайте обоснованный ответ. Напишите уравнения возможных реакций, укажите условия их осуществления и назовите вещества. -
Какие вещества, формулы которых указаны ниже, будут реагировать с оксидом цинка: NaOH, Fe2O3, Ca(OH)2, SO3, HNO3? Дайте обоснованный ответ. Запишите уравнения возможных реакций, укажите условия их осуществления и назовите вещества. -
Написать уравнения реакций образования Mg2P2O7, Ca3(PO4)2, Mg(ClO4)2, Ba(NO3)2 в результате взаимодействия:
а) основного и кислотного оксидов;
б) основания и кислотного оксида;
в) основного оксида и кислоты.
-
Укажите, какой характер имеют гидраты указанных оксидов: CaO, N2O5, Mn2O7, MnO, SnO, FeO, SiO2, Fe2O3. Напишите формулы гидратов, назовите их. -
Назовите и напишите графические формулы оксидов: P2O5, CO2, Mn2O7, ZnO. Составьте уравнения реакций взаимодействия их с водой. -
Напишите реакции солеобразования оксидов следующих элементов:
а) лития, бериллия, бора, углерода, азота;
б) натрия, магния, алюминия, фосфора, серы;
в) стронция, серебра, цинка, сурьмы, мышьяка.
-
Назовите оксиды и приведите формулы соответствующих им гидратных соединений: SnO, SnO2, ClO2, SrO, P2O5, N2O5. -
Напишите эмпирические и графические формулы оксидов:
а) рубидия, цезия, галлия, ртути (II);
б) таллия (I), таллия (III), углерода (II), мышьяка (III);
в) мышьяка (V), сурьмы (V), висмута (III), сурьмы (III);
г) серы (IV), серы (VI), селена (IV), селена (VI);
д) теллура (IV), теллура (VI), хлора (I), хлора (VII);
е) хрома (III), хрома (VI), марганца (II), марганца (IV);
ж) марганца (VII), железа (II), железа (III), олова (IV).
-
Напишите уравнения реакций солеобразования оксидов хрома. Приведите графические формулы этих оксидов. -
Напишите графические формулы и назовите оксиды:
а) ClO2, P2O5, P2O3, N2O3, SiO2;
б) MgO, PbO2, PbO, GeO2, Pb2O.
-
Назовите соли и напишите их графические формулы:
а) CrCl3, Ba(HCO3)2, MgSO4, AlOHCl2;
б) Fe(NO3)3, CrOHSO4, Ca3(PO4)2, Fe(HS)2;
в) (ZnOH)2SO3, Al(H2PO4)3, CaSiO3, FeCl2;
г) Cr2(HPO4)3, FeOHNO3, Al2(SO4)3, CoS;
д) AlN, (CuOH)2CO3, Al2(SO3)3, Mg(HCO3);
е) MgSO3, Na2HPO4, Al(OH)2Cl, CaSiO3;
ж) Na2S, KClO3, FeOHNO3, Ca(H2PO4)2;
и) FeOHCl, FeHPO4, Cu(AlO2), Al2O3;
к) Cu2(OH)2SO4, Na2Cr2O7, Al2S3, NaHZnO2;
л) Ba(HSO3)2, CrOHSO4, Na2PbO2, Na3AlO3;
м) Mg(ClO4)2, CoOHCl, Al2(CO3)3, ZnF2;
н) PbOHNO3, BaHAlO3, K2Cr2O7, Mg2Si;
п) Al4(SiO4)3, Cd(HS)2, NaH2PO4, K2MnO4;
р) NaMnO4, Al2(ZnO2)3, Fe(HCO3)2, CrOHSO4
;
с) Ba(OCl)2, NaVO3, Ca(HSiO3)2, (PbOH)2SO4.
-
Составьте формулы следующих солей:
а) дигидрофосфат кальция, сульфат гидроксоалюминия, сульфат бария, карбонат алюминия;
б) нитрит кальция, гидроалюминат цинка, сульфид бария, хлорид гидроксоцинка;
в) сульфат гидроксоникеля (II), гидросульфид кадмия, карбид железа (III), хромат кальция;
г) хлорид гидроксожелеза (II), силицид магния, дигидроалюминат бария, нитрит цинка;
д) хлорид дигидроксоалюминия, гидросульфит бария, нитрид кальция, манганат железа (III);
е) нитрат гидроксохрома (III), бихромат стронция, дигидросиликат калия, ортоалюминат бария;
ж) метаборат меди (II), ортоалюминат алюминия, хлорид гидроксоцинка (II), сульфид железа (III);
и) гипохлорит алюминия, гидроортоалюминат кальция, бромид ванадия (V), сульфит гидроксомеди (II);
к) метафосфат кальция, перхлорат натрия, гидрокарбонат магния, сульфат дигидроксожелеза (II);
л) ортосиликат магния, нитрит свинца (II), гидрохромат меди (II), бромид гидроксоалюминия;
м) метасиликат цинка, сульфит железа (III), нитрат гидроксожелеза (III), дигидроортоалюминат кобальта (II);
н) метаалюминат кальция, гидросульфид железа (III), перманганат бария, хлорид дигидроксомагния;
п) ортоалюминат магния, гидроксокарбонат алюминия, метафосфат цинка;
р) плюмбит магния, ортосиликат алюминия, нитрат дигидроксохрома (III), гидрофосфат никеля (II);
с) плюмбит алюминия, сульфид алюминия, хлорид дигидроксохрома (III), гидросульфит меди (II).
-
Составить уравнения реакций получения солей: дигидрофосфат натрия, гидросульфит бария, хлорид дигидроксоалюминия, нитрат гидроксохрома (III).
-
Как превратить соли, указанные в задаче 24, в средние? -
Изменяя соотношение реагирующих веществ по реакции Ca(OH)2+H3PO4 получить кислые, основную и среднюю соли. -
Назовите приводимые ниже кислые соли и напишите уравнения реакций, при помощи которых можно эти соли превратить в средние: KH2PO4, K2HPO4. -
Назовите приводимые ниже основные соли и напишите уравнения реакций, при помощи которых можно превратить эти соли в средние: Al(OH)Cl2, Fe(OH)2Cl. -
Определите массу гидроксида натрия, необходимую для перевода 100 г гидрокарбоната натрия в карбонат натрия. -
Напишите уравнения реакций образования кислых солей (назовите эти соли):
а) KOH+H2SO3
г) KOH+H3PO3
б) Ca(OH)2+H3PO4 д) NaOH+H2S
в) KOH+CO2 е) Ba(OH)2+H2SO4
-
Напишите уравнения реакций образования основных солей (назовите их):
а) Al(OH)3+HNO3 ; б) Mg(OH)2+HCl; в) Cu(OH)2+HNO3; г) Bi(OH)3+HNO3;
д) Fe(OH)3+H2SO4; е) Al(OH)3+H2SO4.
-
Составьте формулы средних и кислых бариевых солей следующих кислот: H2SO4, H2S, H3PO4. Напишите реакции получения кислых солей. Назовите их.
-
Переведите в средние следующие соли: NaHCO3, ZnOHCl, Bi(OH)2NO3, Ca(HCO3)2,Mg(HSO3)2. Напишите уравнения соответствующих реакций. -
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Fe2(SO4)3, Fe(HCO3)2. -
Переведите в средние следующие соли: FeOHSO4, Fe(HCO3)2, KHS, (MgOH)2SO4. -
Напишите формулы средних, кислых и основных солей алюминия следующих кислот: CH3COOH, HNO3, H2SiO3. -
Напишите формулы основных и кислых кальциевых солей следующих кислот: H2SiO3, H2CO3, H2SO4. -
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей K2S, KHS, (MgOH)2SO4, Mg(HSiO3)2. -
Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а)
 б)
б) 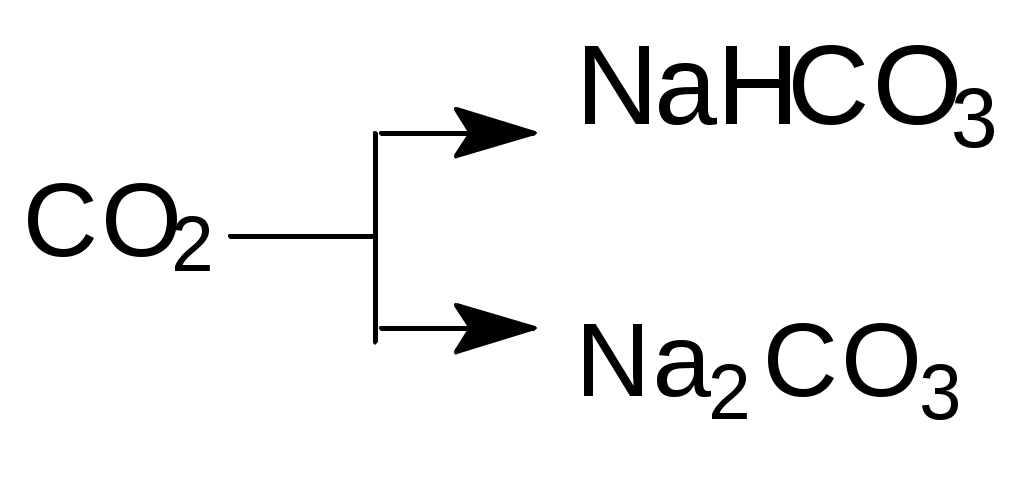 в)
в) 
-
Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а)
 б)
б)  в)
в) 
-
Допишите уравнения реакций взаимодействия веществ в молекулярной и ионной формах:
а) Al2(SO