Файл: Курсовая работа термодинамические и кинетические особенности пиролиза углеводородов.docx
Добавлен: 03.12.2023
Просмотров: 134
Скачиваний: 4
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Зависимость скорости реакции от температуры. известно эмпирическое правило вант-гоффа, которое заключается в том, что при нагревании на 10 ос скорость большинства химических реакций увеличивается в 2–4 раза.
чувствительность скорости к температуре определяется только лишь зависимостью константы скорости от температуры. известно уравнение аррениуса
k kexp E,
(2.20)
o RT
оно содержит два параметра, характеризующих химическую реакцию: ko — предэкспоненциальный множитель, который не
зависит от температуры, а определяется только механизмом реак- ции; E—энергия активации.
Энергия активации — это некоторая пороговая энергия, харак- теризующая высоту энергетического барьера на пути реакции. Энергия активации для большинства реакций также не зависит от температуры. ее можно определить, измерив константу скорости при двух температурах. из уравнения аррениуса следует
E RT1T2 ln k2 .
aT T k
2 1 1
более точно энергию активации определяют по значениям кон- станты скорости при нескольких температурах, т. е. графически.
для этого уравнение (2.20) записывают в логарифмической форме:
ln k ln ko
-
EaRT
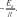 и представляют экспериментальную зависимость логарифма кон- станты скорости от обратной температуры в линеаризованной форме. в этом случае угловой коэффициент прямой на рис. 2.4
и представляют экспериментальную зависимость логарифма кон- станты скорости от обратной температуры в линеаризованной форме. в этом случае угловой коэффициент прямой на рис. 2.4будет равен
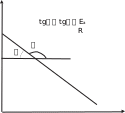 ln k
ln k1/ T
рис. 2.4
различают истинную и кажущуюся (эффективную или наблю- даемую) энергии активации. если определенная эксперимен- тально величина k является константой скорости одностадийной реакции, то найденная по уравнению аррениуса величина Ea—
истинная. если же протекает многостадийная реакция из комбина-
ции нескольких зависящих от температуры параметров, то аррени- усовскую энергию активации называют кажущейся (эффективной, наблюдаемой).
типовое задание к курсовой работе
-
в идеальной газовой системе возможно протекание несколь- ких реакций, характеризующих процесс пиролиза углеводородов. во всех вариантах приведены по четыре различные реакции.
указаны условия проведения эксперимента:
| температура (при 1 атм) | 570 | 610 | 650 | 670 | 700 |
| давление (при 650 к) | 1 | 0,7 | 1,2 | 1,5 | 3 |
определите наиболее вероятную из приведенных реакций в указанном диапазоне температур.
-
полагая, что все остальные реакции подавлены и в системе протекает только одна, наиболее вероятная реакция, рассчитайте степень термической диссоциации углеводорода (пропана, бутана, гексана) при разных температурах (и давлении 1 атм), а также при разных давлениях (и средней из приведенного диапазона темпера- туре) и постройте графически зависимость степени термической диссоциации пропана (бутана) от температуры и давления. про- анализируйте полученные данные. как будет изменяться степень термической диссоциации углеводорода, если в систему изна- чально будет введен посторонний газ? -
в табл. 2 прил. 6 приведены данные кинетического экспери- мента, а именно изменяющаяся во времени концентрация углево- дорода в системе (моль/м3) при различных температурах проведе- ния опыта. определите по этой таблице все параметры уравнения формальной кинетики.