ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 138
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Термическая обработка
Вопрос 1. Атомно-кристаллическое строение металлических материалов. Металлическое состояние вещества. Кристаллическая решетка и ее описание. Классификация кристаллов по типу химической связи: металлы, ионные кристаллы, ковалентные кристаллы, молекулярные кристаллы. Анизотропия кристаллов. Типы кристаллических решеток металлов. Параметры кристаллической решетки: период решетки.Все вещества в твёрдом состоянии могут иметь кристаллическое или аморфное строение. В аморфном веществе атомы расположены хаотично, а в кристаллическом – в строго определённом порядке. Все металлы в твёрдом состоянии имеют кристаллическое строение.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решётки – воображаемой пространственной сеткой, в узлах которой расположены атомы. Наименьшая часть кристаллической решётки, определяющая структуру металла, называется элементарной кристаллической ячейкой.
Типы кристаллических решёток металлов
-
кубическая объемно-центрированная – атомы расположены в узлах ячейки и один атом в центре куба (рис.1). Такую решетку имеют хром, вольфрам, молибден и др.;
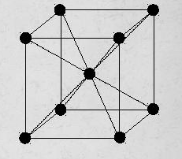
Рисунок 1. Кубическая объемно-центрированная решетка
-
кубическая гранецентрированная – атомы расположены в вершинах куба и в центре каждой грани (рис.2). Эту решётку имеют алюминий, медь, никель и др.;
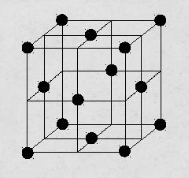
Рисунок 2. Кубическая гранецентрированная решётка
-
гексагональная плотноупакованная – атомы расположены в вершинах и центрах оснований шестигранной призмы и три атома расположены в середине призмы (рис.3). Такой тип решётки имеют магний, цинк и некоторые другие металлы.
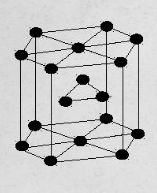
Рисунок 3. Гексагональная плотноупакованная решётка
Параметры кристаллической решётки:
-
период решётки – расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решётки; -
координационное число – число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решётке; -
базис решётки – количество атомов, приходящихся на одну элементарную ячейку решётку.
Классификация кристаллов по типу химической связи:
-
атомная кристаллическая решётка – образуется, когда в узлах кристалла атомы. Атомы соединены между собой прочными ковалентными химическими связями → такая решётка очень прочная.
Физические св-ва: - прочность;
- тугоплавкость;
- низкая электропроводность;
- низкая теплопроводность;
- химическая инертность;
- малая растворимость.
Примеры веществ: простые вещества с высокой валентностью – бор, углерод, кремний и т.д.; сложные вещества, образованные этими неметаллами: кремнезём (SiO2), карбид кремния (SiC), карбид бора, нитрид бора и т.д.
-
молекулярная кристаллическая решётка – эта такая решётка, в узлах которых располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, электростатическое притяжение).
Физические св-ва: - легкоплавность;
NB: Чем больше сила притяжения между молекулами, тем выше температура плавления вещества.
- высокая сжимаемость;
- молекулярные кристаллы в твёрдом виде, а также в растворах и расплавах не проводят ток;
- фазовое состояние при нормальных условиях – газы, жидкости, твёрдые вещества;
- высокая летучесть;
- малая твёрдость.
Примеры веществ: неметаллы, образующие маленькие прочные молекулы (O2, N2, H2, S8); сложные веществ (немет.) с ковалентными полярными связями (кроме оксидов кремния и бора, соединений кремния и углерода) – вода, оксид серы SO3 и др.; одноатомные инертные газы (неон, аргон и т.д.); органические вещества, в которых нет ионных связей – метан, бензол.
-
ионная кристаллическая решётка – когда в узлах кристалла находятся заряженные частицы (ионы). Как правило, в ионных кристаллах чередуются положительно заряженные ионы (катионы) и отрицательно заряженные (анионы), поэтому частицы в кристаллах удерживаются силами электростатического притяжения. Ионная кристаллическая решётка характерна для веществ с ионной химической связью.
Физические свойства: - высокая температура плавления;
- растворы и расплавы хорошо проводят ток;
- хорошая растворимость в полярных растворителях;
- твёрдое фазовое состояние у большинства соединений при н.у.
Примеры веществ: соли органические и неорганические, в том числе соли аммония; основания; оксиды металлов; бинарные соединения, в составе которых есть металлы и неметаллы.
-
металлическая кристаллическая решётка – решётка, обусловленная металлической химической связью. Атомы металлов довольно слабо удерживают валентные электроны. В кристалле одновременно происходят следующие процессы: часть атомов отдает электроны и становится положительно заряженными частицами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Таким образом, возникают ионы, как при образовании ионной связи и образуются общие электроны, как при образовании ковалентной связи. Свободные электроны перемещаются хаотично по всему объему кристалла, и их иногда называют «электронным газом».
Физические свойства: - высокая тепло- и электропроводность;
- ковкость и пластичность;
- металлический блеск;
- металлы, как правило, нерастворимы в растворителях;
- все металлы, кроме ртути, твёрдые при н.у.
Металлическое состояние вещества характеризуется следующими признаками:
- высокая отражательная способность (металлический блеск);
- высокая пластичность;
- высокая тепловая и электропроводность;
- полож. темп. коэффициент линейного расширения.
Анизотропия кристаллов
Анизотропия – это различие свойств среды (например, физических: упругости, электропроводности, теплопроводности, показателя преломления, скорости звука или света и др.) в различных направлениях внутри этой среды; в противоположность изотропии.
В отношении одних свойств среда может быть изотропна, а в отношении других – анизотропна; степень анизотропии также может различаться.
Анизотропия является характерным свойством кристаллических тел. При этом свойство анизотропии в простейшем виде проявляется только у монокристаллов. У поликристаллов анизотропия тела в целом (макроскопически) может не проявляться вследствие беспорядочной ориентировки микрокристаллов, или даже совсем не проявляется, за исключением случаев специальных условий кристаллизации, спец. обработки и т.п.
Причиной анизотропности кристаллов является то, что при упорядоченном расположении атомов молекул или ионов силы взаимодействия между ними и межатомные расстояния (а также некоторые не связанные с ними прямо величины, например, поляризуемость и электропроводность) оказывается неодинаковыми по различным направлениям. Причиной анизотропии молекулярного кристалла может быть ассиметрия его молекул. Макроскопически это неодинаковость проявляется, как правило, лишь его кристаллическая структура не слишком симметрична.
Помимо кристаллов, естественная анизотропия – характерная особенность многих материалов биологического происхождения, например, деревянных брусков.
Анизотропия свойственна жидким кристаллам, движущимся жидкостям (неньютоновским особенно).
Анизотропией особого рода в масштабах всего кристалла или его областей обладают ферромагнетики и сегнетоэлектрики.
Вопрос 2. Основы теории кристаллизации металлов. Кристаллизация чистых металлов. Особенности свойств металлов в жидком и твердом состояниях. Понятие о ближнем и дальнем порядке. Условие равновесия фаз в однокомпонентной системе. Переохлаждение. Понятие о теоретической и фактической температурах кристаллизации. Параметры кристаллизации – скорость зарождения центров и скорость роста. Гомогенная кристаллизация. Понятие о критическом зародыше. Гетерогенное зарождение. Влияние примесей на процесс кристаллизации. Модифицирование и модификаторы. Величина зерна кристаллизующегося металла. Кристаллизация и структура слитка (отливки). Дефекты строения слитка, обусловленные особенностями кристаллизации.
Кристаллизация – процесс, при котором металл из жидкого состояния в твёрдое (кристаллическое). Кристаллизация возможна в условиях, когда система переходит к термодинамически более устойчивому состоянию с меньшей энергией Гиббса (свободной энергией) G, т.е. когда энергия Гиббса кристалла меньше, чем энергия Гиббса жидкой фазы.
Если превращение происходит с небольшим изменением объема, то
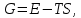
где E – полная энергия (внутренняя энергия фазы); T – абсолютная температура; S – энтропия.
Свободные энергии и жидкого, и твердого состояния металлов и сплавов уменьшаются с повышением температуры (рис. 4). При достижении температуры Т0 свободные энергии жидкого и твердого состояния равны. Температура Т
0 соответствует равновесной (или теоретической) температуре кристаллизации (или плавления) данного вещества, при которой обе фазы (жидкая и твердая) могут сосуществовать одновременно. Процесс кристаллизации при этой температуре еще не начинается. Процесс кристаллизации развивается, если созданы условия, при которых возникает такая разность свободных энергий, когда свободная энергия твердого металла меньше, чем жидкого. Как видно из рис. 4, это возможно только тогда, когда жидкость охлаждена ниже точки Т0, например, до температуры Тк (фактической температуры кристаллизации).
Разность между температурами Т0 и Тк, при которых может протекать процесс кристаллизации, носит название степени переохлаждения:
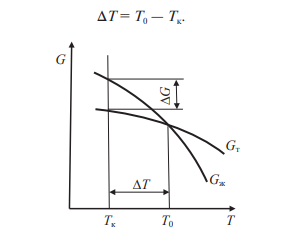
Рисунок 4. Зависимость энергии Гиббса G металла в жидком и твёрдом состояниях от температуры
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах «Время – температура». На рис. 5 приведены термические кривые охлаждения при кристаллизации металла с разной скоростью v. Сначала охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением. При достижении температуры кристаллизации Тк, лежащей ниже температуры Т0, на кривой охлаждения появляется горизонтальная площадка, так как отвод теплоты в окружающую среду компенсируется выделяющейся при кристаллизации так называемой скрытой теплотой кристаллизации. По окончании кристаллизации, т. е. после полного перехода в твердое состояние, температура снова начнет снижаться, и твердое кристаллическое вещество охлаждается.
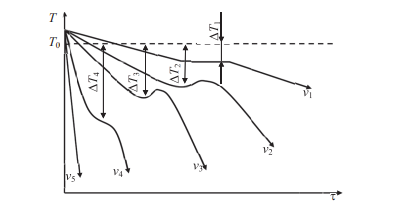
Рисунок 5. Кривые охлаждения металла при кристаллизации (v1<v2<v3<v4<v5)
Как видно из кривых кристаллизации (рис. 5), чем больше скорость охлаждения, тем больше степень переохлаждения и тем ниже температура, при которой происходит процесс кристаллизации. Чем больше скорость охлаждения, тем больше величина переохлаждения. Для того чтобы полностью переохладить металл в жидком состоянии, требуются большие скорости охлаждения (миллионы и даже миллиарды градусов в секунду). При таких скоростях охлаждения (v