ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 145
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
В верхней части слитка, которая затвердевает в последнюю очередь, концентрируется усадочная раковина. Под усадочной раковиной металл получается рыхлым, в нем содержится много усадочных пор. Часть слитка с усадочной раковиной и рыхлым металлом отрезают.
Качественная структура формируется при непрерывной разливке. Литой металл л отличается высокой пластичностью и мелкозернистой структурой, приближаясь по качеству к деформированному металлу.
Вопрос 3. Фазы в сплавах. Определение фазы, компонента, системы. Правило фаз Гиббса. Механические смеси. Твердые растворы замещения. Ограниченные и неограниченные твердые растворы. Упорядоченные твердые растворы. Твердые растворы внедрения. Роль размерного фактора. Промежуточные фазы, их разновидности. Свойства электронных соединений, типы кристаллической решетки. Фазы внедрения (карбиды, гидриды, нитриды и бориды). Фазы вычитания. Фазовые и структурные составляющие в сплавах.
Сплав – это материал, состоящий из двух или более элементов (металлов с металлами или неметаллами). Строение металлических сплавов более сложное по сравнению с чистыми металлами. Компоненты сплава могут взаимодействовать, образуя различные по составу, типу связи и строение кристаллические фазы.
Фаза – 1) это гомогенная часть гетерогенной системы, имеющая определенное строение, состав, обладающая своими термодинамическими свойствами и отделенная от других частей системы границей раздела. Свойства фаз при переходе через границу раздела меняются скачкообразно; 2) это часть системы, характеризующаяся одинаковыми составом, физическими и химическими свойствами в отсутствие внешних сил и полей и ограниченная физической поверхностью раздела.
Компонентами называются вещества, образующие систему, взятые в минимальном числе, достаточном для ее образования.
Системой называется тело (фаза) или совокупность тел (фаз), находящихся в состоянии равновесия. Все остальные тела – окружающая среда. Взаимодействия системы с окружающей средой могут быть различные: обмен теплотой, работой, веществом. По числу присутствующих фаз системы подразделяют на гомогенные (образованные одной фазой) и гетерогенные (содержащие несколько фаз).
В пространстве системы фаза может занимать одну часть (замкнутую область) или быть разделённой на множество частей. Например, все кристаллы соли, присутствующей в виде порошка, составляют одну твёрдую фазу. Термин «фаза» не совпадает с термином «агрегатное состояние вещества», в системе могут присутствовать различные фазы в одном агрегатном состоянии. Убедиться в этом просто, для этого можно слить в одном стакане немного воды и растительного масла и увидеть две различные жидкие фазы.
Число фаз в равновесной системе не может быть произвольным, при изменении термодинамических параметров число равновесных фаз может изменяться.
Число термодинамических степеней свободы (вариантность состояния системы) – количество параметров состояния равновесной системы, значения которых можно изменять в некоторых пределах без изменения числа и природы равновесных фаз; число внешних и внутренних факторов, которое можно изменять без изменения числа фаз.
Составляющие вещества – вещества, которые могут быть выделены из системы и существовать вне ее. Если в системе не протекают химические реакции, то каждое из веществ, составляющих систему, является её компонентом.
Число независимых компонентов равно числу составляющих систему веществ за вычетом числа независимо протекающих реакций.
Правило фаз Гиббса: Число степеней свободы f (вариантность состояния) равновесной термодинамической системы, на которую из внешних факторов влияют только p и T, равно числу независимых компонентов K минус число равновесных фаз Ф плюс число внешних факторов (температуры и давления):
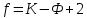
Число степеней свободы системы в состоянии равновесия может быть равно нулю (инвариантное состояние), единице (моновариантное состояние), двум (бивариантное состояние) или иному целому положительному числу, зависящему от количества компонентов и числа равновесных фаз.
Применяя правило фаз к металлам, можно из внешних факторов учитывать только температуру, поскольку давление мало влияет на состояние сплава. Тогда правило фаз Гиббса будет иметь вид:
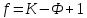
Поскольку число степеней свободы не может быть ниже нуля или дробным числом, то число фаз, находящихся в равновесии, не может быть больше, чем на 1, числа компонентом системы. Например, в двухкомпонентных сплавах в равновесии может находиться не более трех фаз.
В жидком состоянии почти все металлы растворяются друг в друге и образуют жидкий раствор.
При затвердевании сплава возможно образование следующих фаз:
-
Механическая смесь различных фаз -
Твёрдый раствор -
Химическое соединение
Механические смеси. В тех случаях, когда компоненты не взаимодействуют между собой и не способны взаимному растворению, то образуются механические смеси различных кристаллических фаз. Материал будет состоять из зерен различного состава, структуры и свойств.
При строго определенных условиях из жидкого раствора одновременно кристаллизуются два (или более) компонента. В результате образуется механическая смесь двух фаз - эвтектика. Эвтектика имеет определенный химический состав и образуется при постоянной температуре. Зерна эвтектики, как правило, имеют пластинчатое строение.
Твёрдый раствор – это однофазная система, в которой один из компонентов образует собственную кристаллическую решётку, а второй присутствует в виде отдельных атомов, т.е. собственной кристаллической решётки не имеет. Первый компонент называют растворителем, а второй – растворенным компонентом. Обозначают α, β, γ и т.д. Иногда А(В) – означает компонент В растворен в решетке компонента А.
Различают твёрдые растворы внедрения и твёрдые растворы замещения.
Твёрдые растворы внедрения – атомы растворенного вещества находятся в порах кристаллической решетки основного компонента.
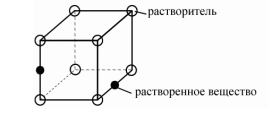
Особенности: 1) растворённые вещества должны иметь малый атомный радиус (обычно это неметалл);
2) ограниченная растворимость.
Твёрдые растворы замещения – атомы растворённого вещества замещают атомы растворителя в узлах кристаллической решётки.
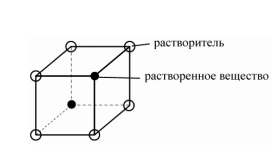
Особенности: 1) часто имеют неограниченную растворимость. При этом атомы растворённого элемента могут полностью заместить атомы растворителя, если выполняются следующие условия:
- компоненты изоморфны (т.е. имеют одинаковый тип кристаллической решётки);
- близкое значения размеров атомов;
- близкое строение валентных оболочек.
2) если эти условия не выполняются, то происходят большие искажения решетки и накопление упругой энергии. Решетка становится неустойчивой, и наступает предел растворимости;
3) многие твердые растворы замещения могут находиться в упорядоченном состоянии. При этом происходит изменение свойств: возрастают электропроводность, температурный коэффициент электрического сопротивления, твердость и прочность, снижается пластичность сплава.
Сплав – химическое соединение.
Химическое соединение образуется при определённом соотношении компонентов. Особенности: 1) они образуют новую кристаллическую решетку, отличную от решеток исходных элементов;
2) соотношение атомов элементов обычно описывается формулой Аn Bm (хотя могут иметь переменный состав);
3) обладают новыми свойствами;
4) имеют определенную температуру плавления (т.е. плавление происходит при постоянной температуре).
Роль размерного фактора – одно из условий неограниченной растворимости: чем больше различие в атомных радиусах, тем меньше растворимость.
Промежуточные фазы включают следующие разновидности:
-
Химические соединения с нормальной валентностью
Формулы соединений подчиняются правилам валентностям компонентов: NaCl, Mg2Si, AuA12. Эти химические соединения образуют кристаллическую решетку, отличную от решеток входящих в него компонентов, с наличием ионных связей. Такие химические соединения характеризуются почти полным отсутствием растворимости компонентов в твердом состоянии, то есть имеют постоянный состав.
-
Фазы внедрения
Фазы внедрения образуются путем соединения переходных металлов (Mo, W, Zr, Ті, Та, Pd, V, Nb) с углеродом, азотом, водородом и бором, в результате которого получаются карбиды, нитриды, гидриды и бориды металлов. В отличие от твёрдых растворов внедрения, фазы внедрения часто имеют кристаллические решётки, отличные от кристаллической решётки металла, на основе которого они образуются. Фазы внедрения имеют переменный состав. Фазы внедрения с одинаковым типом решеток могут образовывать непрерывные ряды твердых растворов, например, TiC-VC; TiC-NiN.
Соединения между металлами называют интерметаллидами. К интерметаллидам относят промежуточные фазы: электронные соединения, сигма-фазы и фазы Лавеса. Примеры интерметаллидов: СиА12, Mg5Al8, MgZn2 Mg2Cu, CaAl2, Al3Fe и другие.
-
Электронные соединения (фазы Юм-Розери)
Этот вид соединений образуется между двумя металлами из следующих групп: Cu, Ag, Au, Fe, Co, Ni, Pd, Pt с одной стороны и Be, Zn, Cd, Al, Sn, Si – с другой. Соединения эти характеризуются определённым отношением валентных электронов к числу атомов (3/2; 21/13 или 7/4), причём каждому отношению соответствует определённая кристаллическая решётка (таблица 1).
| Отношение электронов к числу атомов | Кристаллическая решётка |
| 3/2 | Объемно-центрированная ( 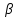 -фаза) -фаза) |
| 21/13 | Гранецентрированная ( 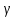 -фаза) -фаза) |
| 7/4 | Гексагональная ( 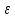 -фаза) -фаза) |
Таблица 1
В соединениях нет упорядоченного расположения атомов. При высоких температурах атомы обоих элементов часто не занимают определённых узлов в решётке, т.е. располагаются статистически. При понижении температуры до определённого значения происходит упорядочение, которое обычно не бывает полным. Этот вид соединений следует считать промежуточным между химическим соединением и твёрдым раствором.
-
Сигма-фазы
Сигма-фазы образуются при взаимодействии двух переходных металлов: Fe-Mo, Fe-W, Fe-Cr, Cr-Mn и других. Устойчивые сигма-фазы образуются, в основном, при разнице атомных размеров не более 8%. Химический состав сигма-фаз определяется стехиометрией AB (FeCr, FeV).
-
Фазы Лавеса
Фазы Лавеса являются фазами практически постоянного состава. Эти фазы образуются при большом различии (около 20 %) атомных диаметров компонентов. Их компоненты могут принадлежать к любой группе таблицы Менделеева. Стехиометрический состав фаз Лавеса описывается формулой АВ2: TiFe2, Mg2Cu, MgZn2, AgBe2.
-
Фазы вычитания
Фазы вычитанияпредставляют собой соединения, у которых соотношения долей атомов разного сорта составляет 1:1, однако позиции одного из компонентов в кристаллической решетке оказываются незанятыми (вакантными). Например, для вюстита (FeO) все кислородные позиции заняты, а некоторые железные — пустуют. Число вакансий не зависит от температуры, а определяется химическим составом сплава. Фазы вычитания могут быть образованы металлами и металлоидами, например, FeO, FeS, TiS, TiC, NbC, VC.
Вопрос 4. Диаграммы состояния сплавов. Принципы и методы построения диаграмм состояния двойных систем. Термические кривые для чистых сплавов и различных сплавов. Правило рычага. Различные виды диаграмм состояния и их анализ: с неограниченной растворимостью компонентов в твердом состоянии; с ограниченной растворимостью компонентов в твердом состоянии и наличием эвтектического или перитектического превращения; с отсутствием растворимости в твердом состоянии и наличием эвтектического превращения; с образованием промежуточной фазы и с перитектическим превращением; с полиморфным превращением компонентов при наличии эвтектоидного и перитектоидного превращения;