Файл: Научноисследовательская работа студентки 4 курса Направления подготовки 06. 03. 01 Биология Профиль Биохимия.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.12.2023
Просмотров: 192
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Уравнения кривой оксигенации гемоглобина
Определение параметров взаимодействия гемоглобина с протонами водорода (эффект Бора)
Определение начальных условий для распределения кислорода в гемоглобине
ГЛАВА 2 МЕХАНИЗМЫ РЕГУЛЯЦИИ СВЯЗЫВАНИЯ ГЕМОГЛОБИНА С КИСЛОРОДОМ
2.1. Модельные представления, используемые для описания взаимодействия гемоглобина с кислородом
2.2. Свободная энергия системы гемоглобин – лиганды
2.3. Описание неравновесных процессов взаимодействия гемоглобина с кислородом
Большое количество полученных в последние годы экспериментальных данных свидетельствует в пользу гетерогенности рецепторов АТ II, и в дальнейшем изложении будем исходить именно из этого предположения [379-382].
Полифункциональность АТ II и гетерогенность его рецепторов можно связать с молекулярной структурной организацией гормона, изученной теоретически. Его предрасположенность к реализации ряда функций проявляется в существовании в нативных условиях нескольких близких по энергии и легко переходящих друг в друга пространственных форм. Высокая эффективность и строгая избирательность взаимодействий АТ II с различными рецепторами связаны с тем, что каждая его функция реализуется посредством актуальной только для данного рецептора конформации из состава самых предпочтительных структур свободной молекулы. Таким образом, поиск структурно-функциональной организации АТ II сводится к выяснению для каждой биологической активности пептида актуальной конформации. Для решения задачи в условиях отсутствия необходимых данных о потенциальных поверхностях мест связывания требуется использование дополнительной информации. В качестве такой информации, как правило, привлекаются данные по биологической активности синтетических аналогов природных пептидов. Однако при формировании серии аналогов без предварительного изучения конформационных возможностей как природного пептида, так и его искусственных аналогов в ходе исследования по существу случайным образом ищется прямая зависимость между отдельными остатками аминокислотной последовательности гормона и его функциями.
Поскольку стимулированные гормоном аллостери-ческие эффекты возникают в результате не точечных, а множественных контактов между комплементарными друг другу потенциальными поверхностями лиганда и рецептора (иначе отсутствовала бы избирательность гормональных действий), нарушение функции при замене даже одного остатка может быть следствием ряда причин. К ним относятся исчезновение нужной функциональной группы, потеря необходимых динамических свойств актуальной конформации, запрещение последней из-за возникающих при замене остатков стерических напряжений, смещение конформационного равновесия из-за изменившихся условий взаимодействия с окружением и т.д.
Следовательно, случайная замена отдельных остатков не приводит к решению задачи структурно-функциональной организации гормонов. Об этом свидетельствует отсутствие в течение нескольких десятков лет заметного прогресса в ведущихся с привлечением множества синтетических аналогов исследованиях зависимости между структурой и функцией АТ II, энкефалинов и эндорфинов, брадикининпотенцирующих пептидов, а также ряда других. Отсюда следует неизбежный вывод о необходимости привлечения к изучению структурно-функциональных отношений у
пептидных гормонов специального подхода, который позволил бы отойти от метода проб и ошибок и при поиске синтетических аналогов делать сознательный выбор для их синтеза и биологических испытаний.
Следует напомнить, что транс-влияние определяется как эффект влияния транс-лиганда на скорость реакций. Так как скорости реакций связанх. с разностью в энергиях активации мен ду исходными соединениями и активированными комплексами, то из этого следует, что оба состояния долишы рассматриваться в теориях транс-влияиия. Поляризационная теория подчеркивает важность вклада основного состояния в скорость реакции, в то время как теория я-связывання в основном рассматривает переходное состояние. Р1екоторые трудности вызываются тем, что обе теории имеют дело с полными, а не со свободными энергиями. К сожалению, для тех комплексов Р1(П), для которых энергии активации были измерены, обнаружено, что высокие скорости реакций соответствуют низким энергиям активации. Однако следует иметь в виду, что использование только данных по скоростям реакций может привести к ошибочным выводам при сравнении энергетических теорий.
Взаимное отталкивание связанных лигандов, или их антикооперативное взаимодействие, также может иметь разную природу. Крупные лиганды могут контактировать только с одной или двумя парами оснований, но стерически препятствовать подходу других молекул лиганда к соседним местам связывания. Сближение лигандов при их связывании с соседними участками может быть просто термодинамически невыгодным. Чтобы получить представление о тех трудностях, с которыми приходится сталкиваться при более детальном анализе, рассмотрим связывание катионов. Такие лиганды при связывании с соседними участками будут отталкиваться друг от друга, но, кроме того, при этом изменится локальная противоионная атмосфера, так что электростатическая свободная энергия всего полимера будет иной, что необходимо учитывать при анализе экспериментов по связыванию.
2.3. Описание неравновесных процессов взаимодействия гемоглобина с кислородом
Неравновесные процессы, происходящие при взаимодействии гемоглобина с кислородом, описываются следующей системой уравнений:
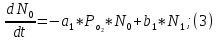
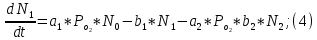
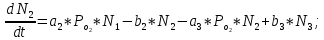
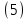
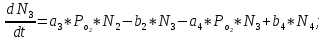
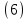
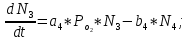
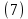
где
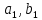 кинетические коэффициенты реакции присоединения и отсоединения кислорода от гемоглобина.
кинетические коэффициенты реакции присоединения и отсоединения кислорода от гемоглобина.В настоящее время детальный анализ системы уравнений, описывающей кинетику взаимодействия гемоглобина с кислородом, сделан лишь для случая стационарного состояния. Общая задача вычисления кинетических коэффициентов
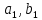 не решена. Обычно из экспериментальных данных определяют не восемь коэффициентов, а всего два. Эти параметры получаются 15 в случае рассмотрения реакции взаимодействия гемоглобина с кислородом как реакции первого порядка, то есть вычисляются некие усредненные по всем состояниям коэффициенты [a], [b].
не решена. Обычно из экспериментальных данных определяют не восемь коэффициентов, а всего два. Эти параметры получаются 15 в случае рассмотрения реакции взаимодействия гемоглобина с кислородом как реакции первого порядка, то есть вычисляются некие усредненные по всем состояниям коэффициенты [a], [b].Для того чтобы установить связь между кинетическими коэффициентами
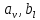 рассмотрим стационарное решение системы уравнений (9):
рассмотрим стационарное решение системы уравнений (9):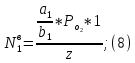
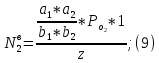
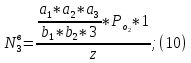
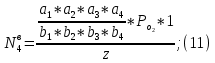
Где
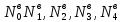 –
– 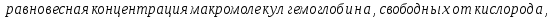
с одной, двумя, тремя, четырьмя молекулами кислорода соответственно
,
Z=1+
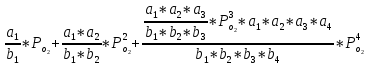 (12)
(12)Если сделать предположение, что процесс присоединения кислорода к гемоглобину определяется диффузией, то константа скорости ассоциации остаётся без изменений. Действительно, по данным [6] ни изменение pH, ни изменение температуры не влияет на скорость реакции соединения гемоглобина с кислородом, тогда как скорость реакций диссоциации возрастает при повышении температуры, а изменение концентрации протонов водорода влияет лишь в ограниченной зоне, между 5,5 и 7,5 pH
Исходя из вышесказанного, для описания кинетических уравнений примем все константы прямой реакции оксигенации одинаковыми:
(a)=
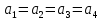 (13)
(13)Константы обратной реакции находятся из соотношения констант реакций (
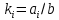 ) с коэффициентами Эйдера (8), которые были найдены раннее из термодинамической модели:
) с коэффициентами Эйдера (8), которые были найдены раннее из термодинамической модели: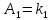 ,
, 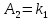 *
*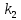 ,
, 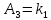 *
*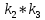 ,
, 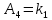 *
*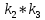 *
*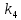 (14)
(14)На рисунке 13 показана зависимость степени заполнения гемоглобина кислородом в растворе от времени для процесса дезоксигенации. Точки экспериментальные данные работы [7] при различных начальных степенях заполнения гемоглобина кислородом. Описание экспериментальных данных наилучшим образом получилось при a=(4+1.2)*1
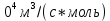 .
.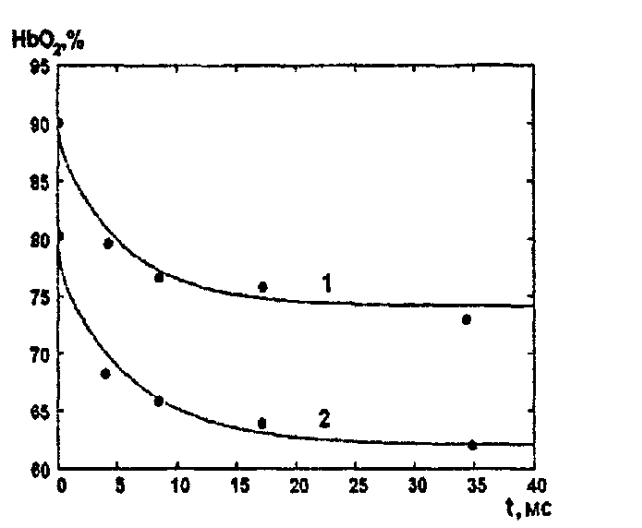
Рисунок 13 – Зависимость степени заполнения гемоглобина кислородом в растворе от времени для процесса дезоксигенации Точки экспериментальные данные [7]. Кривые моделирование. 1начальная степень заполнения гемоглобина кислородом 90%. 2 80%.
Таким образом, можно получить выражения для констант обратных реакций:
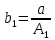 ,
, 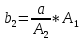 ,
, 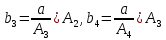 (15)
(15)Так как коэффициенты Эйлера зависят от различных физиологических условий, то и коэффициенты обратных реакций взаимодействия гемоглобина с кислородом также зависят от них. Экспериментальное изучение неравновесных процессов проведено в классической работе Мосшизуки [7]. Он разработал и применил весьма точный метод для измерения скорости реакций. Нами было проведено описание экспериментальных данных, по кинетике оксигенации гемоглобина, полученных этим автором. Для описания кинетики взаимодействия гемоглобина с кислородом численно решалась система уравнений (9). При описании кинетики присоединения кислорода к гемоглобину начальное распределение кислорода в гемоглобине рассчитывалось при некотором давлении
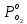 , соответствующем начальной степени заполнения гемоглобина кислородом. Затем система выводилась из состояния равновесия путем изменением давления с
, соответствующем начальной степени заполнения гемоглобина кислородом. Затем система выводилась из состояния равновесия путем изменением давления с 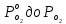 . Для процесса оксигенации гемоглобина
. Для процесса оксигенации гемоглобина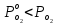 Для процесса дезоксигенации оксигемоглобина
Для процесса дезоксигенации оксигемоглобина 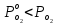
На рисунке 14 изображена Зависимость степени заполнения гемоглобина кислородом в эритроцитах от времени для процесса оксигенации при разных значениях кислотности. Коэффициент прямой реакции гемоглобина с кислородом оказался равным a=(1.1+0,3)*1
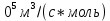 .
.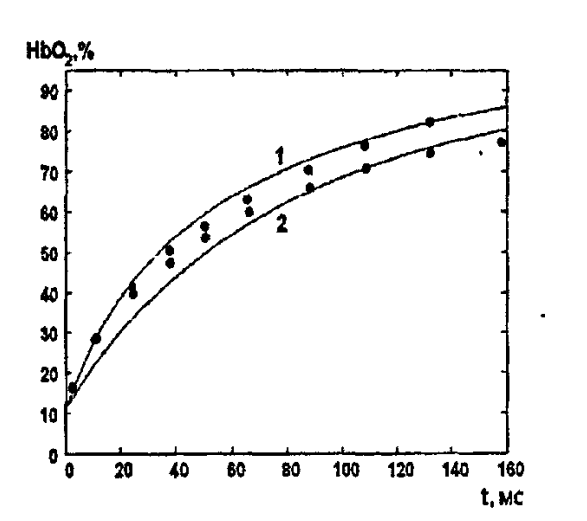
Рисунок 14 – Зависимость степени заполнения Отличие коэффициента прямой гемоглобина кислородом в эритроцитах от времени для процесса оксигенации.
При описании экспериментальных кривых, описывающих неравновесные процессы, подбирается только параметр а. Коэффициенты
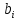 определялись из соотношений (13), а коэффициенты Эйдера были взяты из выражения (8).
определялись из соотношений (13), а коэффициенты Эйдера были взяты из выражения (8).