ВУЗ: Национальный исследовательский томский политехнический университет
Категория: Учебное пособие
Дисциплина: Химия
Добавлен: 09.02.2019
Просмотров: 10324
Скачиваний: 59
156
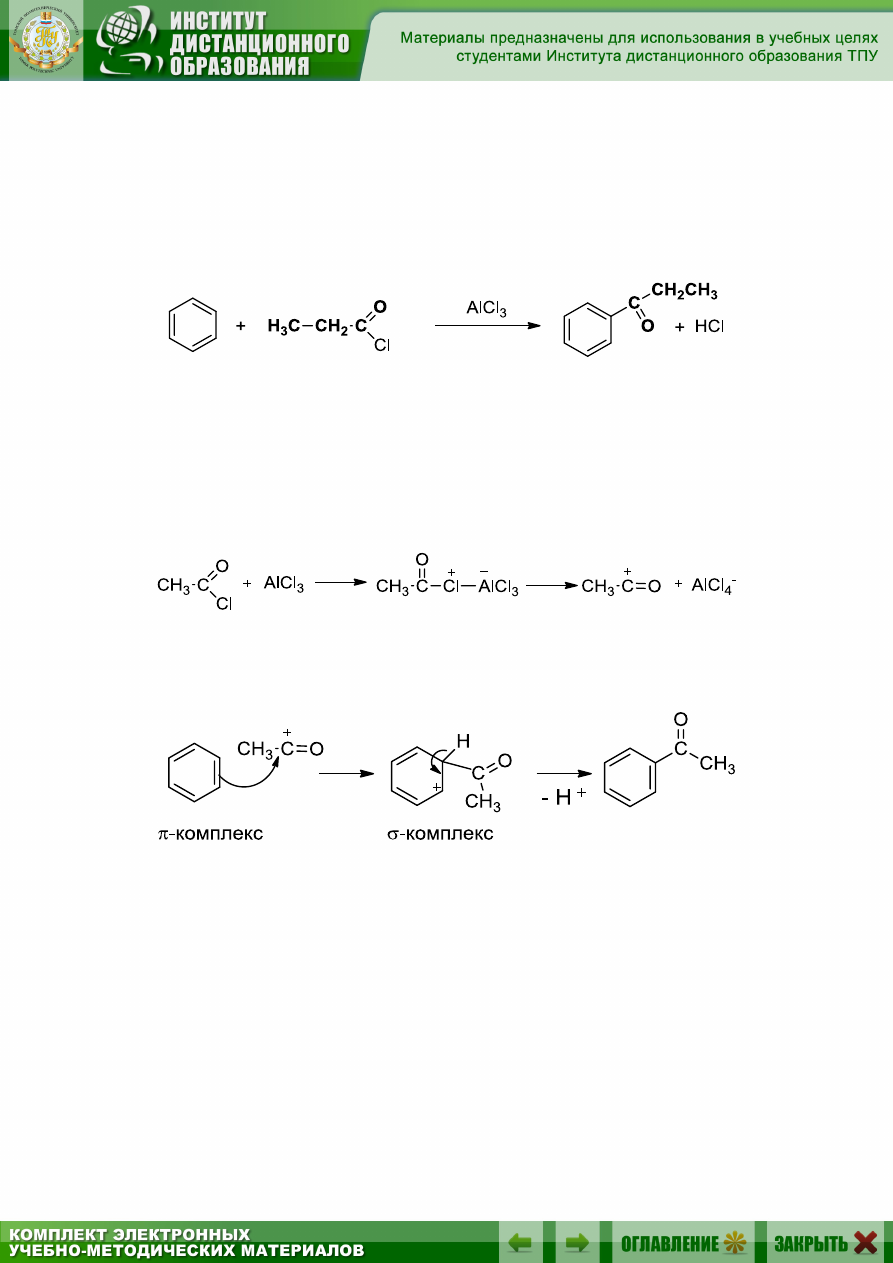
9.5.3.5. Ацилирование по Фриделю – Крафтсу
Реакция ацилирования представляет собой важнейший метод син-
теза ароматических кетонов путем замещения атома водорода в ядре на
ацильную группу RCO-. В качестве ацилирующих агентов используют
хлорангидриды RCOCl и ангидриды кислот (RCO)
2
O:
Ацилирование по Фриделю – Крафтсу осуществляется с участием
катализаторов – кислот Льюиса.
Начальная стадия реакции ацилирования состоит в образовании
комплекса между ацилгалогенидом и хлоридом алюминия. Затем этот
комплекс ионизирует с образованием ацилиевого иона RCO
+
.
1. Образование электрофила:
2. Атака бензольного кольца этим ацилий-катионом приводит к об-
разованию конечного продукта:
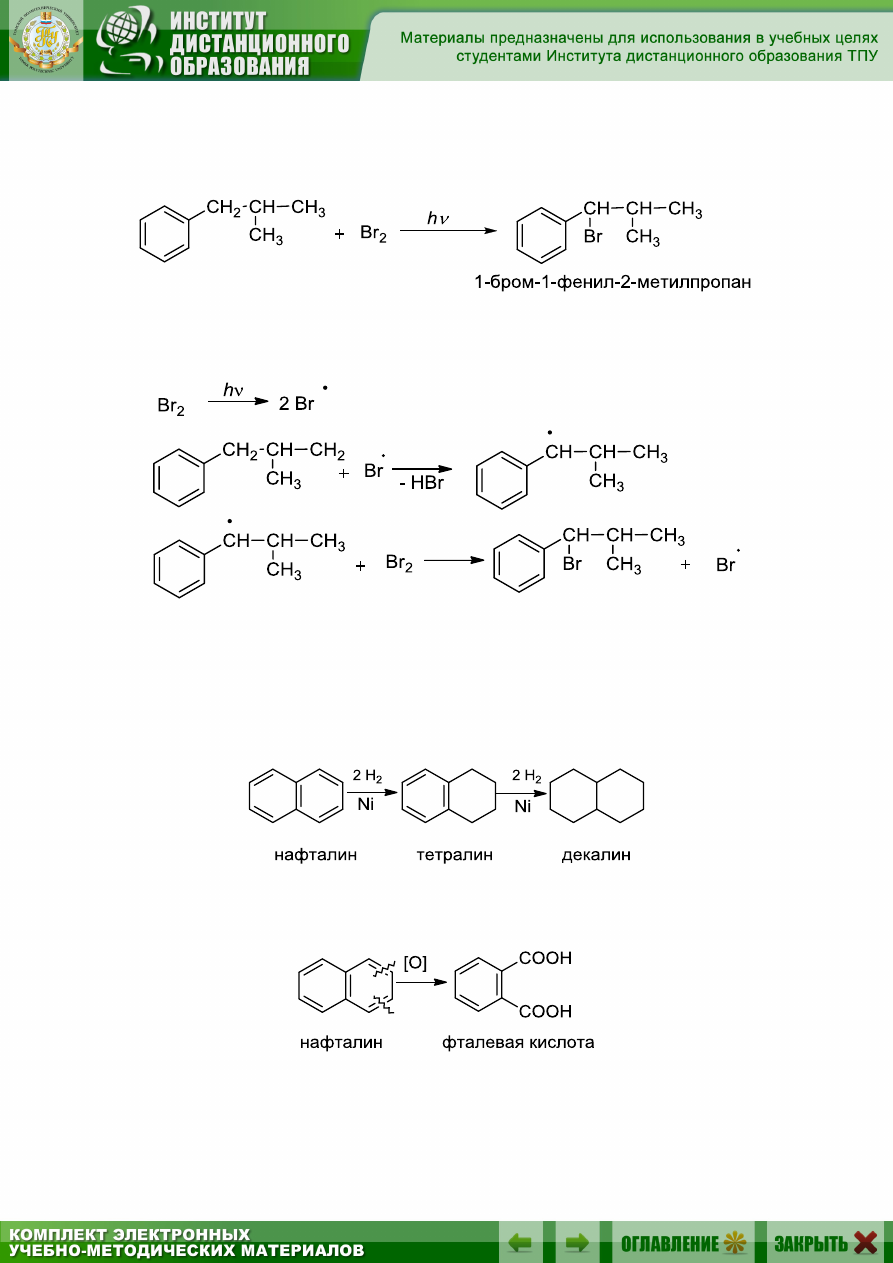
9.5.4. Радикальное замещение в боковую цепь. Галогенирование
Наряду с реакциями электрофильного замещения в ароматическом
ядре, для алкилбензолов характерны реакции в боковой цепи. Среди них
наиболее важная – галогенирование. Эта реакция протекает по цепному
механизму, как и радикальное галогенирование алканов, и включает
стадии инициирования, роста и обрыва цепи. Для инициирования обра-
157
зования радикальных частиц используется ультрафиолетовое облучение
или высокие температуры. (Более подробно см. гл. 5), например:
Механизм S
R
:
Реакции полициклических аренов
1. Гидрирование (разд. 9.5.5):
2. Окисление (разд. 9.5.6):
158
3. Электрофильное замещение (разд. 9.5.7):
9.5.5. Гидрирование
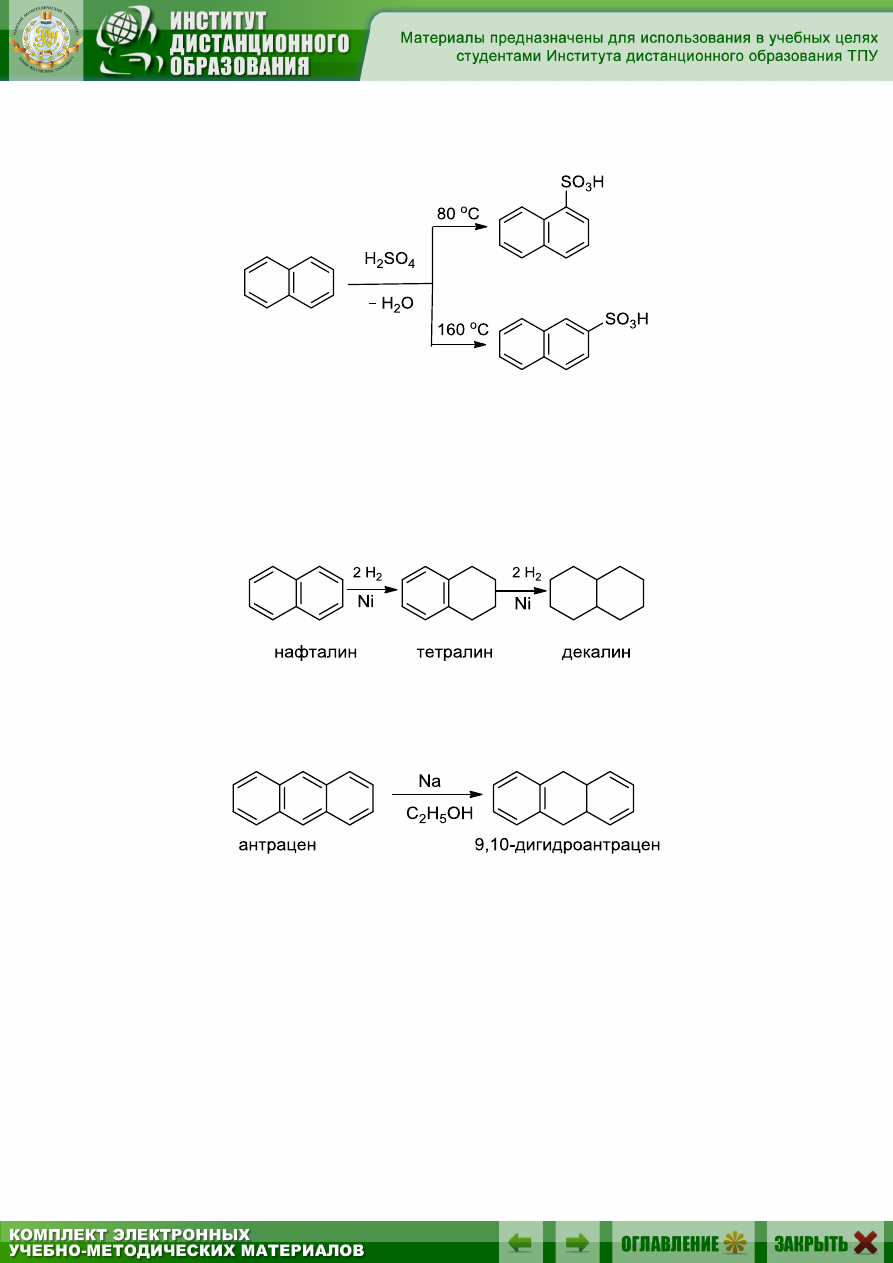
Нафталин легче, чем бензол, вступает в реакцию с водородом, при-
чем сначала гидрируется одно ядро (160 °С) и образуется тетрагидро-
нафталин – тетралин, при повышении температуры до 200 °С конеч-
ным продуктом гидрирования является декагидронафталин – декалин:
Антрацен легко гидрируется в положения 9 и 10 водородом в мо-
мент выделения, например, натрием в кипящем спирте:
При исчерпывающем каталитическом гидрировании образуется
пергидроантрацен C
14
H
24
.
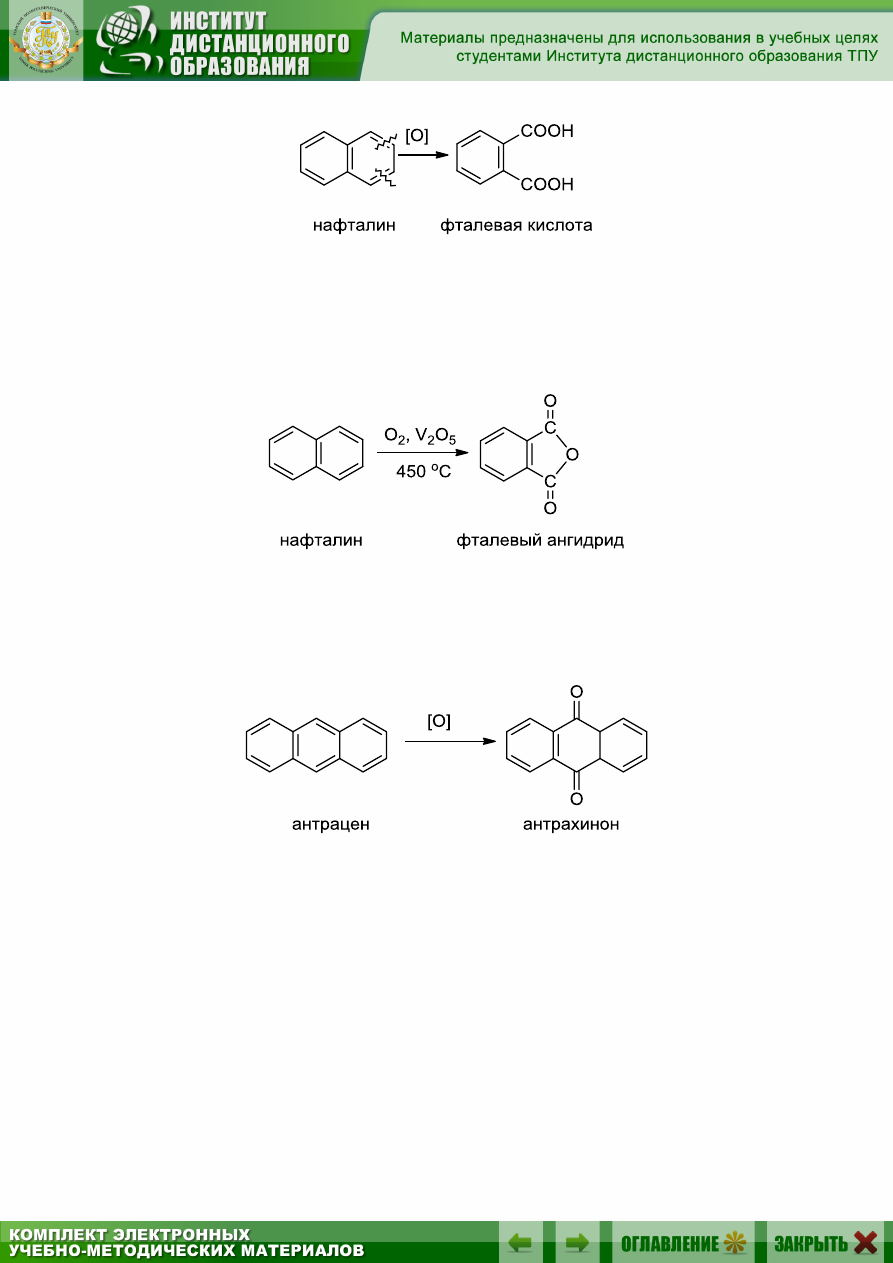
9.5.6. Окисление
Нафталин окисляется легче, чем бензол, при этом одно из бензоль-
ных ядер разрушается, а его
-углеродные атомы превращаются в кар-
боксильные группы и образуется дикарбоновая, фталевая кислота:
159
В промышленном масштабе реакцию проводят, окисляя нафталин
кислородом воздуха в присутствии пятиокиси ванадия при 450 °С. По-
лучается фталевый ангидрид, т.к. фталевая кислота в условиях реакции
теряет воду:
Окисление антрацена хромовой смесью и другими окислителями
приводит к образованию ценного полупродукта в химии красителей,
антрахинона:
9.5.7. Электрофильное замещение
Полициклические арены вступают в те же реакции электрофильного
замещения, что и моноциклические, но они являются более активными.
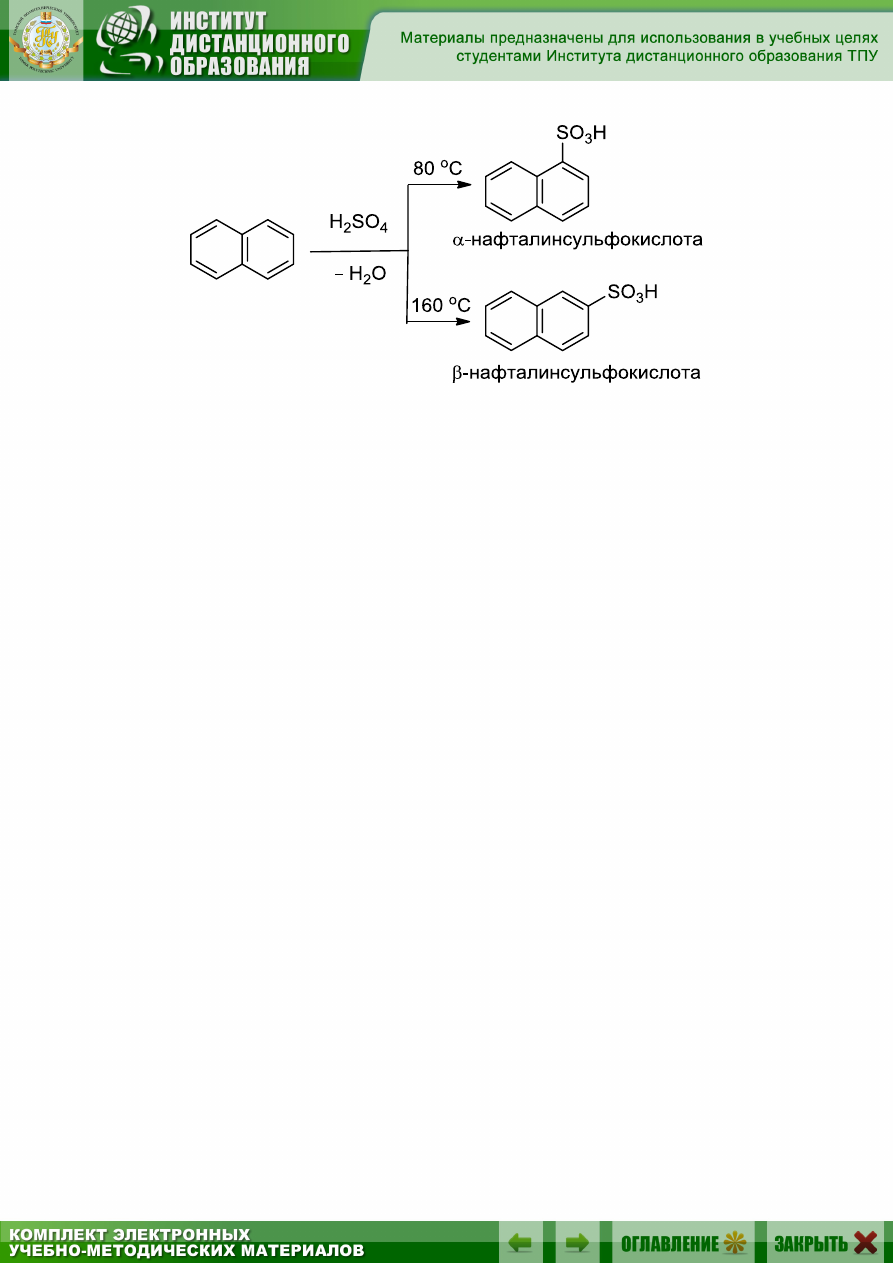
Сульфирование – одна из характерных реакций замещения для
нафталина, причем, в зависимости от условий реакции, может быть по-
лучена как
-нафталинсульфокислота, так и
-нафталинсульфокислота:
160
-Нафталинсульфокислота превращается при нагревании до 160 °С
в
-изомер, т.е. последний изомер термодинамически более стабилен.
Однако
-изомер образуется быстрее, т.к. имеет более низкую энергию
активации. В данном случае мы имеем пример кинетического и термо-
динамического контроля реакции. (См. также гл. 7.)
Сходным образом реакции галогенирования, нитрования, ацетили-
рования нафталина в первую очередь затрагивают
-положение.
9.6. Влияние заместителей на электрофильное замещение
в ароматическом ряду
Каждый имеющийся в кольце заместитель влияет на дальнейшее
протекание электрофильного замещения. Это влияние находит выраже-
ние в двух явлениях:
в общем увеличении или уменьшении скорости замещения (ре-
акционная способность);
в направлении вступающих заместителей в определенные поло-
жения относительно уже имеющегося заместителя (ориентация).
Реакционная способность
Реакция электрофильного замещения в ароматическом ряду проте-
кает через промежуточное образование
-комплекса. Поэтому замести-
тели, которые стабилизируют этот интермедиат (электронодоноры) бу-
дут повышать скорость данной конкретной реакции замещения. И, на-
оборот, заместители, дестабилизирующие
-комплекс (электроноакцеп-
торы), будут снижать скорость реакции. Таким образом, заместители,
имеющиеся в бензольном кольце, можно разделить на две группы: ак-
тивирующие и дезактивирующие кольцо по отношению к электрофиль-
ному замещению (табл. 9.1).