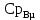ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.01.2024
Просмотров: 265
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Давление в колонне атмосферное. В качестве греющего теплоносителя в испарителе колонны применяется пар, для получения которого устанавливается котел. Конденсат от испарителя колонны, имеющий высокую температуру, используется на собственные нужды предприятия. В первом подогревателе исходной смеси теплоносителем являются кубовые остатки. Во втором подогревателе исходной смеси в качестве теплоносителя, так же как и в испарителе, применяется пар. В качестве низкотемпературного теплоносителя для конденсатора ‒ дефлегматора и холодильника готового продукта используется охлаждающая вода.
2 Материальный баланс установки
Введем обозначения:
GР, XР–поток и концентрация НК дистиллята;
Gw, Xw – поток и концентрация НК кубового остатка;
Gf, Xf– поток и концентрация НК флегмы;
Gv – количество пара, выходящего из колонны.
Материальный баланс по всему потоку, кг/с:
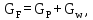 | (2.1) |
Материальный баланс по низкокипящему компоненту, кг/с:
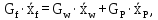 | (2.2) |
Массовая концентрация НКК в исходной смеси:
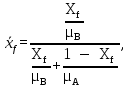 | (2.3) |
где μА и μБ – молекулярная масса компонентов (µH2O=18 кг/кмоль, µСH3COOH=60 кг/кмоль).
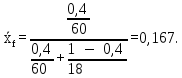
Массовая концентрация НКК в кубовом остатке:
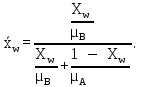 | (2.4) |
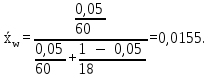
Массовая концентрация НКК в дистилляте:
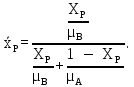 | (2.5) |
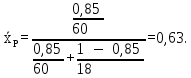
Составим систему уравнений:
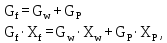
Решая получившуюся систему уравнений получим:
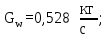
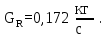
3 Конструкторский и тепловой расчёт колонны
3.1 Определение числа тарелок
3.1.1 Построение диаграммы фазового равновесия y=f(x)
На диаграмму наносятся температуры кипения чистых компонентов. Сведем в таблицу 3.1 физико ‒ химические свойства воды и уксусной кислоты при 110
°С.
Таблица 3.1 ‒ Физико ‒ химические свойства воды и бутилового спирта
| Вещество | tн, оС | Cp (110 °С), кДж/кг·К | r(110 °С), кДж/кг | ВКК/НКК | А/В | µ, кг/кмоль |
| Вода | 100 | 4,23 | 2234 | НКК | А | 18 |
| Уксусная кислота | 118,1 | 2,48 | 390 | ВКК | В | 60 |
Парциальное давление пара каждого компонента идеальных смесей зависит от температуры и содержания данного компонента и пропорционально молярной доле данного компонента в смеси. Это соотношение называется законом Рауля и может быть математически выражено следующим образом:
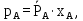 | (3.1) |
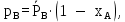 | (3.2) |
где
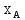 – молярная доля компонента А в жидкости;
– молярная доля компонента А в жидкости; 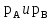 – парциальные давления паров компонента А и компонента В над смесью, МПа;
– парциальные давления паров компонента А и компонента В над смесью, МПа; 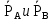 ‒ давления насыщения паров компонентов А и В при данной температуре. Тогда молярная доля компонента В в жидкой смеси будет
‒ давления насыщения паров компонентов А и В при данной температуре. Тогда молярная доля компонента В в жидкой смеси будет 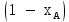 .
.Полное (общее) давление пара над жидкостью Робщ равно сумме парциальных давлений компонентов:
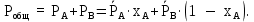 | (3.3) |
В то же время парциальные давления компонентов в системе следуют закону Дальтона:
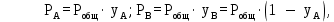 | (3.4) |
где yв– концентрация ВКК в паровой фазе; Робщ – атмосферное давление, равное 0,1 МПА
Для установившегося равновесия:
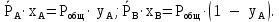 | (3.5) |
Откуда
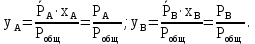 | (3.6) |
Окончательные уравнения:
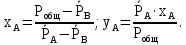 | (3.7) |
Величину давления насыщения компонентов А и В в зависимости от температуры находят по уравнению Антуана:
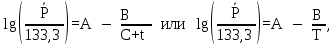 | (3.8) |
где А, В, С – некоторые числа для данных веществ; t – температура насыщения компонента смеси, оC.
Выражаем давления насыщения паров компонентов А и В:
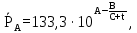 | (3.9) |
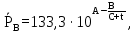 | (3.10) |
Задаваясь значением температур в промежутке от tА до tВ, из уравнения Антуана определяют давления насыщения высококипящего компонента при данных температурах. Данные сведем в таблицу 3.2.
Таблица 3.2 ‒ Давление паров воды и уксусной кислоты в зависимости от
температуры
| Жидкость | Уравнение | Интервал температур, оС | А | В | С | |
| Вода | 2.9 | 0 | 100 | 8,07414 | 1733 | 233,84 |
| Уксусная кислота | 2.9 | 16,4 | 118 | 7,55716 | 1642,54 | 233,39 |
Приведем пример расчета для температуры 104 оС:
Давление насыщения паров компонента А при 100 оС:
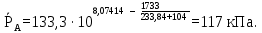
Давление насыщения паров компонента В при 100 оС:
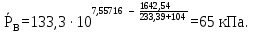
Концентрация НКК в жидкой фазе:
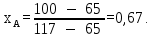
Концентрация ВКК в паровой фазе:
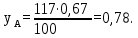
Остальные расчеты выполняем аналогично. Результаты сведены в таблицу 3.3.
Таблица 3.3 ‒ Данные для построения диаграммы фазового равновесия у=f(x) и t=f(x,y)
| t, оС | 100 | 104 | 108 | 112 | 116 | 118,1 |
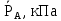 | 100,0 | 117,3 | 134,7 | 154,2 | 175,9 | 188,3 |
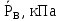 | 56,9 | 65,1 | 74,2 | 84,4 | 95,7 | 100,0 |
| xA | 1 | 0,668 | 0,426 | 0,224 | 0,054 | 0 |
| yA | 1 | 0,784 | 0,574 | 0,345 | 0,095 | 0 |
Построение диаграммы фазового равновесия смеси вода – уксусная кислота представлено на рисунке 3.1
3.1.2 Построение диаграммы фазового равновесия t=f(x,y)
Равновесные (сопряженные) концентрации компонента А в жидкой и газообразных фазах находятся на изотерме, пересекающей соответствующие линии кипения и конденсации, поэтому берутся эти значения (xi и yi) из таблицы 3.3 и наносятся на диаграмму в координатах t=f(x,y) (рисунок 3.2).
3.1.3 Построение диаграммы фазового равновесия h=f(x,y)
Построение кривых рабочих линий сопряжено с большими трудностями: здесь необходимо учитывать энтальпии пара и энтальпии жидкости с изменением этих свойств.
Изобарная мольная теплоемкость смеси:
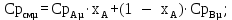 (3.11)
(3.11)где
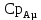 и
и