ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.07.2024
Просмотров: 131
Скачиваний: 0
СОДЕРЖАНИЕ
1.Классификация и номенклатура ферментов
4) Структура белковой молекулы
8)Биосинтез холерестерина и его биологическая роль.
10) .Роль желчных кислот, переваривание липидов
11) Характеристика гормонов поджелудочной железы
15) Характеристика витаминов(в2 и в5)
19)Ферменты биологического окисления
20)Взаимосвязь аминоуглеводов с обменом липидов
23) Факторы, влияющие на скорость ферментативных реакций
1.Классификация и номенклатура ферментов
А. Рабочее название Б. Классы ферментов
Каждый класс состоит из многочисленных подклассов и подподклассов с учётом преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из 6 классов имеет свой порядковый номер, строго закреплённый за ним.
1. Оксидоредукпшзы
Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой).
Систематическое наименование ферментов составляют по формуле "донор: акцептороксидоредуктаза", рабочее - субстрат-подкласс оксидоредуктаз.
Дегидрогеназы. В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN (см. ниже). Все ферменты этой группы обладают высокой субстратной специфичностью. Пример реакции:
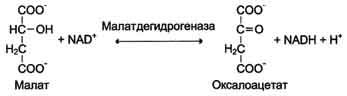
Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
![]()
Оксигеназы (гидроксилазы) - атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции:
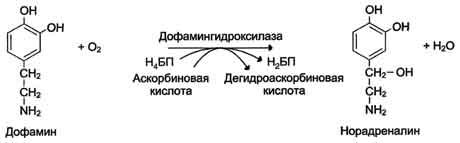
2.Трансферты.Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы.
Название этих ферментов составляют по формуле "донор: ацетрофэкспортируемая группатрансфераза". К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтранс-феразы, гликозилтрансферазы, киназы (фосфо-трансферазы). Примеры реакций (см. схему А).
3.ГидролазыКатализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи.
Наименование ферментов составляют по формуле "субстрат-гидролаза" или прямым присоединением к названию субстрата суффикса "аза", например протеаза, липаза, фосфолипаза, рибо-нуклеаза. Пример реакции (см. схему Б).
Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определённой химической связи: эстеразы, фосфатазы и др.
4. Лиазы. К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
Наименование ферментов составляют по формуле "субстрат-отщепляемая или присоединяемая группировка". Примеры реакций (см. схему В).
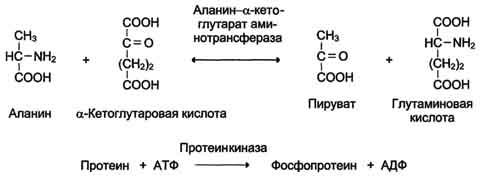
Схема А
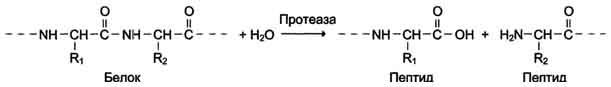
Схема Б
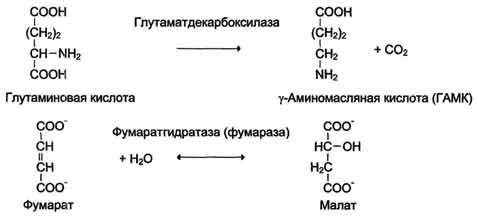
Схема В
5. Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
Как общее название ферментов этого класса применяют термин "изомеразы", например (см. схему А).
Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы (см. схему Б).
Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют "мутазой", например (см. схему В).
6. Лигазы (синтетазы)
Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют ли-газами, или синтетазами (см. схему Г).

Схема А
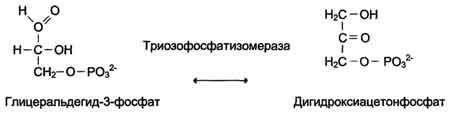
Схема Б
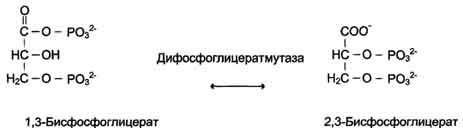
Схема В
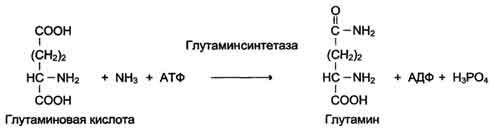
Схема Г
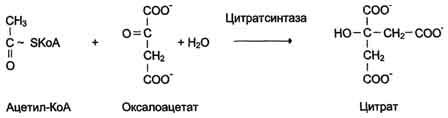
Схема
В. Систематическое название
В соответствии с классификацией каждый фермент получил систематическое название, однозначно характеризующее катализируемую им химическую реакцию. Например, D-глицеральдегид-3-фосфат: NAD-оксидоредуктаза (рабочее название - глицеральдегидфосфат дегидрогеназа). Из названия фермента следует, что субстратом этого фермента служит D-глицеральдегид-3-фосфат, тип катализируемой реакции - окислительно-восстановительная в присутствии кофермента NAD+.
2)ГЛИКОЛИЗ (от греч. glykys-сладкий и lysis - разложение, растворение, распад), анаэробное (без участия О2) негидролитич. расщепление углеводов (гл. обр. глюкозы) в цитоплазме под действием ферментов, сопровождающееся синтезом АТФ и заканчивающееся образованием молочной к-ты (см. рис.). Гликолиз одной молекулы глюкозы м. б. выражен след. ур-нием:
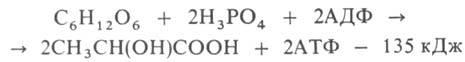
где АДФ-аденозиндифосфат. Субстратами гликолиза кроме глюкозы м. б. другие моносахариды, а также полисахариды. В мышечной ткани, где основной субстрат гликолиза-гликоген, процесс начинается с р-ции I и наз. гликогенолизом. У растений субстратом для гликолиза может служить крахмал. Первые этапы гликолиза, спиртового и нек-рых. др. видов брожениясходны.
Стадии,
в к-рых осуществляются необратимые
р-ции (II-IV), играют существ. роль в регуляции
скорости гликолиза. Наиб. важный
регуляторный фермент-фосфофруктокиназа,
катализирующая р-цию III;
ее активность ингибируется АТФ,
НАДН, лимонной и жирными к-тами,
стимулируется АДФ и АМФ.
Р-ции II и IV катализируются
соотв. гексокиназой ипируваткиназой, активность к-рых
регулируется адениловыми нуклеотидами,
промежуточными продуктами гликолиза
и цикла трикарбоновых к-т. У животных и
человека в регуляции гликолиза принимают
участие также гормоны.
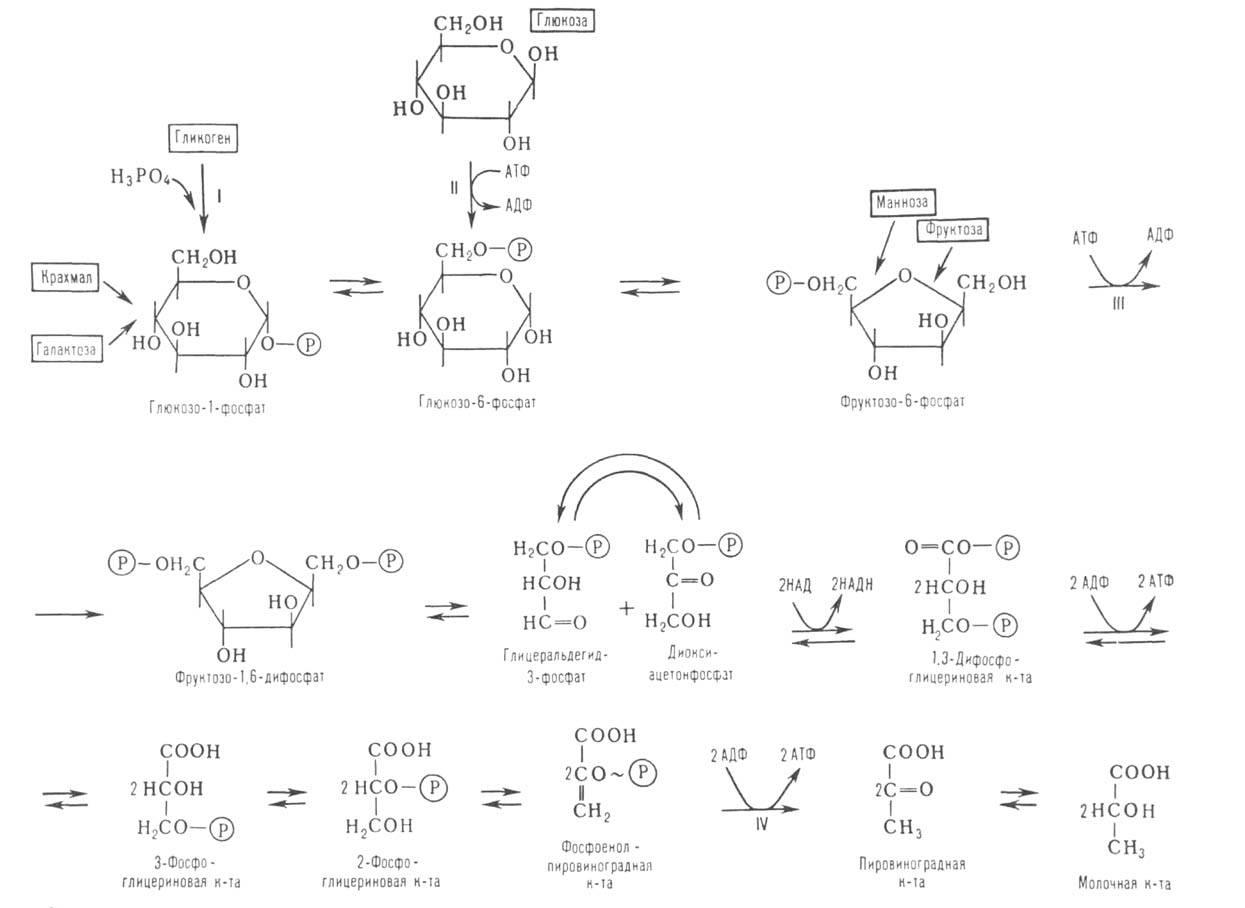
Схема гликолиза. В одинарных рамках-субстраты гликолиза, АТФ -аденозинтрифосфат, АДФ-аденозиндифосфат, НАДН и НАД-соотв. восстановленная и окисленная формы никотинамидадениндинуклеотида, Р-остаток фосфорной к-ты, ~ -высокоэргич. связь.
В условиях недостаточности кислорода гликолиз-единств. процесс, поставляющий энергию для осуществления физиол. ф-ций организма. В аэробных условиях гликолиз-первая стадия окислит. превращения углеводов: в присут. О2 пировиноградная к-та может подвергаться дальше окислит. декарбоксилированию, а образующаяся уксусная к-та в виде СН3С(О)КоА (КоА-остаток кофермента А) полностью окисляться до СО2 и воды в цикле трикарбоновых к-т.
Интенсивный гликолиз происходит в скелетных мышцах, где он поставляет энергию для мышечных сокращений, а также в печени, сердце, мозге животных и человека. В клеткахосуществляется тонкая регуляция окислит. и анаэробного обмена. Подавление гликолиза дыханием в присут. О2 (эффект П а с т е р а) обеспечивает клетке Наиб. экономный механизм образования богатых энергией соединений. В тканях, где такой эффект отсутствует (напр., в эмбриональных и опухолевых), гликолиз протекает очень активно. В нек-рых тканях с интенсивным гликолизом наблюдается подавление тканевого дыхания (эффект Крабтри).
Гликолиз-простейшая форма биол. механизма аккумулирования энергии углеводов в АТФ. Считают, что он возник в период, когда в атмосфере Земли не было О2. При энергетически более выгодном аэробном окислении из одной молекулы глюкозы образуется 38 молекул АТФ.
4) Структура белковой молекулы
Структура белковой молекулы — сложная пространственная структура, обладающая первичным, вторичным, третичным и четвертичным уровнями организации. Особенности структурной организации белковой молекулы определяются первичным уровнем ее организации.
Первичная структура белковой молекулы — полипептидная цепь с линейной последовательностью аминокислот, связанных между собой за счет пептидной связи. Первичная структура белка наиболее прочная из всех. В отношении всех свойств, которыми будет обладать белковая молекула, эта структура является определяющей. Все остальные структурные уровни организации образуются в соответствии с особенностями строения первичного уровня по принципу самосборки. Внешние факторы не оказывают влияния на этот процесс.
Вторичная структура белковой молекулы — структура белковой молекулы, образующаяся за счет скручивания линейной последовательности аминокислот первичной структуры с образованием спирали, многочисленные витки которой связаны между собой водородными связями.
Третичная структура белковой молекулы — структура белковой молекулы, образующаяся за счет наложения одних частей спирали белковой молекулы на другие, формирования между этими частями различного рода связей: водородных ковалентных ионных, дисульфидных (при наличии аминокислоты цистеин), гидрофобных. Третичная структура имеет вид глобулы.
При третичном уровне организации белковой молекулы возможность принимать участие в химических реакциях, проявлять химическую активность остается только у тех аминокислотных остатков, которые имеют поверхностное расположение.
Четвертичная структура белковой молекулы — структура белковой молекулы, представляющая собой сложную пространственную организацию нескольких полипептидных цепей, связанных между собой за счет различных химических связей. Эти связи аналогичны таковым в третичном уровне организации белковой молекулы. Полипептидные цепи, принимающие участие в образовании четвертичной структуры белковой молекулы, могут быть одинаковыми или иметь различное строение.
8)Биосинтез холерестерина и его биологическая роль.
Биосинтез холерестерина начинается с конденсации 3.м ацетила
Биологическая роль.
¾ синтезируемого х.используется на синтез желчных кислот
Для синтеза витамина д
Для синтеза стероидных гормонов (коркового надпочечников)
Для синтеза половых органов