ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.07.2024
Просмотров: 121
Скачиваний: 0
СОДЕРЖАНИЕ
1.Классификация и номенклатура ферментов
4) Структура белковой молекулы
8)Биосинтез холерестерина и его биологическая роль.
10) .Роль желчных кислот, переваривание липидов
11) Характеристика гормонов поджелудочной железы
15) Характеристика витаминов(в2 и в5)
19)Ферменты биологического окисления
20)Взаимосвязь аминоуглеводов с обменом липидов
23) Факторы, влияющие на скорость ферментативных реакций
20)Взаимосвязь аминоуглеводов с обменом липидов
СВЯЗЬ МЕЖДУ ОБМЕНОМ БЕЛКОВ И УГЛЕВОДОВ
В процессе распада углеводов образуются кетокислоты, которые могут подвергаться аминированию или переаминированию и дать соответствующие a-аминокислоты - структурные элементы белков. Например, путем аминирования или переаминирования пировиноградная кислота, являющаяся продуктом распада углеводов, может превратиться в аминокислоту -аланин. Кроме того, пировиноградная кислота в результате дальнейших превращений дает щавелевоуксусную (СООН—СН2—СО—СООН) и a-кетоглютаровую (СООН—СН2—СН2—СО—СООН) кислоты, из которых путем реакции аминирования и переаминирования соответственно образуются аспарагиновая и глютаминовая аминокислоты.
И наоборот, углеводы в животном организме могут синтезироваться из продуктов окисления белков. Углеводы образуются из тех аминокислот, которые при своем дезаминировании превращаются в кетокислоты.
СВЯЗЬ МЕЖДУ ОБМЕНОМ УГЛЕВОДОВ И ЖИРОВ
Единство в обмене углеводов и жиров доказывается возникновением общих промежуточных продуктов распада. При распаде углеводов образуется пировиноградная кислота, а из нее -активная уксусная кислота -ацетил-КоА, который может быть использован в синтезе жирных кислот. Последние при своем распаде дают ацетил-КоА. Для синтеза нейтрального жира необходим кроме жирных кислот и глицерин. Глицерин также может синтезироваться из продуктов распада углеводов, а именно, из фосфоглицеринового альдегида и фосфодиоксиацетона. И наоборот, при распаде глицерина могут образовываться фосфотриозы
21)гликогенолиз. Известно, что фосфоролитический распад играет ключевую роль в мобилизации полисахаридов.
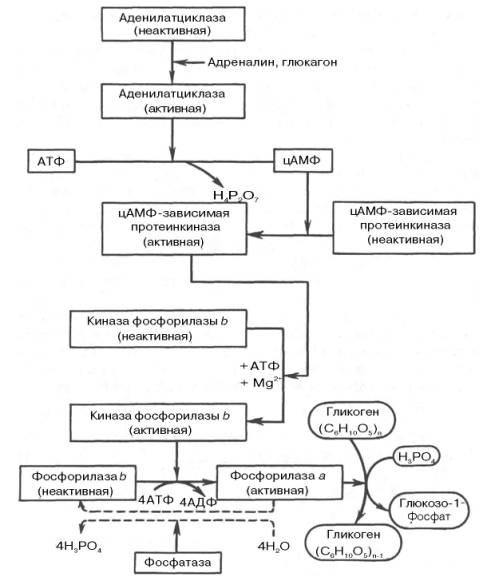
Рис. 10.1. Гормональная регуляция фосфоролитического отщепления остатка глюкозы от гликогена.
Фосфорилазы переводят полисахариды (в частности, гликоген) из запасной формы в метаболически активную форму; в присутствии фосфо-рилазы гликоген распадается с образованием фосфорного эфира глюкозы(глюкозо-1-фосфата) без предварительного расщепления на более крупные обломки молекулы полисахарида. В общей форме эту реакцию можно представить в следующем виде:
(C6H10O5)n+ H3PO4–> (C6H10O5)n–1+ Глюкозо-1-фосфат,
где (С6Н10О5)n означает полисахаридную цепь гликогена, а (С6Н10О5)n,– ту же цепь, но укороченную на один глюкозный остаток.
На рис. 10.1 изображены процесс распада гликогена до глюкозо-1-фосфата и участие в этом процессе цАМФ.Фермент фосфорилаза существует в двух формах, одна из которых (фосфорилаза а) активна, в то время как другая (фосфорилаза b) обычно неактивна. Обе формы могут диссоциировать на субъединицы. Фосфорилаза b состоит из двух субъединиц, а фосфорилаза а – из четырех. Превращение фосфо-рилазы b в фосфорилазу а осуществляется фосфорилированием белка:
2 Фосфорилаза b + 4 АТФ –> Фосфорилаза а + 4 АДФ.
Катализируется эта реакция ферментом, который называется киназой фосфорилазы b. Установлено, что эта киназа может существовать как в активной, так и в неактивной форме. Неактивная киназа фосфорилазы превращается в активную под влиянием фермента протеинкиназы (киназа киназы фосфорилазы), и не простопротеинкиназы, а цАМФ-зависимой протеинкиназы.
Активная форма последней образуется при участии цАМФ, которая в свою очередь образуется из АТФ под действием фермента аденилатцик-лазы, стимулируемой, в частности, адреналином и глюкагоном. Увеличение содержания адреналина в крови приводит в этой сложной цепи реакций к превращению фосфорилазы b в фосфорилазу а и, следовательно, к освобождению глюкозы в виде глюкозо-1-фосфата из запасного полисахарида гликогена. Обратное превращение фосфорилазы а в фосфорилазу b катализируетсяферментом фосфатазой (эта реакция практически необратима).
Образовавшийся в результате фосфоролитического распада гликогена глюкозо-1-фосфат превращается под действием фосфоглюкомутазы в глюкозо-6-фосфат. Для осуществления данной реакции необходима фосфо-рилированная форма фосфоглюкомутазы, т.е. ее активная форма, которая образуется, как отмечалось, в присутствии глюкозо-1,6-бисфосфата .

Образование свободной глюкозы из глюкозо-6-фосфата в печени происходит под влиянием глюкозо-6-фосфатазы. Данный фермент катализирует гидролитическое отщепление фосфата:
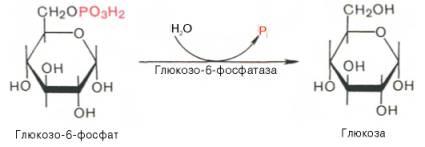

Рис. 10.2. Распад и синтез гликогена (схема).
Жирными стрелками указан путь распада, тонкими - путь синтеза. Цифрами обозначены ферменты: 1 - фосфорилаза; 2 - фос-фоглюкомутаза; 3 - глюкозо-6-фосфатаза; 4 - гексокиназа (глюкокиназа); 5 - глюко-зо-1-фосфат-уридилтрансфераза; 6 - глико-генсинтаза.
Заметим, что фосфорилированная глюкоза в противоположность неэте-рифицированной глюкозе не может легко диффундировать из клеток. Печень содержит гидролитический фермент глюкозо-6-фосфатазу, который и обеспечивает возможность быстрого выхода глюкозы из этого органа. В мышечной ткани глюкозо-6-фосфатаза практически отсутствует.
На рис. 10.2 отражены представления о путях распада и синтеза гликогена в печени.
Можно считать, что сохранение постоянства концентрации глюкозы в крови является результатом одновременного протекания двух процессов: поступления глюкозы в кровь из печени и потребления ее изкрови тканями, где она используется в первую очередь как энергетический материал.
В тканях (в том числе в печени) распад глюкозы происходит двумя основными путями: анаэробным (при отсутствии кислорода) и аэробным, для осуществления которого необходим кислород.
23) Факторы, влияющие на скорость ферментативных реакций
Так же как и скорость любых химических превращений, скорость ферментативных реакций зависит от многих факторов. Основными из них являются следующие – время протекания ферментативной реакции (время инкубации),
температура и рН окружающей среды, присутствие особых веществ – модификаторов фермента (ингибиторов и активаторов). Рассмотрим влияние перечисленных факторов на скорость ферментативных реакций.Время протекания. По мере того, как время инкубации фермента увеличивается, скорость реакции снижается. Это может происходить по различным причинам, главными из которых являются: уменьшение концентрации субстрата, увеличение скорости обратной реакции (в результате накопления продукта),
ингибирование фермента продуктом реакции, денатурация фермента. При кинетических исследованиях проводят измерения начальной скорости реакции.
Температура. Согласно правилу Вант-Гоффа для химических реакций повышение температуры на 10°С приводит к увеличению скорости реакции в 2–4 раза. Скорость ферментативной реакции с повышением температуры увеличивается, достигая максимума при какой-то оптимальной температуре (температурный оптимум фермента), а затем падает до нуля (рис. 12 а). Следует заметить, что температурный коэффициент увеличения скорости для ферментативных реакций меньше, чем для обычных химических реакций: при увеличении температуры на каждые 10°С скорость возрастает не более в два раза. Снижение скорости реакции до нуля вызвано инактивацией фермента
вследствие денатурации его белковой части. Большинство ферментов инактивируются при температурах 40–50°С. Отдельные ферменты инактивируются при температурах, близких к 0°С. Высокой термостабильностью отличаются
ферменты, являющиеся гликопротеинами, поскольку углеводный фрагмент придает белку термоустойчивость. Такие ферменты работают в микроорганизмах, обитающих в горячих источниках.
Влияние температуры на скорость ферментативных реакций очень важно для понимания процессов жизнедеятельности. При понижении температуры некоторые животные впадают в состояние анабиоза за счет снижения скорости ферментативных реакций, в результате чего обеспечивается малый расход на-
копленных в клетках веществ. Искусственное охлаждение организма (гибернация) используется в клинике при проведении хирургических операций, так как позволяет снизить расход веществ и сохранить жизнеспособность клеток. Повышение температуры тела при инфекционных заболеваниях ускоряет биохимические реакции в клетках, мобилизуя защитные функции организма, однако расточительное использование эндогенных ресурсов требует их восполнения засчет поступления с пищей. Кроме того, уже при температуре порядка 40°С часть термолабильных ферментов теряет свою активность, что нарушает ход биохимических реакций, тем самым «обезоруживая» организм в химической битве с микроорганизмами. Сведения о термостабильности ферментов используются в практике для разработки температурных режимов хранения продуктов.
рН среды. Изменение рН среды приводит к изменению степени ионизации кислотных и основных групп как активного центра фермента, так и самого субстрата. Следовательно, изменение рН влияет на сродство субстрата к активному центру фермента и на каталитический механизм реакции. Обычно зависимость скорости ферментативной реакции от рН среды имеет колоколообразную форму (рис. 12 б), поскольку для каждого фермента существует свое оптимальное значение рН, при котором фермент проявляет наибольшую каталитическую активность (оптимум рН фермента). Значение рН в оптимуме отвечает наилучшему связыванию субстрата ферментом и наибольшей скорости катализа. Оптимум рН для большинства ферментов лежит в пределах от 6 до 8, однако есть и исключения: например, пепсин имеет наибольшую активность при рН около 2. Количественное определение активности ферментов проводят при оптимальном для данного фермента значении рН.