ВУЗ: Национальный исследовательский томский политехнический университет
Категория: Учебное пособие
Дисциплина: Химия
Добавлен: 09.02.2019
Просмотров: 9498
Скачиваний: 56
151
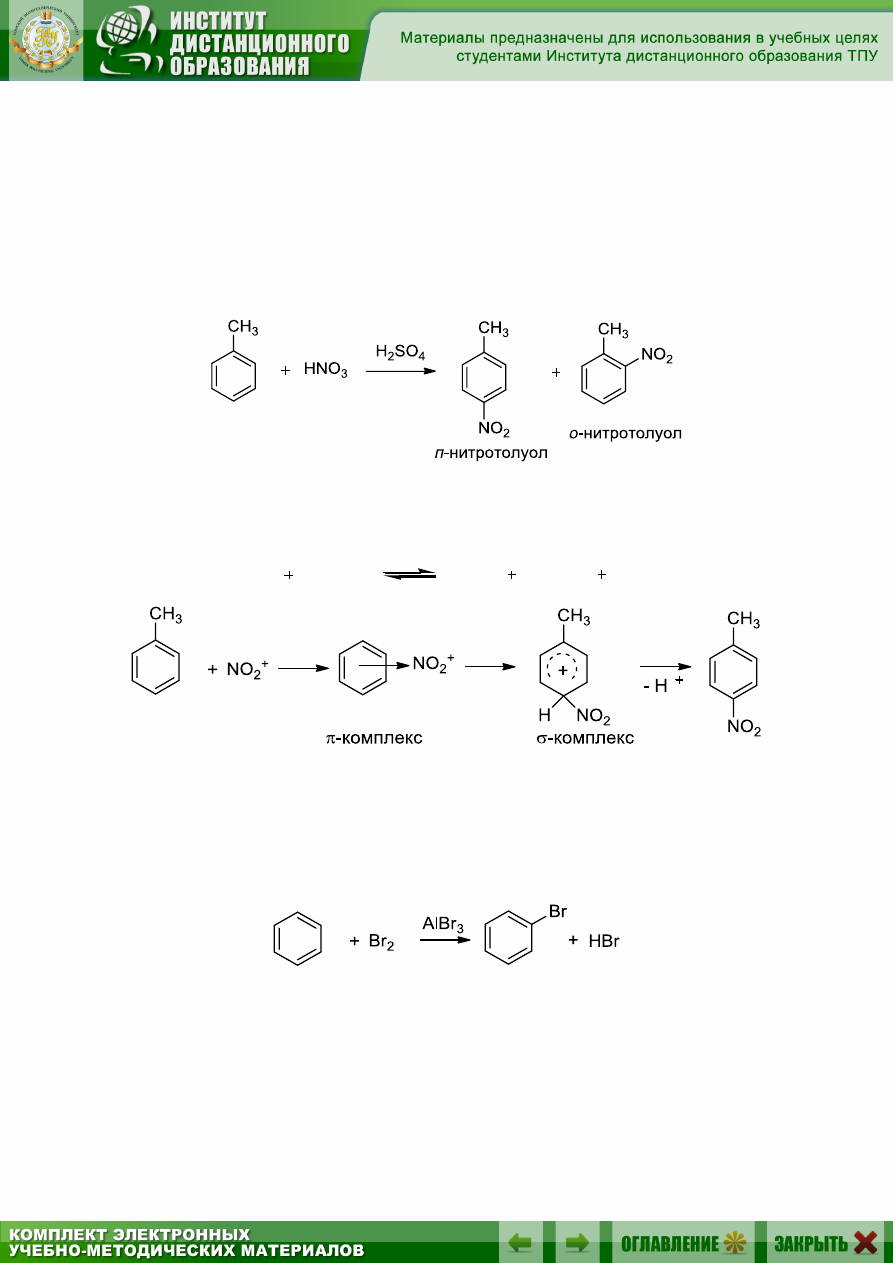
9.5.3.1. Нитрование
Бензол и концентрированная азотная кислота очень медленно реа-
гируют с образованием нитробензола. Скорость взаимодействия значи-
тельно увеличивается при добавлении концентрированной серной ки-
слоты; поэтому нитрование ароматических соединений часто проводят
смесью концентрированных азотной и серной кислот (соотношение 1:2),
называемой нитрующей смесью:
Механизм реакции S
E
:
1. Образование электрофила:
HNO
3
2 H
2
SO
4
NO
2
+
2HSO
4
-
H
3
O
+
9.5.3.2. Галогенирование
Ароматические углеводороды вступают в реакцию с хлором или
бромом с образованием соответствующих галогенопроизводных только
в присутствии каталитических количеств кислот Льюиса:
Роль кислоты Льюиса в данном случае состоит в том, что бром
(или хлор), выступая основанием, отдает электронную пару одного из
атомов галогениду алюминия. В результате происходит сильная поляри-
зация связи Br–Br и один из его атомов становится достаточно электро-
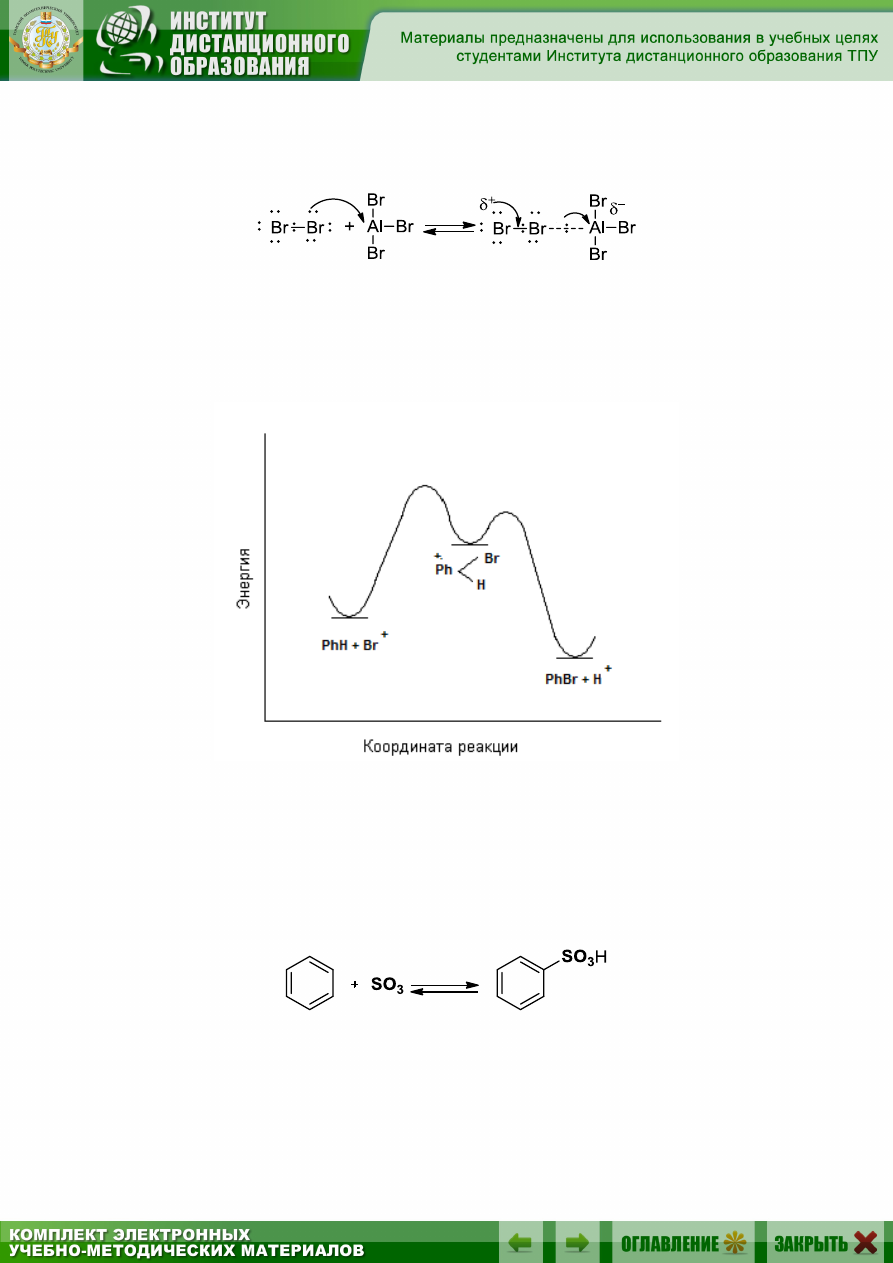
152
фильным, вступая в кислотно-основное взаимодействие с молекулой
брома (или хлора):
Образующийся комплекс и выступает как электрофильный броми-
рующий агент по отношению к аренам, действуя по описанному уже
механизму S
E
.
Изменение свободной энергии в реакции электрофильного броми-
рования можно изобразить следующим способом (рис. 9.2).
Рис. 9.5. Изменение свободной энергии реакции бромирования
9.5.3.3. Сульфирование
Сульфирование ароматических углеводородов можно осуществить,
используя дымящую серную кислоту (серная кислота, содержащая рас-
творенный серный ангидрид SO
3
):
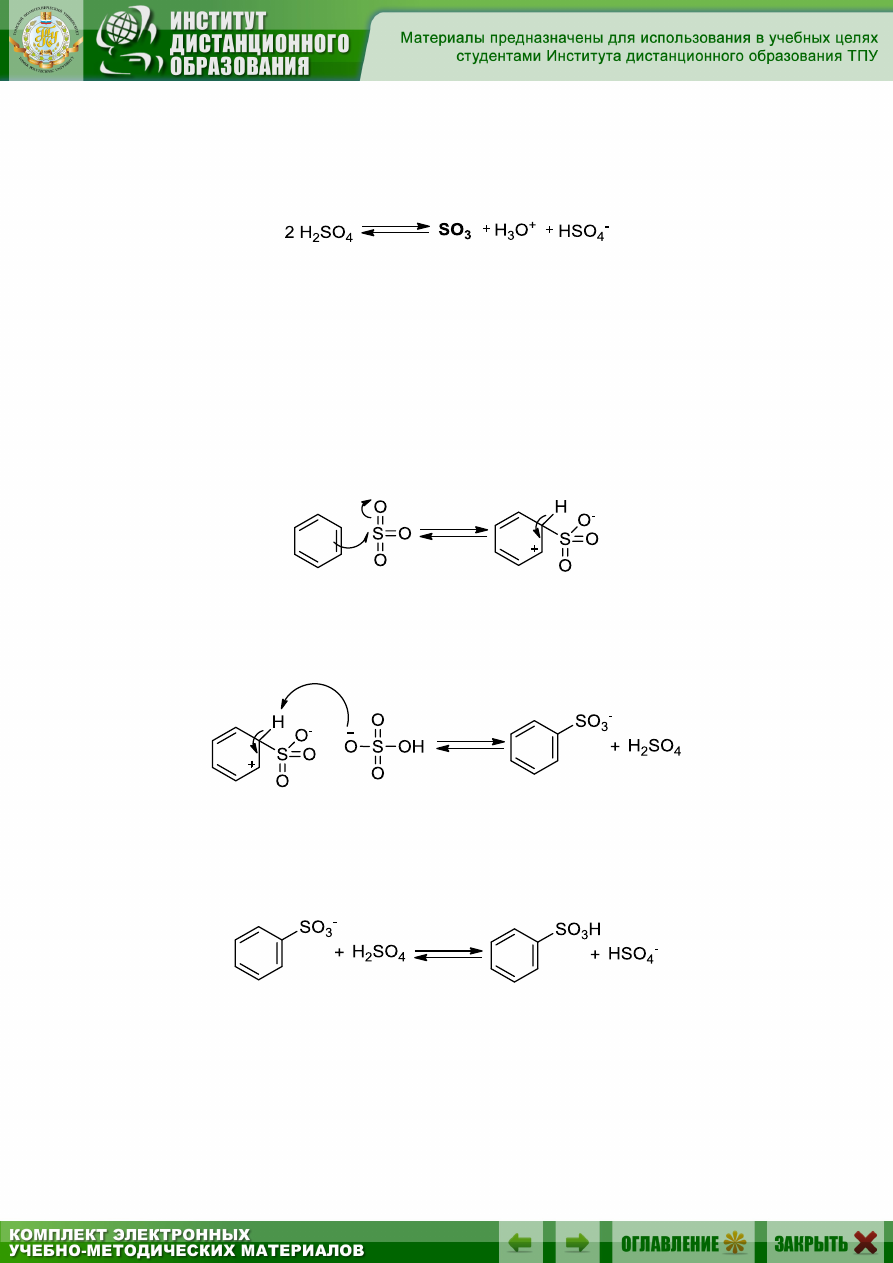
Полагают, что главным сульфирующим агентом в дымящей серной
кислоте является оксид серы (VI) – SO
3
.
153
Даже если для сульфирования используется не олеум, а концентри-
рованная серная кислота, то оксид серы (VI) может образоваться в ре-
зультате равновесной реакции
Процесс сульфирования начинается с того, что молекула аромати-
ческого углеводорода поставляет пару электронов атому серы молекулы
серного ангидрида. Сера ведет себя как акцептор электронной пары по
двум причинам. Во-первых, три (электроотрицательных) атома кисло-
рода, связанные с атомом серы, делают его электрононенасыщенным.
Во-вторых, образующаяся группировка SO
3
резонансно стабилизиро-
вана. Принципиальным отличием механизма сульфирования от меха-
низма других реакций S
E
является обратимость реакции
-Комплекс отщепляет протон с образованием аниона бензолсуль-
фокислоты:
Последним шагом является отрыв анионом бензолсульфокислоты
протона от молекулы серной кислоты с образованием бензолсульфокис-
лоты:
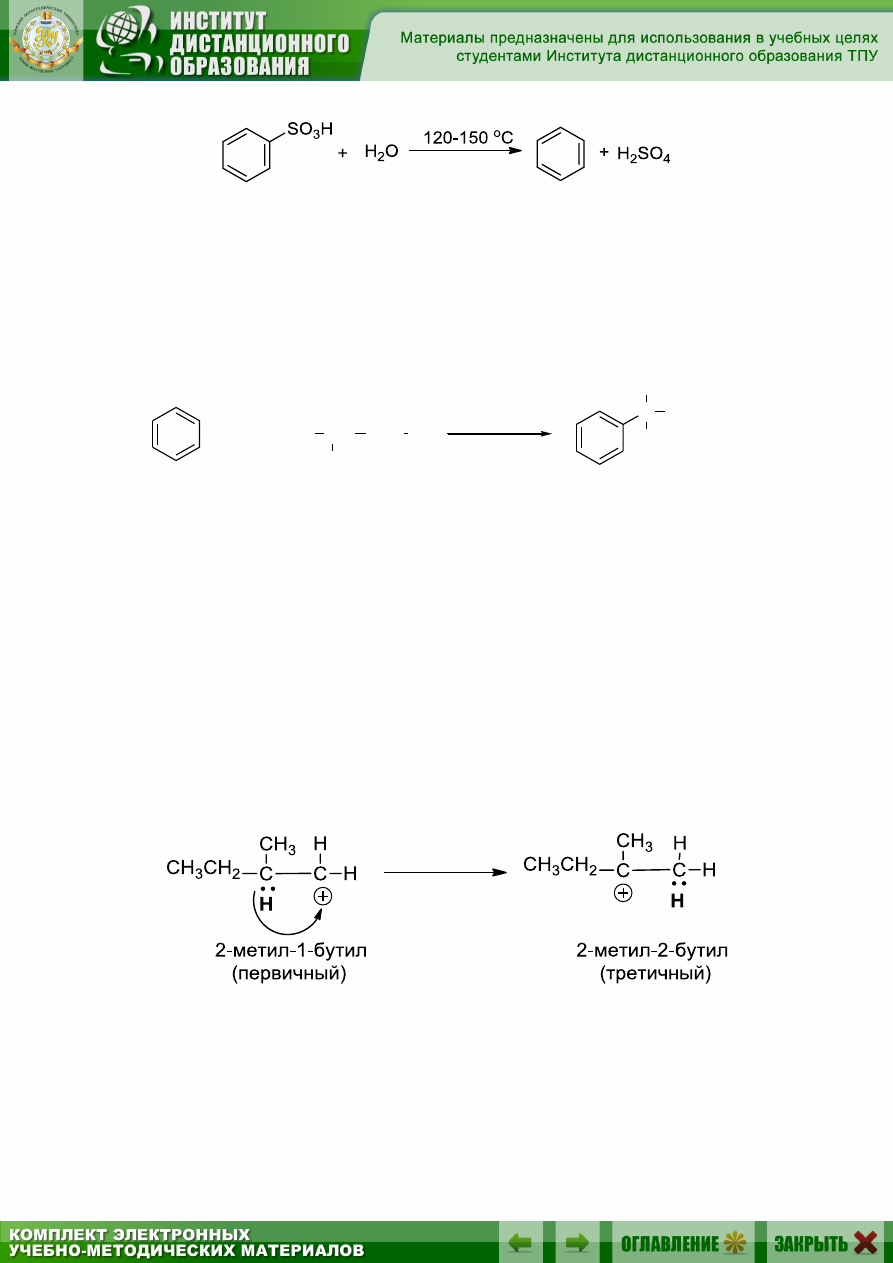
Каждая стадия сульфирования обратима, и в целом весь процесс
является обратимым. При обработке бензолсульфокислоты перегретым
водяным паром происходит обратная реакция – десульфирование:
154
9.5.3.4. Алкилирование по Фриделю – Крафтсу
Алкилирующими агентами в данной реакции могут выступать
алилгалогениды в присутствии кислот Льюиса, а также алкены и спирты
в присутствии сильных кислот. И в том, и в другом случае будут гене-
рироваться карбокатионы, являющиеся алкилирующими агентами:
+
CH
H
3
C
CH
3
CH
2
Br
AlBr
3
C CH
3
CH
3
CH
3
трет-бутилбензол
Данная реакция осложняется тем, что карбокатионы, участвующие
в реакции S
E
, подвержены перегруппировкам с образованием наиболее
устойчивого карбокатиона, который затем и вступает в реакцию с бен-
золом.
Перегруппировки
Известно, что карбокатион может перегруппировываться, и что эта
перегруппировка происходит всякий раз, когда 1,2-перенос водорода
или алкильной группы может привести к образованию более устойчиво-
го карбокатиона, например:
1,2-гидридный сдвиг:
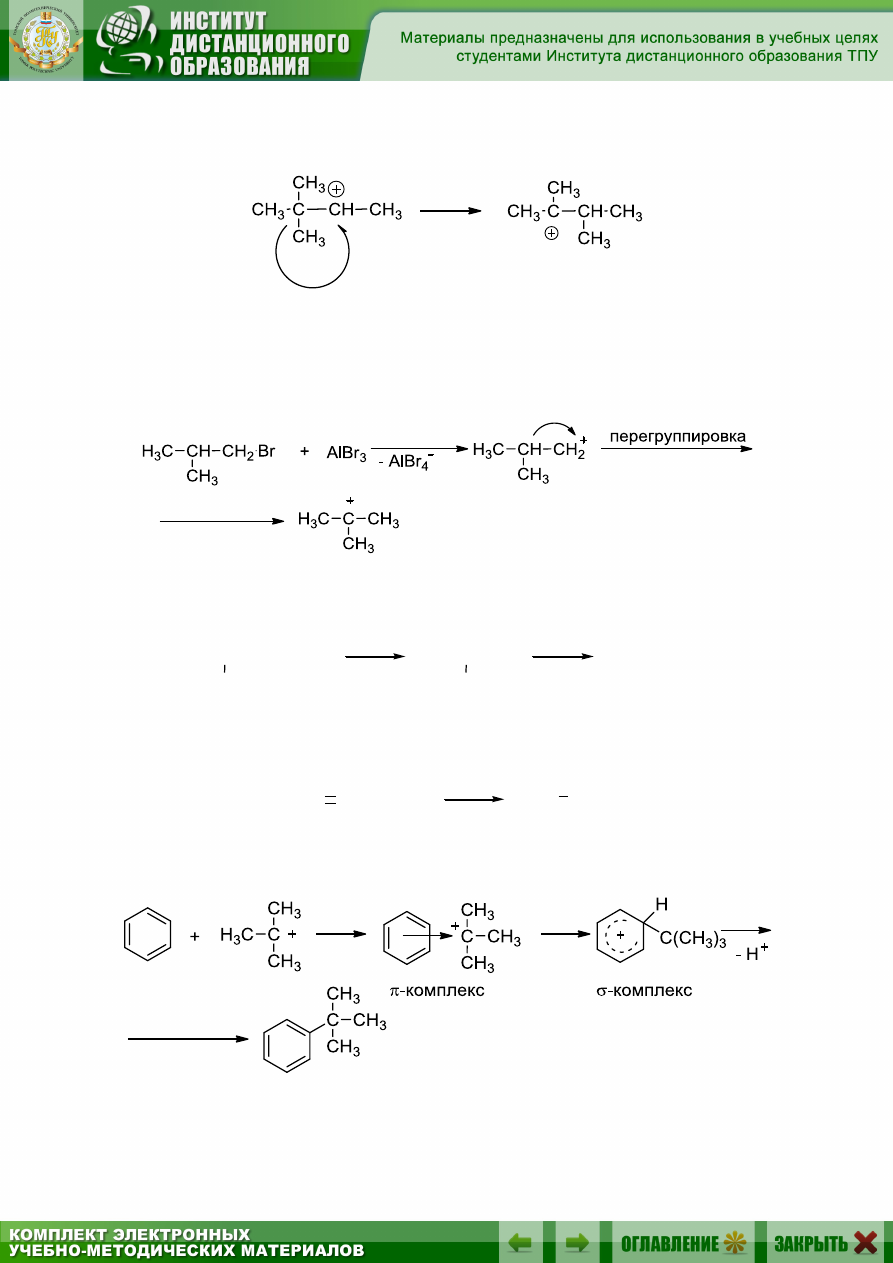
155
1,2-метильный сдвиг:
Механизм реакции алкилирования:
1. Образование электрофила:
а) из алкилгалогенида:
б) из спирта:
-H
2
O
CH
3
-CH-CH
3
OH
+ H
+
CH
3
-CH-CH
3
OH
2
+
CH
3
-CH-CH
3
+
в) из алкена:
CH
2
CH
2
+ H
+
CH
3
CH
2
+
2. Механизм реакции S
E
: